鼻内镜下溯源法切除鼻内翻性乳头状瘤的临床分析
刘永泽,孙飞虎,麻晓峰,陈峰
(南京大学医学院附属鼓楼医院 耳鼻咽喉头颈外科 江苏省医学重点学科 南京鼓楼医院耳鼻咽喉研究所,江苏 南京 210008)
尽管鼻内镜下手术切除鼻内翻性乳头状瘤(nasal inverted papilloma,NIP)已取得不亚于传统鼻外径路的效果且更加微创,但针对如此一种良性肿瘤,内镜手术并未能彻底改变其术后易复发的临床特征,目前多认为肿瘤复发最主要的因素只是术中肿瘤切除不彻底,而最容易发生残留的部位恰恰是肿瘤的起源部[1-2]。学者又发现即便生长非常广泛的NIP,其起源部往往也比较局限,于是产生了追溯并重点处理肿瘤起源部的内镜手术方式[3-4]。我们参考上述手术方式,2013年1月—2017年6月针对71例NIP患者以精准定位和处理瘤体起源为核心制定手术方案,确认此溯源法对控制肿瘤术后复发具有优势,现将我们的经验总结如下。
1 资料与方法
1.1 一般资料
71例NIP患者,男53例,女18例;年龄14~82岁,平均53岁;病程1个月至11年;单侧发病68例,肿瘤侵犯双侧3例。26例系NIP复发患者,本次入院距上次手术时间4个月至11年,平均3.5年,其中既往接受鼻侧切开7例,上颌窦根治术3例,鼻内镜下手术16例。根据Krouse分级Ⅰ级14例,Ⅱ级25例,Ⅲ级28例,Ⅳ级4例。所有患者术前均行鼻内镜及鼻窦CT检查,51例术前行MRI平扫和增强扫描。64例术前活检明确为NIP,7例术中冷冻切片明确为NIP,所有患者都采用鼻内镜下溯源法切除病变。本组不包括伴随癌变患者,也不包括术后常规病理才确诊为NIP的患者。
1.2 手术方法
术前预判肿瘤的起源部位早期我们主要依据CT的骨质异常特征,后期我们更多地采用CT结合MRI的脑回征逆向回溯来推测起源部位[5-6]。术中首先充分收缩鼻黏膜,纱条均匀受力推挤瘤体,除了少数瘤体小或起源于中鼻甲、钩突及鼻中隔等容易暴露部位的KrouseⅠ、Ⅱ级患者,多数NIP患者需要逐步切除瘤体和拓宽手术径路才能暴露肿瘤起源部。内镜下经常面对的是鼻腔鼻窦狭小的空间内充满肿瘤,需要沿瘤体终末端向起源部逐步切除瘤体和切除未被肿瘤侵犯的解剖结构来拓宽手术径路,这两者交替有序进行,切除瘤体前要将这部分瘤体与周围组织分辨清晰,不要损伤正常黏膜,而拓宽径路时则避免动及瘤体,可以用纱条或棉片覆盖保护瘤体,拓宽径路带来的创面及时用双极电凝或低温等离子止血,保持术野的清晰直到最终定位肿瘤的起源部。
术中追溯肿瘤明确其起源于上颌窦内时,我们多选用泪前隐窝径路进入上颌窦腔,因为该径路容易定位并处理肿瘤起源部,再视起源部位所在及范围决定上颌窦内侧壁及鼻泪管的去留。若肿瘤起源部位于额隐窝或额窦内,行DrafⅡb术式自额窦引流通道前下逐步向后上显露,直至追寻到起源部,若肿瘤侵犯到对侧额窦或向外侧侵犯较多,可进一步扩大为或直接行DrafⅢ术式或联合鼻外径路。源自蝶窦的病变,可以通过切除蝶窦前壁甚至部分中隔蝶嘴探查窦腔,但在确认起源部前勿损伤其他窦壁黏膜,以防造成新的难以辨别的创面。
记录肿瘤起源部位,使用不同角度的吸引器测量其直径,距基底周围5 mm紧贴骨质切除瘤体。基底下骨质分两类情况,一类是可以连同肿瘤手术中直接彻底切除,比如中鼻甲,筛窦的非颅底、眶壁结构,上颌窦内侧壁,蝶窦前壁等,另一类是不宜或不便一并切除,需要在彻底去除骨壁表面软组织后,将增生至粗糙并有较多滋养血管出入的骨质先用电刀烧灼止血,再用电钻磨至骨面光滑平顺,特别注意骨连接缝和神经血管出入处要充分打磨。处理完肿瘤起源部后,结合影像学仔细检查有无肿瘤残留,特别是复发型NIP,要防止其可能有不止一处起源部。手术结束时的术腔以随诊时能鼻内镜下方便观察和处理起源部为宜。
术后常规鼻腔冲洗、类固醇激素喷鼻至术腔上皮化。随访主要目的是及时发现和处理肿瘤复发,因此要根据术中记录的肿瘤起源部和处理情况,检查整个术腔特别是起源部有无可疑新生瘤样组织,术后1~2个月,新生的上皮组织和残留复发的肿瘤组织间着较明显的形态颜色对比,也易于切除送检,必要时可在再次适当扩大切除新生上皮至骨壁。此后每月复查1次,半年后每3 个月复查1次,并逐渐延长随访周期,但不宜超过半年。
1.3 统计学方法
应用 SPSS 26.0 软件,对复发率的比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 术前影像学检查预测
本组71例患者,术中能精确定位肿瘤唯一起源部67例(94.4%),例如图1术前CT提示肿瘤起源于筛窦骨质,图2术前CT提示肿瘤起源于上颌窦前壁,图3术前CT提示肿瘤源于上颌窦顶壁与后壁交界处,均在术中得以证实。1例复发型患者在上颌窦和筛窦有不连续的起源部;1例复发患者和1例初发患者肿瘤起源部位过于弥漫累及不止一个窦腔或一个窦腔多个窦壁,内镜下无法准确区分与周围黏膜组织的界限;1例源自额隐窝或前筛的初发NIP患者,在暴露起源部前对周围组织切除致界限不清,从而无法准确定位肿瘤起源部。
2.2 术中探查发现
67例术中准确定位具有唯一起源部的NIP患者,发现上颌窦来源28例(41.8%),筛窦来源24例(35.8%),额隐窝及额窦来源10例(14.9%),蝶窦来源3例(4.5%),鼻中隔来源2例(3.0%)。起源部位的直径为5~28 mm,平均值10.1 mm。4例患者术中未能精确定位。
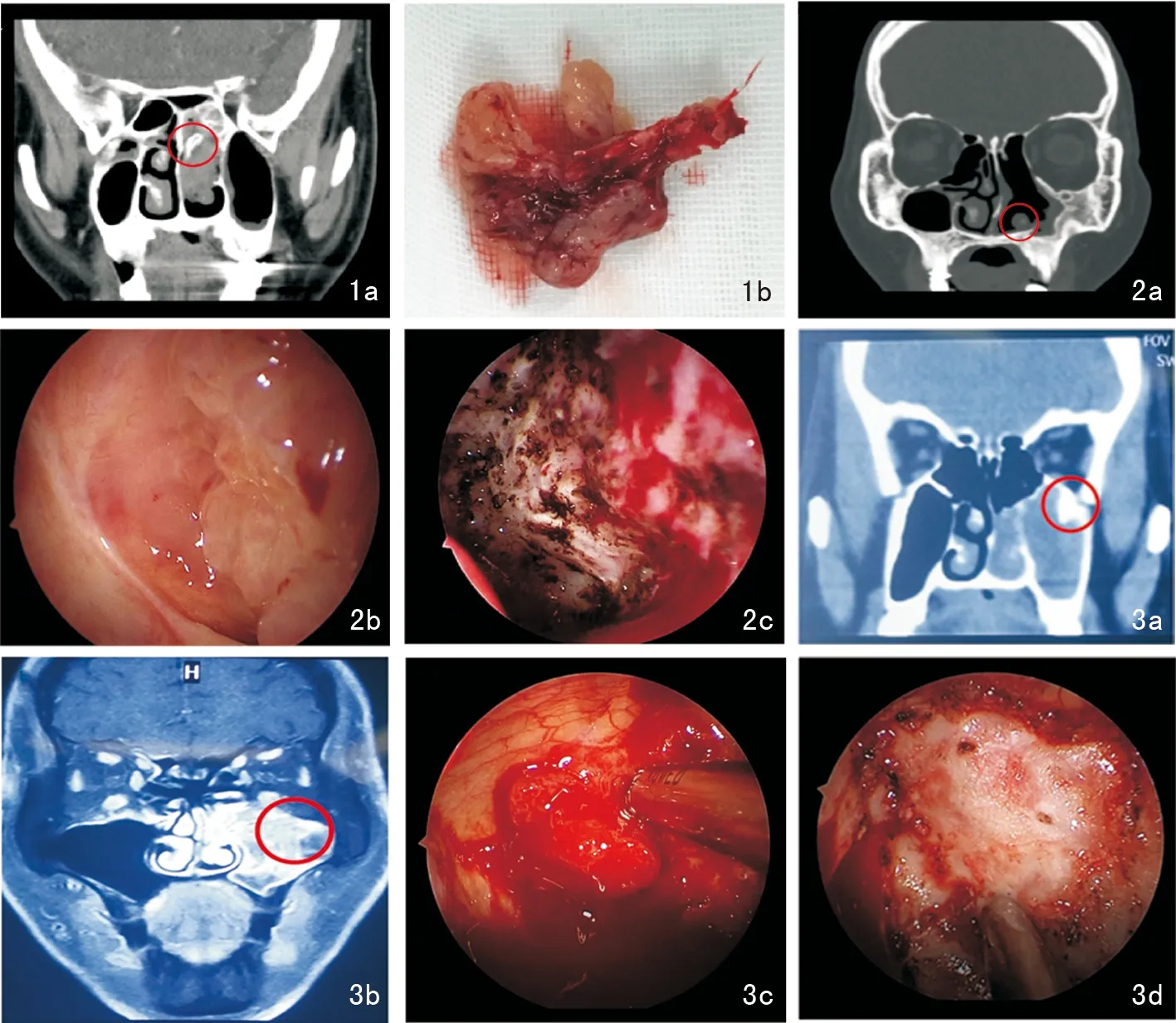
图1 左侧筛窦乳头状瘤 1a:鼻窦冠状位CT中红色圆圈处示乳头状瘤根蒂骨质部位于左侧后组筛窦; 1b:术中将肿瘤根蒂骨质连同附着肿瘤组织一并取出 图2 左侧上颌窦前壁复发型乳头状瘤 2a:鼻窦冠状位CT红色圆圈处示肿瘤位于左侧上颌窦前壁; 2b:术中所见乳头状复发肿瘤组织; 2c:完整切除肿瘤组织,并用磨钻将附着骨质磨除 图3 左侧上颌窦乳头状瘤 3a:鼻窦冠状位CT红色圆圈处示肿瘤根蒂位于左侧上颌窦顶壁与后壁交界处; 3b:鼻窦冠状位MRI红色圆圈,脑回征所指向处为肿瘤根蒂部位; 3c:术中将肿瘤切除后暴露肿瘤根蒂骨质部; 3d:完整切除肿瘤组织,并用磨钻将附着骨质磨除
2.3 术后并发症及处理
本组患者无眶内及颅内并发症,无术中术后严重鼻出血,5例(5/7)肿瘤起源于上颌窦内侧壁患者切除鼻泪管,术后无泪道阻塞溢泪患者,2例(2/5)肿瘤起源于上颌窦上壁患者术后出现眶下面部麻木。1例肿瘤源于额隐窝患者行DrafⅡb术式,术后3个月出现额窦闭锁,由于患者无明显症状和肿瘤复发,且不愿再次手术,目前随访已2年。
2.4 术后随访情况及患者疗效
术后1年内4例复发,复发率为5.6%,其中术中能精确定位唯一起源部的NIP患者1年复发率为3.0%(2/67),而不能精确定位者复发率为50.0%(2/4),复发肿瘤的起源和原起源区域基本吻合,复发于上颌窦1例,纸板1例,额隐窝1例,蝶窦1例。能精确定位起源部位的复发率与未能精确定位起源部位的复发率相比较,差别具有统计学意义(P=0.014)。
3 讨论
作为鼻腔鼻窦最常见的良性肿瘤,NIP的年发病率约为0.6~1.5/100 000。以往外径路经鼻侧切开或面中翻切除内侧上颌骨是其标准手术入路,自1992年Waitz报道应用内镜切除NIP以来,随着设备和技术的发展,即便传统上认为内镜下困难部位的肿瘤如上颌窦前壁和底壁,现在也可以做到彻底切除[7]。大量文献也表明内镜手术有不低于传统鼻外径路的手术疗效[8-9]。由于NIP具有术后易复发的特性,因此评价手术疗效的最核心指标即为术后复发率,有一项针对2007—2013年不同手术方法治疗1 385例NIP患者的比较研究[10],术后总体复发率为11.5%,其中内镜手术、联合径路及鼻外径路手术的复发率分别为11.1%,12.0%和14.2%,内镜手术复发率与另两种径路手术分别相比均无明显差异。而内镜下通过寻找起源部的手术方式其复发率只有6.9%,要明显优于其他方式。
即便能够做到,内镜手术也不应该是通过比鼻外径路更广泛地切除获得宽大的术腔来显示其优越性,对于NIP,有时肿瘤虽然会占据较大的鼻腔鼻窦空间,但其起源部往往只是一个不成比例的细蒂,瘤体只是由于其边缘在生长过程中被不断推挤而占据这些空间,而不是与周围接触的黏膜有着真正的组织连接,因此手术只需重点处理肿瘤起源部而避免过度的瘤周组织切除[4]。找到肿瘤起源部,需要在周围内镜下正常黏膜做扩大切除,有扩大范围为8~10 mm[4],我们考虑到针对一种良性肿瘤5 mm的切缘应该满足要求,同时要切除或部分磨除起源部黏骨膜下骨质,因为骨缝隙内可能有上皮组织残留甚至骨质直接被肿瘤侵蚀[11]。本组病例术后1年内有4例复发,复发部位全部在起源部或邻近起源部,这既进一步证明术中重点处理肿瘤起源部的价值,也反应出我们在判断和处理起源部仍存在不足。
首先,术中仅凭内镜下肉眼判定肿瘤的边界和骨质是否健康并非可靠。目前有越来越多的文献推荐使用术中快速冷冻切缘[4,12],Miglani术前通过CT预判NIP起源,又在术中定位所有患者起源部,切除肿瘤后在起源部周围送环形快速冷冻切缘直至病理组织阴性,结果表明27%患者首次切缘为阳性,22例患者术后平均随访40个月零复发[12]。分析其原因可能是黏膜下生长的肿瘤在其黏膜表面病变并不明显,内镜下清晰的视野反倒会导致误判。其次,对于复发型患者和伴随明显急慢性炎症患者,既往手术后的瘢痕、息变或充血肿胀的黏膜组织既然妨碍对肿瘤起源部的准确定位,那么就很难保证术中肿瘤的彻底切除。复发型患者由于种植或瘢痕分隔,有时会出现病变不连续的多中心生长,加之厚厚的瘢痕也会妨碍对肿瘤边界的判断,这些都不利于肿瘤切尽。炎症的出血和组织的增厚不平同样也是不利因素,因此对于有明显炎症或感染表现的患者,我们建议术前要尽量控制炎症。第三,早期对额窦及额隐窝的处理缺乏经验,术野拓展不足,既影响肿瘤起源部的准确定位和顺利彻底切除,又容易发生术后瘢痕闭锁,影响随访观察。
要准确定位肿瘤起源部,有时光通过追踪切除瘤体是不够的,特别是肿瘤源发于上颌窦及额窦时。多角度的刨吸刀头和鼻科钻头为更加微创地暴露窦腔内NIP起源部,切除瘤体,磨除其下骨质提供便利,依据肿瘤原发于上颌窦的具体窦壁,决定上颌窦内侧壁切除的范围[13]。根据我们的经验,除了肿瘤起源局限于上颌窦窦口周围或后外侧壁的内侧,扩大自然口不能保证肿瘤切除的彻底性,而鼻泪管前径路结合上颌窦内侧壁和前壁的选择性切除,可以做到上颌窦内各壁肿瘤的清除,因此对于术前影像学提示肿瘤起源于经自然口难以处理部位,或肿瘤充满窦腔而影像学难以判定起源的患者,我们优先选择直接经鼻泪管前径路。无论何时影像学显示额窦内有广泛肿瘤侵犯时,都要做好鼻外联合径路的准备,肿瘤自筛窦指状突入额隐窝或额窦,采用DrafⅡa术式开放额窦,若肿瘤起源自额隐窝,需采用DrafⅡb术式,肿瘤起源于额窦后壁黏膜适合DrafⅢ术式[8]。相比起炎性病变更激进的额窦引流通道处理,不仅是明确辨别和彻底切除肿瘤的需要,瘤体起源部下方的骨质常有增厚、粗糙、滋养动脉出入,因此需要大量磨除局部增生骨质,也需要预防术后瘢痕粘连闭锁。
本组术后1年有4例患者复发。对此我们的总结是,术中准确定位并记录肿瘤起源部,将起源部及其下骨质的处理区域控制在尽可能小的范围,一则能专注于处理区域的彻底清除,减少大面积的切除和骨质打磨带来的局灶遗漏可能,还可以获得清晰的黏膜对比,易于判断再次上皮化过程中的异样组织。减少黏膜切除特别是其下骨质磨除的范围,有利于术后术腔的清洁、减少局部痂下感染及肉芽生长,相比起水肿囊泡,肉芽更容易与残留生长的局灶NIP相混淆,而且减少后期瘢痕的面积和厚度,也有助于及时发现并处理复发,因为我们在处理复发型NIP时,埋藏于瘢痕下的肿瘤并不少见。此外,保留相对宽敞的径路,便于术后随访和处理也很重要,尤其对起源部基底较大或不能准确定位患者。
在追溯NIP起源的经验积累过程中,我们更加明确一个观念,NIP术后的复发最大的原因只是手术残留,而溯源法则能很好的兼顾到微创和疗效,减少起源部的骨缝和骨质内残留,减少种植残留,随访时及时处理局灶残留。因此相比起常用的Krouse分期,有专家建议分期应取决于肿瘤的基底部,而不是其体积[7],即肿瘤起源部是否明确,范围及可达到难易度。复发型NIP之所以手术再复发率高,很大程度上是因为瘢痕及解剖结构改变影响到对起源部的准确判断。至于人类乳头状瘤病毒与NIP的发病关系一直存在争议,有认为在乳头状瘤和邻近的正常黏膜的细胞中已发现人类乳头状瘤病毒的DNA,手术去除邻近看似正常的黏膜可降低复发[7],但近来又有不少文献否定人类乳头状瘤病毒在NIP发病中的作用[14],而我们更愿意采信后者,肿瘤的复发跟黏膜下生长的肿瘤残留有关[12],因此今后术中要更多的取送冷冻切缘。依赖术中冷冻切片明确鼻腔病变性质却不值得推荐,本组有11例术中才明确诊断的患者,术前通过影像学检查多已高度怀疑NIP,只是因为中隔明显偏曲,或病变在鼻腔内不明显或显露部分极似息肉,但这也增加不确定性和复发的风险。

