高校化学实验室废水中Cu2+的绿色化处理研究

摘要:本文采用泡沫分离技术,对高校基础实验室含铜废水进行了处理,重点考察了表面活性剂种类及浓度、分离时间、进气速度、pH等因素对分离效果的影响,结果表明,在最佳操作条件下:Cu2+的富集比为1.64,回收率达到46.3%。
关键词:表面活性剂;铜离子;泡沫分离
泡沫分离技术,又称泡沫吸附分离技术,是一种新型的分离技术。在化工、生化、医药、污水处理等领域,它的应用和发展前景都十分广阔[1-2]。泡沫分离技术具有能耗低、设备简单、投资小、分离效果好等优点[3]。与其它分离方法相比,泡沫分离更适于回收微量组分,研究表明,当金属离子浓度为1.0×10-6 mol/L时,都可以将其分离出来,尤其适用于贵重金属和稀有金属离子的回收利用[4],该方法对稀有金属回收利用、改善生态环境、降低企业生产成本等有重要作用。
本文以高校基础化学实验室含硫酸铜废水为研究对象,采用泡沫分离技术,先考查不同表面活性剂种类及浓度、进气速度、分离时间等单因素对Cu2+分离结果的影响,在此基础上设计正交实验对上述因素进行综合考查,以富集比和回收率作为考察指标,筛选出Cu2+的最优分离条件。
1 实 验
1.1 主要材料及设备
硫酸铜,十二烷基磺酸钠(SDS),十六烷基三甲基溴化铵(CTMAB),盐酸,氢氧化钠;TAS-990原子吸收分光光度计, PHS.3C型精密pH计,LZB转子流量计,空气压缩机,泡沫分离塔。
1.2 实验方法及过程
25 ℃时用自制滴管测定SDS、CTMAB的临界胶束浓度分别是:9.1 mol/m3、2.6 mol/m3,与文献值差别不大[4],在下面的实验中,表面活性剂的配制都按照实验值计算、称量。实验在自制泡沫分离塔中进行,塔高130 cm,下部直径4.6 cm,上部直径6.5 cm,柱高132 cm。塔底部装有孔板型分布器,孔直径70 μm,间距8 mm,等边三角形排列。在塔内加入一定量已处理的实验室废水(主要成分硫酸铜)与适量表面活性剂的混合溶液,由空气压缩机将气体打入分离塔,气体由塔底部的孔板型分布器分散至溶液中,将泡沫由导管从塔顶导出并收集、消泡,每组实验平行测定三次。
用原子吸收分光光度计测量Cu2+吸光度,并在标准曲线上由吸光度值得到相应的Cu2+浓度。曲线方程为:A=0.2067c-0.0014。
2 结果与讨论
2.1 单因素实验
2.1.1 表面活性剂筛选
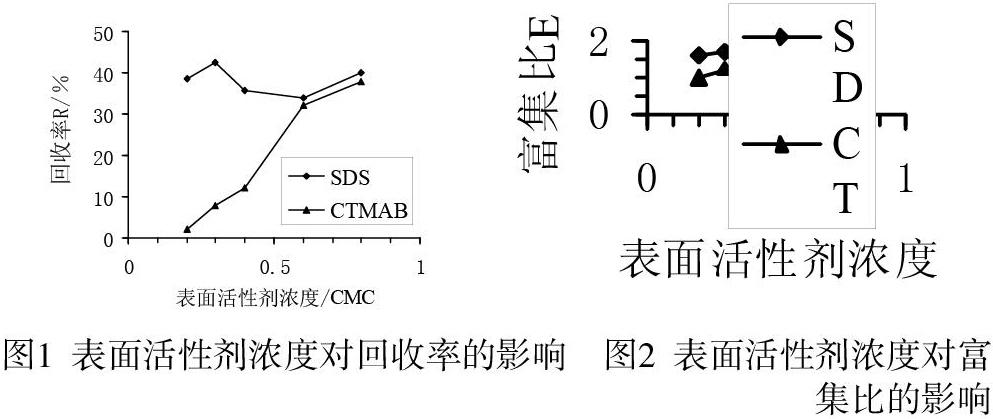
取1L含50g/m3的Cu2+和不同浓度SDS、CTMAB的混合溶液,进气速度固定为0.06 m3/h,装液量200 cm3,分离时间10 min。室温下对铜离子进行泡沫分离实验,分离结果如图1、图2所示。
上图表明,SDS分离效果优于CTMAB,当SDS浓度为0.3 CMC时,富集比回收率都出现最大值。随着表面活性剂浓度增加,泡沫量越来越多,泡沫夹液量也增大,使得泡沫液中铜离子浓度降低,富集比反而下降。故表面活性剂用SDS,浓度为0.3 CMC。
2.1.2 分离时间的影响
取1000 cm3含50g/m3 Cu2+和0.3 CMC的SDS混合溶液,设定分离时间10min,进气速度0.08 m3/h,装液量为 200 cm3,室温下考察不同分离时间对分离效果的影响。实验结果如图3所示。
图3结果表明,随着时间变化富集比出现下降趋势,而回收率变化则是先增后减,因为在泡沫分离的初始阶段,溶液中存在大量的表面活性剂,产生了大量细密均匀的泡沫,气-液接触面积大,金属离子大量吸附在气泡表面,富集比较大;随着分离的进行,溶液中表面活性剂减少,泡沫产生量减少的同时泡沫体积变大,气-液接触面积变小,金属离子吸附量减小,所以富集比降低;同时由于气泡间隙大,泡沫排液速度变快,泡沫液体积变大,使得回收率呈上升趋势[5-6]。
2.1.3 进气速度的影响
取1000 cm3含50 g/m3 Cu2+和0.3 CMC的SDS混合溶液,装液量为200 cm3,于室温控制不同的进气速度,结果如图4所示。
由图4可知,进气速度较小时,富集比较大,這是因为气体流量较小时,气泡在溶液中的停留时间长,气-液界面传质充分。随着进气速度增大,气泡停留时间缩短,气-液传质不充分,泡沫的夹液量变大,泡沫中金属离子减少,富集比下降,即气体流量对泡沫分离体系的影响主要表现为塔内流体力学特性的改变[7-8]。综合富集比和回收率及动力消耗,0.08 m3/h为适宜的进气速度。
2.1.4 初始浓度的影响
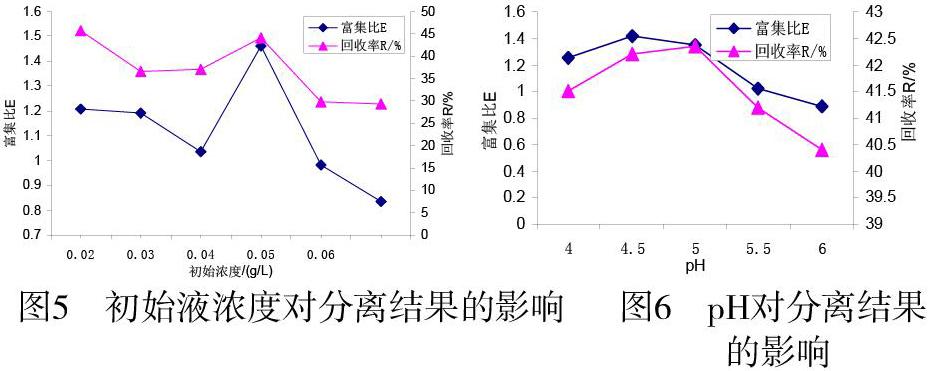
分别配制Cu2+初始浓度为0.02、0.03、0.04、0.05、0.06g/L的硫酸铜溶液,与浓度为0.3 CMC的SDS混合,设定进气速度0.08 m3/h,装液量200 cm3,分离10分钟,室温下比较分离效果,结果如图5所示。
由图5可知,当初始液浓度小于0.04g/L时,富集比和回收率都要高于高浓度范围(0.05-0.06g/m3)的,当Cu2+初始浓度为0.05g/L时,富集比和回收率均达到最大值。根据富集比计算公式,金属离子初始浓度越低,即分母越小,分数值越高这与许多文献结论相同[7]。
2.1.5 pH的影响
取1000 cm3含50 g/m3 Cu2+和0.3 CMC的SDS混合溶液,200 cm3装液量,进气速度0.08 m3/h,分离10min,以HCl和NaOH将混合液pH控制在4.0至6.0,室温下进行实验,分离结果如图6所示。
图6结果表明,pH较小时,H+浓度较高,根据静电吸附原理,H+与SDS形成络合物吸附在气泡表面,与Cu2+发生竞争吸附,所以Cu2+去除效果不理想。随着pH升高,竞争吸附减少,回收率增大,富集比降低。由此可见,pH不仅影响金属离子与表面活性剂结合方式,还会影响泡沫的夹带率和金属离子的去除率[9]。
2.2 正交实验结果
在单因素实验基础上,选取4因素进行实验,各因素都取4水平,结果如下。
因泡沫分离技术在重金属离子回收领域应用较多,所以以回收率R为考察指标,对上述正交实验结果进行极差分析,结果如下表所示:
在上表中,J 越大,表示该因素对回收率的影响越大[10]。由极差大小可知,影响泡沫分离铜离子的4个实验因素的主次关系为:C(初始浓度)> B(进气速度)> D(分离时间) >A(表面活性剂浓度)。根据极差结果,较好的实验条件是A1B2C1D4,在此条件下进行追加实验,得到富集比为1.64,回收率为46.3%,综合起来比正交实验中的效果好。
3 结论
(1)用泡沫分离法去除废水溶液中的Cu2+是一种有效的方法,泡沫分离法除去金属离子要受表面活性剂种类及浓度、进气速度、分离时间、金属离子初始液浓度、pH值、装液量等多种条件的影响。
(2)通过单因素及正交实验追加实验,确定Cu2+的最佳分离条件为:用浓度为0.3 CMC的十二烷基磺酸钠,设定进气速度0.08 m3/h,Cu2+初始浓度为10 g/m3,200 cm3装液量,于室温下分离10min,在此条件下富集比为1.645,回收率为46.3%。
参考文献
[1]段睿,王立和,杨翠英.常温中和铁氧体法处理高浓度含铜废水的研究[J].工业水处理,2013,33 (5):31-34
[2]孙景辉.泡沫相分离塔分离蛋白质的工艺标准研究[J].工业水处理,2016,9 (1):27-30
[3]殷昊,赵艳丽,李雪良,吴兆亮.泡沫分离设备及工艺的研究进展[J].食品工业科技.2010,8:16-19
[4]刘颖,木泰华,孙红男.泡沫分离技术在食品及化工业中的应用现状[J].食品工业科技.2013,13:52-54
[5]胡滨,朱海兰,吴兆亮.气体分布器孔径对泡沫分离过程影响的研究[J].高校化学工程学报.2014.2:61-64
[6]李軒领,张炜,陈元涛,陈亮.亚麻籽饼粕中亚麻蛋白的初步泡沫分离[J].河南工业大学学报(自然科学版).2015,1:22-24
[7]柴茂权.泡沫分离法除去水中的微量硫酸铜[J].科技创新与应用.2016,19(2):56-58
[8]刘茉娥,陈欢林.新型分离技术基础[M].杭州:浙江大学出版社.1993:145-165.
[作者简介] 王玉美(1984-),女,山东寿光人,硕士研究生,主要研究方向为环境治理。
[基金项目] 潍坊科技学院2018年度校级课题科技类(项目编号:2018KJWZ04),2018年度山东省高等学校科研创新平台课题(项目编号2018YY035)
(潍坊科技学院 山东 寿光 262700)

