基于金黄色葡萄球菌FnBPA 和停乳链球菌GapC 的多表位疫苗免疫原性研究
马骏,王然,刘硕,王欣,段旭阳,陈晶,杨思宇,王丽,刘慧婷,范钊伟,崔玉东
(黑龙江八一农垦大学动物科技学院,大庆 163319)
奶牛乳腺炎是奶牛最常见的疾病,严重危害奶牛健康和奶业的发展。奶牛乳腺炎主要是由细菌乳腺内感染(IMI)引起的,而金黄色葡萄球菌和链球菌是引起奶牛乳腺炎的常见重要病原体[1-2]。尽管在世界各地的一些奶牛场采取了乳腺炎控制计划,但在过去的几十年中对奶牛乳腺炎仍然以抗生素治疗为主[3]。然而,随着金黄色葡萄球菌和链球菌抗生素耐药菌株的大量增加以及消费者对无抗生素牛奶的需求,使用抗生素治疗和控制奶牛乳腺炎受到严格限制。因此,研究和开发有效的疫苗来预防奶牛乳腺感染越来越引起人们的关注。目前人们研究奶牛乳腺炎疫苗主要是亚单位疫苗,并且多种抗原蛋白融合诱导的免疫保护作用优于单一抗原蛋白[4]。奶牛乳腺炎由多种致病菌引起,单一抗原亚单位疫苗无法满足奶牛乳腺炎免疫预防需要,奶牛乳腺炎疫苗应当包含多种致病菌的抗原。但是由于表达抗原蛋白的载体容量有限,无法同时表达多个抗原蛋白。表位是有效诱导免疫应答的基本成分,一般T 细胞表位为8~16 个氨基酸的线性短肽,线性B 细胞表位多为6~9 个氨基酸短肽。表位串联而制成的表位疫苗具有能够容纳多个抗原表位、预防多种病原感染的优势,且具有安全、稳定、高产、可以选择性地诱导免疫应答类型[5]。以往研究表明[6-7],金黄色葡萄球菌纤连蛋白结合蛋白A(FnBPA)参与金黄色葡萄球菌的早期黏附,能够诱导良好的细胞免疫应答和体液免疫应答;另据报道[8-9],使用重组的停乳链球菌甘油醛-3-磷酸脱氢酶C(GapC)进行免疫,可以对停乳链球菌、无乳链球菌和乳房链球菌提供交叉保护。进一步研究表明[10],GapC 蛋白的 1 至 150 位的氨基酸序列(GapC1-150)可诱导免疫小鼠产生与GapC 全蛋白相同的抗无乳链球菌、停乳链球菌和乳房链球菌的免疫应答和免疫保护作用。通过生物信息学分析显示,这三种链球菌的GapC 蛋白的1 至150 位氨基酸同源性高达94%。
为了探索能够诱导细胞和体液免疫应答,且能够同时预防金黄色葡萄球菌和链球菌引起的奶牛乳腺炎的表位疫苗,前期以金黄色葡萄球菌FnBPA的 CD4+T 细胞表位 FnBPA488-505和 B 细胞表位FnBPA352-364、FnBPA763-772构建了多表位疫苗 FTB1B2;以停乳链球菌GapC 的CD4+T 细胞表位GapC63-77和B 细胞表位 GapC30-36、GapC97-103构建了多表位疫苗GTB1B2,并证明这两个多表位疫苗均能诱导良好的细胞免疫应答和体液免疫应答,且能抑制金黄色葡萄球菌及停乳链球菌在免疫小鼠各器官的定殖量。实验将表位疫苗FTB1B2 和GTB1B2 串联,通过小鼠模型评估多表位疫苗的免疫原性和保护效果,为设计研究预防金黄色葡萄球菌和链球菌感染的通用型奶牛乳腺炎多表位疫苗提供参考。
1 材料与方法
1.1 菌株和实验动物
金黄色葡萄球菌Newman、停乳链球菌LS0312、重组菌株 BL21(DE3)/pGEX-6p-1(+)/FTB1B2、BL21(DE3)/pGEX-p-1(+)/GTB1B2 、BL21(DE3)/pGEX-p-1(+)/FT、BL21(DE3)/pGEX-p-1(+)/GT 由实验室构建并保存。6~8 周龄雌性SPF BALB/c 小鼠购辽宁长生生物技术有限公司。
1.2 主要试剂
限制性内切酶BamHⅠ和XhoⅠ购自TaKaRa 宝生物工程有限公司;Goat anti-mouse IgG-HRP 及弗氏佐剂购自Sigma 公司;红细胞裂解液购自碧云天生物公司;CCK-8 购自同仁化学研究所;RPMI-1640 培养基、胎牛血清(FBS)及青霉素-链霉素双抗购自GIBCO 公司;GST-binding-resin 纯化柱购自天地人和生物科技有限公司;小鼠IFN-γ、IL-4 和IL-17A预包被ELISA 检测试剂盒购自北京达科为生物有限公司。
1.3 实验方法
1.3.1 表位疫苗的设计
实验室前期筛选了FnBPA 的一个CD4+T 细胞表位FnBPA488-505(FT)和GapC 的一个CD4+T 细胞表位GapC63-77(GT),并且实验已经构建了FnBPA 多表位肽FTB1B2 和GapC 多表位肽GTB1B2。使用GSGSGS 作为蛋白 Linker,串联 FT、GT,构成 FGT 多肽;串联FTB1B2、GTB1B2,构成FG 多肽。使用DNA-works 将表位肽的氨基酸序列转换成核苷酸序列并进行密码子优化。在序列的上下游分别加入BamHⅠ和XhoⅠ酶切位点。由吉林省库美生物科技有限公司合成基因。
1.3.2 重组表位原核表达载体的鉴定
将合成含有目的基因的重组质粒分别命名为pGEX-6P-1(+)-FGT、pGEX-6P-1(+)-FG。将合成的重组质粒转化到感受态细胞BL21(DE3)中,提取重组质粒后,使用限制性内切酶BamHⅠ和XhoⅠ对含有目的基因的重组质粒37 ℃酶切3 h,酶切产物经2%琼脂糖凝胶电泳进行分析。将鉴定正确的重组菌株等体积加到50%甘油溶液中,混匀后冻存于-80 ℃。
1.3.3 重组表位的表达纯化及多肽的合成
活化重组菌株 BL21(DE3)/pGEX-6P-1(+)/FGT、BL21(DE3)/pGEX-6P-1(+)/FG、BL21(DE3)/pGEX-6P-1(+)/FT、BL21(DE3)/pGEX-6P-1(+)/GT、BL21(DE3)/pGEX-6P-1(+)/FTB1B2 和 BL21(DE3)/pGEX-6P-1(+)/GTB1B2,1∶100 转接至 Amp+LB 培养基,培养至 OD600为 0.6~0.8,加入终浓度 1 mM·mL-1的IPTG,继续培养4 h,超声破碎后,使用GST-binding-resin 纯化柱纯化重组蛋白并进行SDS-PAGE 分析,将目标蛋白装到透析袋中,于PBS 中4 ℃过夜透析,将蛋白稀释或浓缩至 1 mg·mL-1,放在-80 ℃冰箱备用。由上海楚肽生物有限公司合成FT、GT、FTB1B2和GTB1B2 多肽。
1.3.4 小鼠免疫接种及攻毒
将6~8 周龄的雌性BALB/c 小鼠随机分为8 组,每 组 10 只 小 鼠 。 纯 化 的 FT、GT、FGT、GTB1B2、FTB1B2、FG 和GST 蛋白与等体积的弗氏完全佐剂混匀乳化,对小鼠后腿部肌肉注射免疫接种,免疫剂量为100 μg·只-1。初次免疫后3 周,将蛋白与弗氏不完全佐剂混匀乳化,免疫接种小鼠。加强免疫后2周,每组选取3 只小鼠腔注射1×108CFU 的停乳链球菌LS0312;每组选取3 只小鼠腹腔注射2×109CFU 的金黄色葡萄球菌Newman,攻毒后48 h 检测小鼠各组织脏器的细菌定殖情况。
1.3.5 分离小鼠的脾淋巴细胞
加强免疫后一周,每组取3 只,无菌取脾脏,在200 目尼龙网上研磨脾脏,使用红细胞裂解液裂解红细胞,收集脾淋巴细胞,进行细胞计数,并稀释成1×106mL-1备用。
1.3.6 检测多表位疫苗诱导的脾淋巴细胞增殖
将分离得到的小鼠脾淋巴细胞加入到96 孔细胞培养板,每孔 100 μL 细胞,分别用 FT 与 GT 混合物、FTB1B2 多肽和 GTB1B2 多肽,2 μg·孔-1刺激各免疫组小鼠的脾淋巴细胞,以5 μg ConA 作为阳性对照,以无菌PBS 刺激作为阴性对照,以完全培养基作为空白对照。37 ℃,5% CO2培养48 h 后,每孔加入10 μL CCK-8 试剂,混匀后继续培养3 h。使用酶标仪检测450 nm 处样品的吸光度。
1.3.7 检测多表位疫苗诱导的特异性细胞因子水平
将分离得到的小鼠脾淋巴细胞加入到6 孔细胞培养板,每孔2 mL 细胞,分别用FTB1B2 多肽、GTB1B2 多肽刺激各免疫组小鼠的脾淋巴细胞,每孔40 μg,以无菌PBS 缓冲液刺激作为阴性对照。37 ℃,5% CO2培养48 h 后,4 ℃离心收集上清。使用预包被的小鼠IFN-γ ELISA 检测试剂盒、鼠IFN-γ ELISA检测试剂盒和鼠IFN-γ ELISA 检测试剂盒检测细胞培养上清中的IFN-γ、IL-4 和IL-17A 的含量。
1.3.8 间接ELISA 法检测多表位疫苗诱导的血清IgG 水平
加强免疫后2 周,每组取3 只小鼠,摘除眼球取血,使用无菌EP 管收集血液,血液37 ℃静置1 h 后4 ℃过夜,次日5 000 g 离心30 min,吸出上层血清。以GTB1B2 多肽和FTB1B2 多肽作为检测抗原,使用间接ELISA 法检测各免疫组小鼠血清中的IgG 水平。
1.3.9 检测免疫小鼠器官中的细菌定殖
使用Newman 菌株和LS0312 菌株攻毒48 h 后,每组取3 只小鼠,摘除并研磨小鼠的肝脏、脾脏、肺脏和肾脏,连续10 倍比稀释,取50 μL 涂布于TSA 或BHI 固体培养基平皿,37 ℃培养24 h,菌落计数并计算小鼠各脏器的金黄色葡萄球菌和停乳链球菌定殖数。
1.3.10 统计分析
使用OriginPro 8.0 和SPSS 软件对实验数据进行了分析,“ *”表示 P<0.05,“ **”表示 P<0.01,“***”表示 P<0.001。
2 结果
2.1 重组多表位肽质粒的鉴定
对合成的含有FGT、FG 目的基因的重组质粒进行提取,使用限制性内切酶BamHⅠ和XhoⅠ对提取的质粒进行酶切鉴定,酶切产物的琼脂糖凝胶电泳结果如图1 所示,分别在126 bp 和312 bp 处可见目的条带。
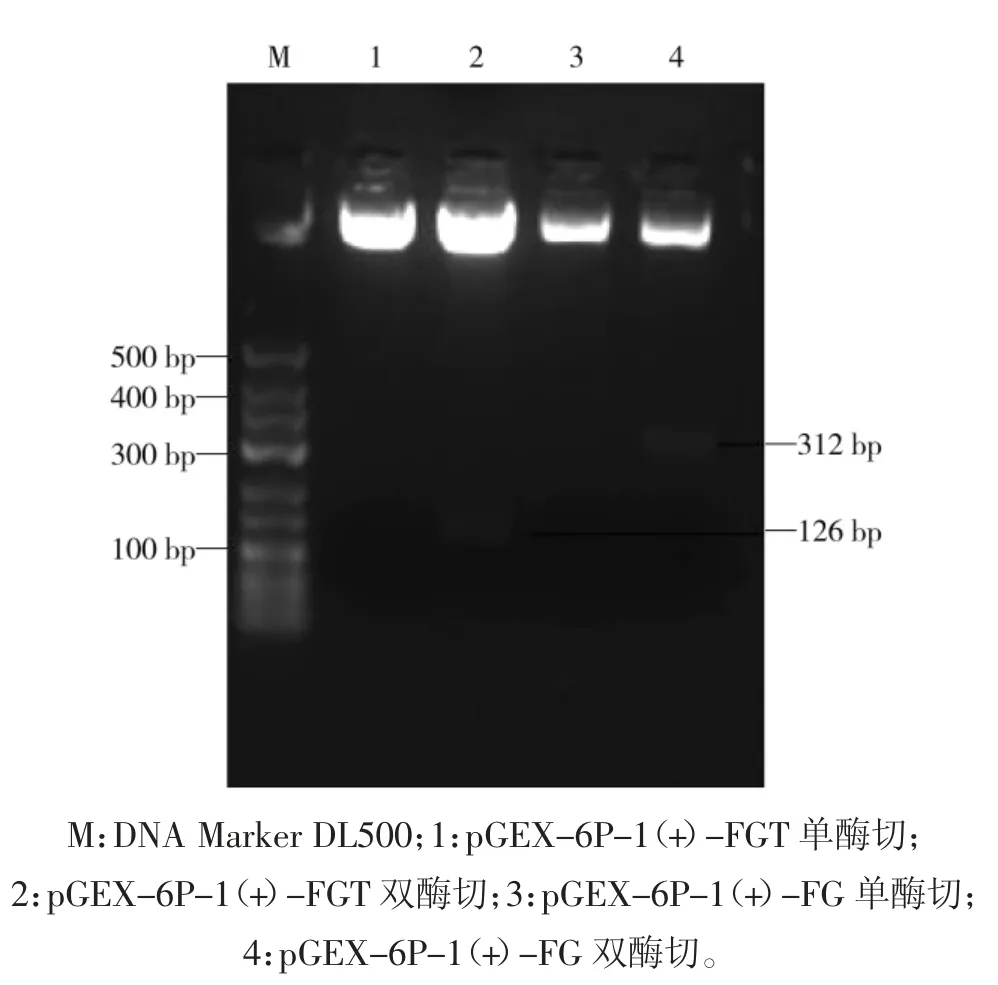
图1 多表位肽质粒的酶切鉴定Fig.1 Identification of multi-epitope peptide plasmids by double digestion
2.2 重组多表位蛋白的表达及纯化结果
重组菌株 BL21(DE3)/pGEX-6P-1(+)/FGT、BL21(DE3)/pGEX-6P-1(+)/FG 经 IPTG 诱导 4 h,使用GST 标签蛋白纯化柱纯化后,进行SDS-PAGE 分析。结果如图2 所示,超声后大部分重组蛋白保留在上清液中,在31 KDa 左右处可见重组FGT 蛋白,36 KDa处发现重组的FG 蛋白,与预期蛋白大小基本一致。
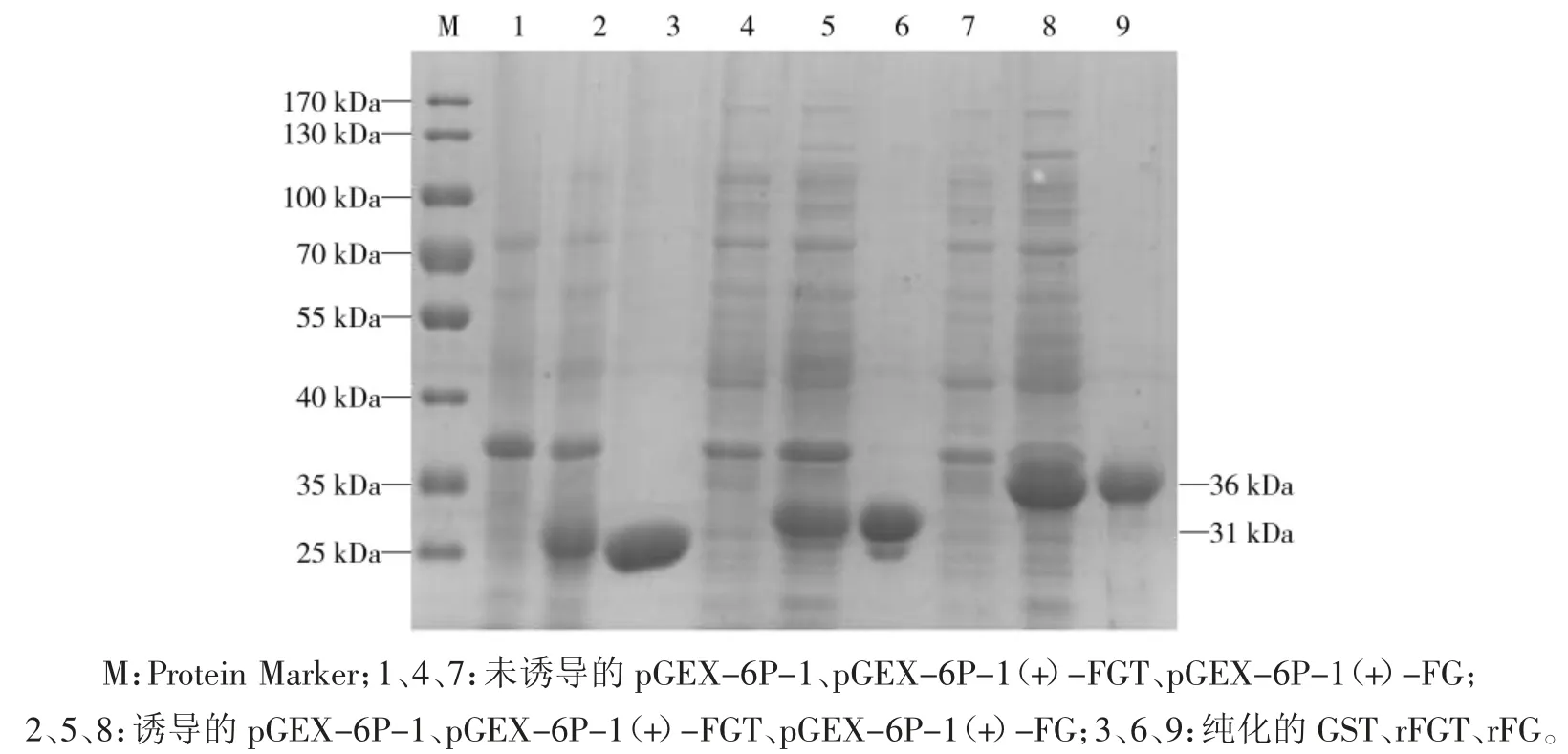
图2 重组表位蛋白的表达与纯化的SDS-PAGE 分析Fig.2 SDS-PAGE analysis of expressed and purified multi-epitope peptides
2.3 多表位疫苗诱导的特异性淋巴细胞增殖
为了评价多表位疫苗诱导细胞免疫应答的能力,对小鼠淋巴细胞的增殖进行检测。加强免疫后一周,分离各免疫组小鼠脾淋巴细胞,分别用FT 与GT混合物、FTB1B2 多肽、GTB1B2 多肽刺激后,使用CCK-8 法检测细胞增殖。结果如图3 所示,FTB1B2多肽能刺激FT、FGT、FTB1B2 和FG 免疫组小鼠淋巴细胞增殖;GTB1B2 多肽能刺激 GT、FGT、GTB1B2 和FG 组小鼠淋巴细胞增殖;FT 和GT 混合肽能同时刺激 FT、GT、FGT、GTB1B2、FTB1B2 和 FG 免疫组小鼠淋巴细胞的增殖,并且GT 和FGT 免疫组淋巴细胞增殖指数显著高于其他表位疫苗组(P<0.05)。
2.4 多表位疫苗诱导的特异性细胞因子水平
为了鉴定多表位疫苗诱导细胞免疫应答的水平及类型,通过间接ELISA 方法检测各免疫组小鼠脾淋巴细胞在体外受到FTB1B2 和GTB1B2 多肽刺激后分泌的细胞因子水平。结果如图4 所示,受到FTB1B2 刺激后,FT 和 FGT 免疫组分泌的 IFN-γ 和IL-17A 水平显著高于 GST 对照组,FTB1B2 和 FG 免疫组小鼠脾淋巴细胞分泌的IFN-γ、IL-4 和IL-17A水平高于其他免疫组(P<0.01);各免疫组小鼠脾淋巴细胞受到GTB1B2 多肽刺激后,GT 和FGT 组分泌的IFN-γ 和 IL-17A 水平显著高于 GST 对照组,GTB1B2 和 FG 免疫组分泌的 IFN-γ、IL-4 和 IL-17A均显著高于其他免疫组(P<0.01)。
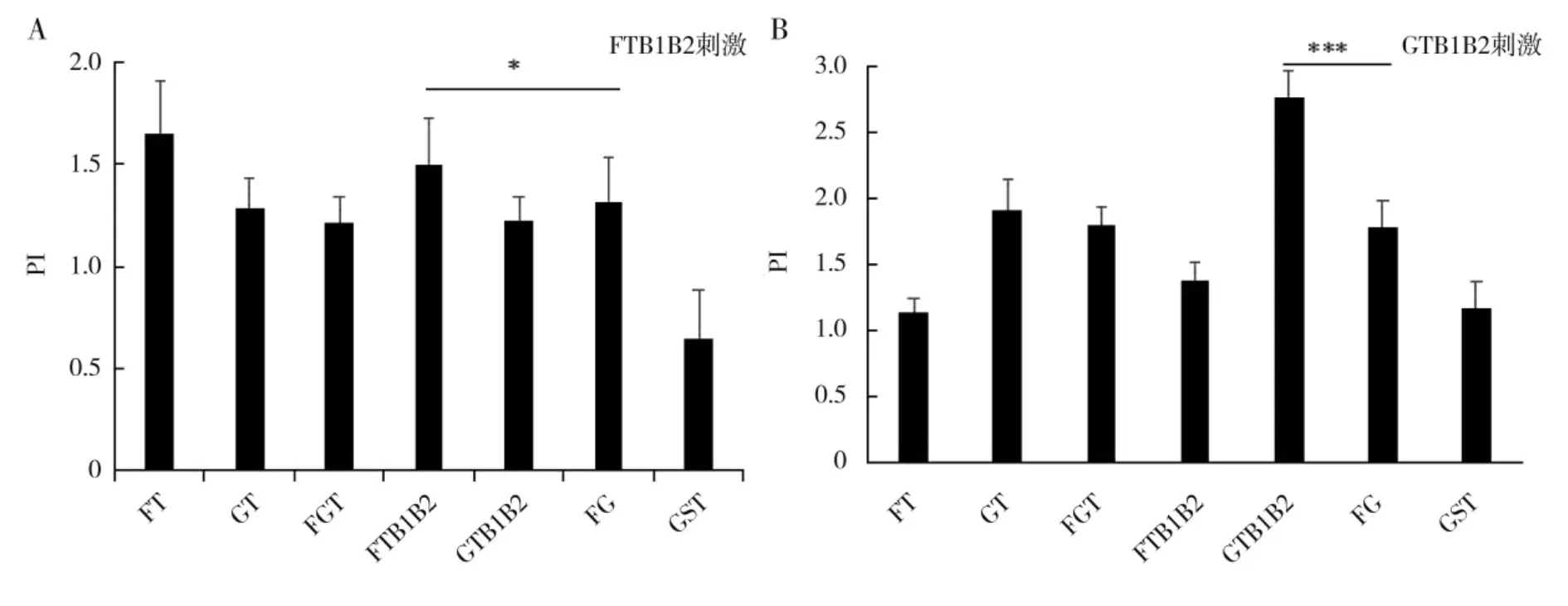

图3 表位疫苗诱导的淋巴细胞增殖结果Fig.3 Epitope vaccine-induced lymphocyte proliferation results

图4 多表位疫苗诱导的特异性细胞因子水平Fig.4 Epitope vaccine-induced lymphocyte proliferation results
2.5 多表位疫苗诱导的血清IgG 水平
为了分析表位疫苗诱导小鼠产生的特异性IgG水平,加强免疫后两周,取各免疫组小鼠血清,分别以FTB1B2 和GTB1B2 多肽作为包被抗原检测IgG抗体水平。小鼠血清的特异性IgG 抗体水平如图5所示,FG 免疫组小鼠血清中的FTB1B2 抗体水平低于FTB1B2 组,但是显著高于其他免疫组:FG 免疫组小鼠血清中的GTB1B2 抗体水平显著高于其他免疫组但低于GTB1B2 组。

图5 表位疫苗诱导的血清特异性IgG 抗体水平Fig.5 Specific IgG antibody levels in sera induced by epitope-vaccines
2.6 免疫小鼠器官中的细菌定殖
为了评价表位疫苗免疫接种后产生的免疫保护作用,小鼠加强免疫接种后两周,分别以最大耐受剂量的 S.dysgalactiae LS0312 和 S.aureus Newman 对小鼠进行腹腔攻毒,48 h 后通过多器官细菌定殖数来评价表位疫苗的免疫保护作用。从金黄色葡萄球菌定殖情况来看,FT、FGT、FTB1B2 和 FG 免疫组小鼠各脏器中的细菌定殖数显著低于GST 对照组,FG 免疫组小鼠脏器中的细菌定殖数显著低于FT 和FGT免疫组但高于 FTB1B2 免疫组(P<0.001);从 S.dysgalactiae 定殖情况看,GTB1B2 和FG 免疫组小鼠各脏器中的S.dysgalactiae 定殖数显著低于其他免疫组,而FG 免疫组小鼠脏器中的细菌定殖数显著高于GTB1B2 免疫组(P<0.001)。尽管 FG 表位疫苗抑制小鼠脏器中S.aureus 或S.dysgalactiae 定殖效果要低于FTB1B2 或GTB1B2,但是FG 表位疫苗能够同时对金黄色葡萄球菌和S.dysgalactiae 起到抑制作用。结果见图6。


图6 免疫小鼠器官中的S.aureus 和S.dysgalactiae 定殖结果Fig.6 Colonization of S.aureus and S.dysgalactiae in the immunized mouse organs
3 讨论
能够引起奶牛乳腺炎的致病菌种类繁多,但金黄色葡萄球菌和链球菌(主要是无乳链球菌、停乳链球菌和乳房链球菌)感染所占奶牛乳腺炎病例比例很高,可高达75%[11]。因此,预防奶牛乳腺炎的理想疫苗应该能够同时预防金黄色葡萄球菌感染和链球菌感染。但是由于表达载体容量限制,无法同时表达多个抗原蛋白。选用两种病原菌的多个抗原研究制备奶牛乳腺炎多抗原表位疫苗对预防金黄色葡萄球菌感染或链球菌感染无疑具有重要意义。
以往研究表明[12-15],细胞免疫应答在抗金黄色葡萄球菌与链球菌感染中发挥着重要的作用,且在表位疫苗构建中加入T 细胞表位则可以提高表位疫苗诱导的免疫保护作用。因此,在研究前期研究金黄色葡萄球菌FnBPA 的多表位疫苗FTB1B2 和停乳链球菌GapC 的多表位疫苗GTB1B2 时,就分别引入了CD4+T 细胞表位,并证明了CD4+T 细胞表位能够提高多表位疫苗的效果。研究进一步将前期构建的多表位疫苗 FTB1B2 和 GTB1B2 用 GSGSGS 柔性 Linker进行串联制备了新的多表位疫苗FG。同时还构建了由 FnBPA CD4+T 细胞表位FT 和GapC CD4+T 细胞表位GT 构成的CD4+T 细胞表位疫苗FGT 作为对照。从细胞因子结果可以看出,CD4+T 细胞表位疫苗FGT 能诱导免疫小鼠产生IFN-γ 和IL-17A,即TH1和TH17 型应答,但诱导细胞免疫应答能力并未随着T 细胞表位数量的增加而增强。FTB1B2、GTB1B2 和FG 免疫小鼠后都能诱导产生较高水平的IFN-γ、IL-4 和IL-17A,尽管FG 诱导的细胞因子水平要低于FTB1B2 和GTB1B2,但FG 能诱导针对两种病原菌抗原表位肽的细胞免疫应答。体液免疫应答在抗金黄色葡萄球菌与链球菌感染中同样不可或缺,表位疫苗的IgG 检测结果发现,FG 免疫组血清中的FTB1B2 抗体水平或GTB1B2 抗体水平低于FTB1B2和GTB1B2 免疫组,但是FG 能同时诱导产生针对两种表位肽的IgG 抗体。FGT 与 FT、GT 相比,抑制金黄色葡萄球菌或停乳链球菌定殖的效果基本一致,并显著低于其他表位疫苗免疫组。FG 表位疫苗诱导小鼠抑制金黄色葡萄球菌或停乳链球菌器官定殖作用弱于FTB1B2 或GTB1B2 表位疫苗,但是FG 表位疫苗能够诱导小鼠同时抑制金黄色葡萄球菌和停乳链球菌器官定殖作用。以上说明多表位疫苗FG 诱导小鼠的细胞免疫应答和体液免疫应答以及抑制细菌在内脏器官定殖作用均弱于多表位疫苗FTB1B2或GTB1B2,但一个多表位疫苗能够诱导小鼠产生针对金黄色葡萄球菌和停乳链球菌两种病原的免疫预防作用。
大多数的表位疫苗设计都是将T 细胞表位放在多表位疫苗的N 端,将B 细胞表位放在C 端[16-17],此前构建好的多表位疫苗FTB1B2 与GTB1B2 都是将CD4+T 细胞表位放在了各自的N 端。而实验是将FTB1B2 与GTB1B2 直接以Linker 按此顺序串联,并没有在进一步优化T 细胞表位和B 细胞表位的顺序。再有,报道的多表位疫苗常包含 3~4 个表位[16,18],而研究的FG 由6 个表位构成,从结果可以看出,随着抗原表位的增多,表位疫苗诱导的免疫应答和免疫保护作用会显著下降。因此,表位数量、各表位的顺序、表位间的连接以及表位的性质等是否会对其诱导的免疫应答和免疫保护作用造成了一定的影响有待进一步研究。研究对小鼠进行了两次免疫,增加免疫次数是否会提高免疫保护效果值得进一步研究。
综上所述,研究构建的FG 多表位能够诱导小鼠产生较好的细胞和体液免疫应答,并能同时较好地抑制攻毒小鼠器官中金黄色葡萄球菌和停乳链球菌的定殖。

