少腹逐瘀汤对子宫内膜容受性不良大鼠的改善作用及机制研究
李 琳,贺 冰,马本玲
湖南中医药大学第二附属医院 妇科,湖南 长沙 410005
子宫内膜容受性是子宫对胚胎定位、黏附、入侵子宫内膜的接受能力,可影响胚胎着床、妊娠过程,子宫内膜容受性不良是导致女性不孕的重要因素之一[1-2]。目前,西医治疗子宫内膜容受性不良多以药物、手术为主,但药物不良反应影响了药物的长期应用,手术治疗具有术后并发症多、易复发等不足。中医认为子宫内膜容受性属“癥瘕”“月经不调”“不孕症”等范畴,血瘀证为常见辨证分型之一,治疗需以活血化瘀、温经散寒为主。研究表明,中药可促进子宫内膜、胚胎同步发育,提升临床妊娠率[3]。少腹逐瘀汤由生蒲黄、当归、赤芍、五灵脂等组成,具有活血化瘀、温阳散寒、舒经通络的功效。少腹逐瘀汤能提升临床妊娠率[4],提示该方可能在调节子宫内膜容受性上也有一定作用,本研究建立血瘀型子宫内膜容受性不良大鼠模型,考察少腹逐瘀汤对大鼠子宫内膜容受性及胚胎着床率的影响。
1 材料
1.1 动物
清洁级雌性SD 大鼠50 只,8 周龄,体质量(240±20)g;清洁级雄性SD 大鼠25 只,8 周龄,体质量(320±20)g,购自北京科兴中维生物技术有限公司,许可证号SYXK(京)2019-0052。大鼠于温度(22±2)℃、湿度(40±10)%、12 h/12 h 昼夜周期照明下,自由进食饮水,适应性饲养3 d。动物实验经湖南中医药大学第二附属医院动物伦理委员会审核批准(批准号IACUC-2019-005)。
1.2 药材
少腹逐瘀汤(批号181104)由湖南中医药大学第二附属医院提供。少腹逐瘀汤由生蒲黄9 g、当归9 g、赤芍6 g、五灵脂6 g、延胡索3 g、小茴香3 g、川芎3 g、没药3 g、肉桂3 g、炮姜0.6 g 组成,以上药材经湖南中医药大学第二附属医院陈卫红副主任药师分别鉴定为香蒲科植物水烛香蒲Typha angustifoliaL.的干燥花粉、伞形科植物当归Angelica sinensis(Oliv.) Diels 的干燥根、毛茛科植物川赤芍Paeonia veithiiLynch 的干燥根、鼯鼠科动物复齿鼯鼠Trogopterus ranthipesMilne-Edwards 的干燥粪便、罂粟科植物延胡索Corydalis yanhusuoW.T.Wang 的干燥块茎、伞形科植物茴香Forniculum vulgareMill.的果实、伞形科植物川芎Ligusticum chuanxiong Hort.的干燥根茎、橄榄科植物地丁树Commiphora myrrhaEngl.的干燥树脂、无患子科植物龙眼Dimocarpus longanLour.的假种皮、姜科植物姜Zingiber officinaleRosc.的干燥根茎。
1.3 药品与试剂
戊酸雌二醇片(1 mg/片,批号130109)购自拜耳医药保健有限公司;羟基脲(批号101129)购自美国Sigma 公司;肾上腺素(批号170324)购自华润双鹤药业股份有限公司;苏木精-伊红(HE)染色试剂盒(批号200110)购自上海迈基生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)ELISA 试剂盒(批号分别为120415、150301、111207)购自武汉博士德生物工程有限公司;活性氧(reactive oxygen species,ROS)、丙二醛试剂盒(批号分别为070514、100417)购自上海晶抗生物有限公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(批号091104)、血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,KDR)抗体(批号100527)、山羊抗兔IgG 抗体(批号121107)购自上海彩佑生物技术发展有限公司。
1.4 仪器
FLx 800 荧光酶标仪(美国Bio-Tek 公司);BX 50 光学显微镜(日本Olympus 公司);Dolphin-Doc凝胶成像系统(美国Wealtec 公司);Allegra X-30高速离心机(美国贝克曼库尔特有限公司)。
2 方法
2.1 少腹逐瘀汤的制备
除肉桂外的其他药物加300 mL 水浸泡1 h,文火煎煮1 h;后下肉桂,煎煮20 min,滤过,浓缩至质量浓度为8 mg/mL(以生药量计)的混悬液。
2.2 模型的制备
随机选取10 只雌性大鼠作为对照组,其余雌性大鼠建立血瘀型子宫内膜容受性不良模型[5]:大鼠每日9:00 时进行阴道涂片检查,当阴道分泌物内出现大量白细胞,或夹杂少许核扁平上皮细胞,且未出现角化细胞,即为静止期,开始建模。大鼠ig羟基脲(450 mg/kg,4 mL/kg),1 次/d,持续10 d;自第4 天开始,同时sc 肾上腺素(0.3 mg/kg),1次/d,持续7 d。大鼠出现蜷缩少动、拱背、反应迟钝、大便偏稀、背部皮毛疏松或脱落等症状,即为造模成功。
2.3 分组与给药
将造模成功的36 只大鼠随机分为模型组、戊酸雌二醇(0.27 mg/kg,相当于临床等效剂量)组及少腹逐瘀汤低、高剂量(144、288 mg/kg,相当于临床等效剂量、2 倍剂量)组,每组9 只[6]。各给药组ig 相应药物,对照组和模型组ig 等体积生理盐水(10 mL/kg),1 次/d,持续10 d。自给药后第1 天开始,每日18:00 时至次日8:00 时,按2∶1将雌性、雄性大鼠合笼,合笼后对雌性大鼠进行阴栓、阴道涂片检查,观察出现精虫或阴栓的时间,记为妊娠第1 天。妊娠第5 天,各组大鼠ip 2%戊巴比妥钠(2.5 mL/kg)麻醉,仰卧位固定于手术台,迅速解剖腹腔,观察子宫胚泡着床情况,记录胚胎着床率、平均胚胎着床数;取子宫内膜组织,以0.9%氯化钠溶液冲洗后于液氮中保存备用。
2.4 少腹逐瘀汤对大鼠子宫内膜TNF-α、IL-6 和IL-8 水平的影响
子宫内膜组织加入预冷PBS,于冰上研磨,4℃、13 000 r/min 离心15 min,取上清液。按照酶联免疫吸附法试剂盒说明书分别检测子宫内膜组织中TNF-α、IL-6、IL-8 水平。
2.5 少腹逐瘀汤对大鼠子宫内膜ROS 和丙二醛水平的影响
子宫内膜组织加入预冷PBS,于冰上研磨,4℃、13 000 r/min 离心15 min,取上清液。按照试剂盒说明书检测子宫内膜组织ROS 和丙二醛水平。
2.6 少腹逐瘀汤对大鼠子宫内膜病理变化、子宫腺体数、子宫血管数和子宫内膜厚度的影响
子宫内膜组织于4%多聚甲醛中固定,流水冲洗,以梯度乙醇脱水、二甲苯透明、包埋后切片(厚度5µm)。脱蜡后切片进行HE 染色、脱水、透明、封片。于显微镜下观察大鼠子宫内膜组织病理变化,记录大鼠子宫腺体数、子宫血管数;采用Leica QWin 软件分析子宫内膜厚度,评估子宫内膜容受性。
2.7 少腹逐瘀汤对大鼠子宫内膜VEGF 和KDR 蛋白表达的影响
取子宫内膜组织,加入全细胞裂解液(10 mL/g),于冰上研磨,4 ℃、13 000 r/min 离心15 min,取上清液。蛋白定量后,加入蛋白上样缓冲液,沸水浴10 min 使蛋白变性。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,室温封闭2 h。分别加入VEGF、KDR 抗体(1∶1000),4 ℃孵育过夜;缓冲盐溶液洗涤后,加入山羊抗兔IgG 抗体(1∶5000),孵育2 h;缓冲盐溶液洗涤3次,10 min/次。加入ECL 试剂反应5 min,曝光、显影、定影。采用Image J2x 软件,对蛋白条带灰度值进行分析。
2.8 统计学分析
采用SPSS 19.0 统计软件分析数据,计量资料以±s表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用LSD 检验,多个独立样本采用χ2检验。
3 结果
3.1 少腹逐瘀汤对大鼠子宫内膜TNF-α、IL-6 和IL-8 水平的影响
如表1所示,与对照组比较,模型组大鼠子宫内膜TNF-α、IL-6 和IL-8 水平均显著升高(P<0.05);与模型组比较,各给药组大鼠子宫内膜TNF-α、IL-6 和IL-8 水平均显著降低(P<0.05),且少腹逐瘀汤呈剂量相关性。
表1 少腹逐瘀汤对大鼠子宫内膜TNF-α、IL-6 和IL-8 水平的影响 (±s)Table 1 Effect of Shaofu Zhuyu Decoction on TNF-α,IL-6,and IL-8 levels in endometrium of rats (±s)
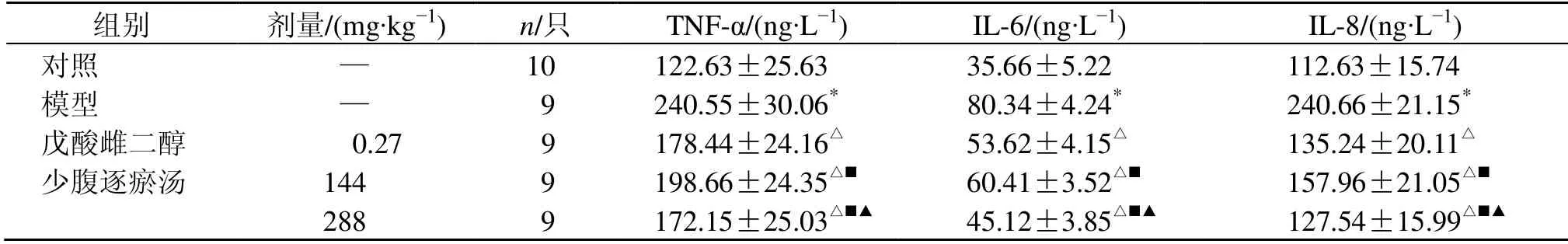
表1 少腹逐瘀汤对大鼠子宫内膜TNF-α、IL-6 和IL-8 水平的影响 (±s)Table 1 Effect of Shaofu Zhuyu Decoction on TNF-α,IL-6,and IL-8 levels in endometrium of rats (±s)
与对照组比较:*P<0.05;与模型组比较:△P<0.05;与戊酸雌二醇组比较:■P<0.05;与少腹逐瘀汤(144 mg·kg−1)组比较:▲P<0.05,下表同*P < 0.05 vs control group; △P < 0.05 vs model group; ■P < 0.05 vs estradiol valerate group; ▲P < 0.05 vs Shaofu Zhuyu Decoction (144 mg·kg−1)group,same as below tables
组别 剂量/(mg·kg−1) n/只 TNF-α/(ng·L−1) IL-6/(ng·L−1) IL-8/(ng·L−1)对照 — 10 122.63±25.63 35.66±5.22 112.63±15.74模型 — 9 240.55±30.06* 80.34±4.24* 240.66±21.15*戊酸雌二醇 000.27 9 178.44±24.16△ 53.62±4.15△ 135.24±20.11△少腹逐瘀汤 144 9 198.66±24.35△■ 60.41±3.52△■ 157.96±21.05△■288 9 172.15±25.03△■▲ 45.12±3.85△■▲ 127.54±15.99△■▲
3.2 少腹逐瘀汤对大鼠子宫内膜ROS 和丙二醛水平的影响
如表2所示,与对照组比较,模型组大鼠子宫内膜ROS 和丙二醛水平均显著升高(P<0.05);与模型组比较,各给药组大鼠子宫内膜ROS 和丙二醛水平均显著降低(P<0.05),且少腹逐瘀汤呈剂量相关性。
3.3 少腹逐瘀汤对大鼠胚胎着床率和平均胚泡着床数的影响
如表3所示,与对照组比较,模型组大鼠胚胎着床率、平均胚泡着床数显著降低(P<0.05);与模型组比较,各给药组大鼠大鼠胚胎着床率、平均胚泡着床数均显著升高(P<0.05),且少腹逐瘀汤呈剂量相关性。
3.4 少腹逐瘀汤对大鼠子宫内膜病理变化的影响
如图1所示,对照组大鼠子宫内膜组织较完整,内膜、肌层及外膜结构清晰,子宫腺上皮细胞核大、圆,形态无异常,肌层肌纤维排列整齐、紧密。模型组大鼠子宫内膜增生明显,细胞成分增多,部分上皮细胞坏死,子宫腺排列稀疏,固有层间质内存在炎性细胞浸润。各给药组大鼠子宫内膜组织较为完整,少量子宫内膜上皮细胞空泡变性,腺上皮细胞排列较为规则,固有层间质内炎性细胞浸润减少,肌层肌纤维排列较整齐,尤以少腹逐瘀汤高剂量组改善作用更显著。
3.5 少腹逐瘀汤对大鼠子宫腺体数、子宫血管数和子宫内膜厚度的影响
如表4所示,与对照组比较,模型组大鼠子宫腺体数、子宫血管数、子宫内膜厚度均显著降低(P<0.05);与模型组比较,各给药组大鼠子宫腺体数、子宫血管数、子宫内膜厚度均显著升高(P<0.05),且少腹逐瘀汤呈剂量相关性。
表2 少腹逐瘀汤对大鼠子宫内膜ROS 和丙二醛水平的影响 (±s)Table 2 Effect of Shaofu Zhuyu Decoction on ROS and malondialdehyde levels in endometrium of rats (±s)
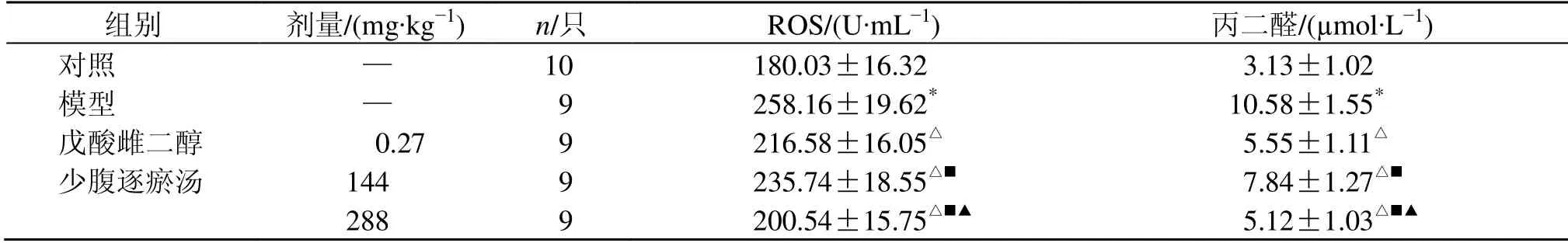
表2 少腹逐瘀汤对大鼠子宫内膜ROS 和丙二醛水平的影响 (±s)Table 2 Effect of Shaofu Zhuyu Decoction on ROS and malondialdehyde levels in endometrium of rats (±s)
组别 剂量/(mg·kg−1) n/只 ROS/(U·mL−1) 丙二醛/(µmol·L−1)对照 — 10 180.03±16.32 03.13±1.02模型 — 9 258.16±19.62* 10.58±1.55*戊酸雌二醇 000.27 9 216.58±16.05△ 05.55±1.11△少腹逐瘀汤 144 9 235.74±18.55△■ 07.84±1.27△■288 9 200.54±15.75△■▲ 05.12±1.03△■▲
表3 少腹逐瘀汤对大鼠胚胎着床率和平均胚泡着床数的影响 (±s)Table 3 Effect of Shaofu Zhuyu Decoction on embryo implantation rate and average number of blastocyst implantation of rats (±s)
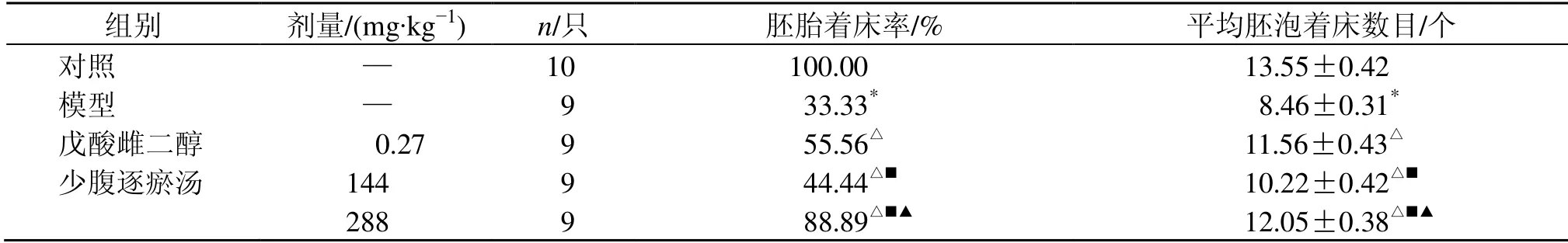
表3 少腹逐瘀汤对大鼠胚胎着床率和平均胚泡着床数的影响 (±s)Table 3 Effect of Shaofu Zhuyu Decoction on embryo implantation rate and average number of blastocyst implantation of rats (±s)
组别 剂量/(mg·kg−1) n/只 胚胎着床率/% 平均胚泡着床数目/个对照 — 10 100.00 13.55±0.42模型 — 9 033.33* 08.46±0.31*戊酸雌二醇 000.27 9 055.56△ 11.56±0.43△少腹逐瘀汤 144 9 044.44△■ 10.22±0.42△■288 9 088.89△■▲ 12.05±0.38△■▲
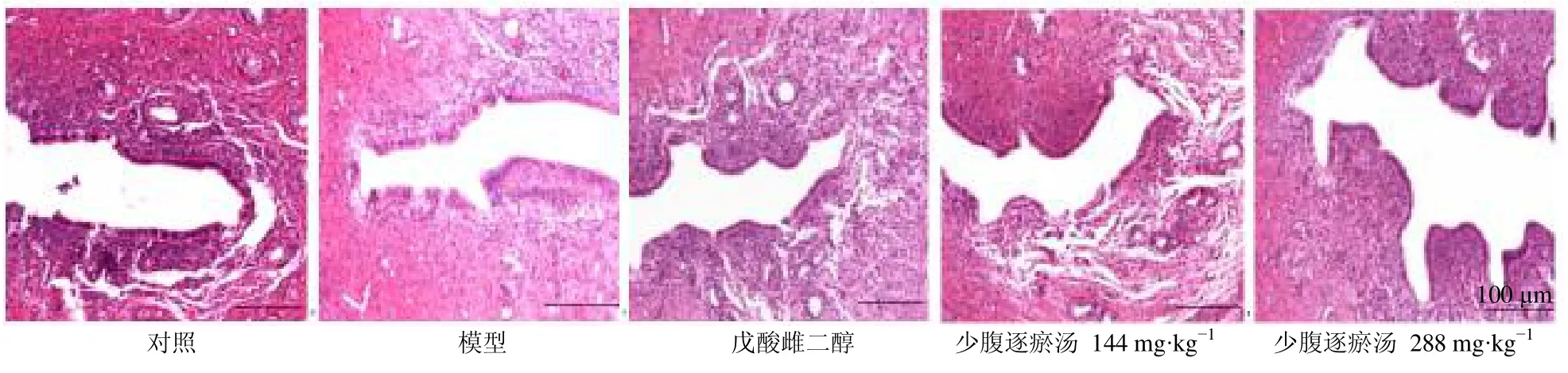
图1 少腹逐瘀汤对大鼠子宫内膜病理变化的影响 (HE,×100)Fig.1 Effect of Shaofu Zhuyu Decoction on pathological change of endometrium in rats (HE,× 100)
表4 少腹逐瘀汤对大鼠子宫腺体数、子宫血管数和子宫内膜厚度的影响 (±s)Table 4 Effect of Shaofu Zhuyu Decoction on number of uterine glands,uterine blood vessels and endometrial thickness in rats (±s)

表4 少腹逐瘀汤对大鼠子宫腺体数、子宫血管数和子宫内膜厚度的影响 (±s)Table 4 Effect of Shaofu Zhuyu Decoction on number of uterine glands,uterine blood vessels and endometrial thickness in rats (±s)
组别 剂量/(mg·kg−1) n/只 子宫腺体数目/个 子宫血管数目/个 子宫内膜厚度/mm对照 — 10 2.85±0.65 4.12±0.84 415.25±33.65模型 — 9 1.01±0.41* 1.52±0.76* 294.84±37.15*戊酸雌二醇 000.27 9 1.98±0.45△ 3.45±0.89△ 371.05±35.78△少腹逐瘀汤 144 9 1.69±0.55△■ 3.02±0.81△■ 324.15±36.15△■288 9 2.24±0.56△■▲ 3.72±0.91△■▲ 395.84±38.55△■▲
3.6 少腹逐瘀汤对大鼠子宫内膜VEGF 和KDR 蛋白表达的影响
如图2和表5所示,与对照组比较,模型组大鼠子宫内膜VEGF 和KDR 蛋白表达水平显著降低(P<0.05);与模型组比较,各给药组大鼠子宫内膜VEGF和KDR 蛋白表达水平均显著升高(P<0.05),且少腹逐瘀汤呈剂量相关性。
4 讨论

图2 少腹逐瘀汤对大鼠子宫内膜VEGF 和KDR 蛋白表达的影响Fig.2 Effect of Shaofu Zhuyu Decoction on expressions of VEGF and KDR in endometrium of rats
表5 少腹逐瘀汤对大鼠子宫内膜VEGF 和KDR 蛋白表达的影响 (±s)Table 5 Effect of Shaofu Zhuyu Decoction on expressions of VEGF and KDR in endometrium of rats (±s)
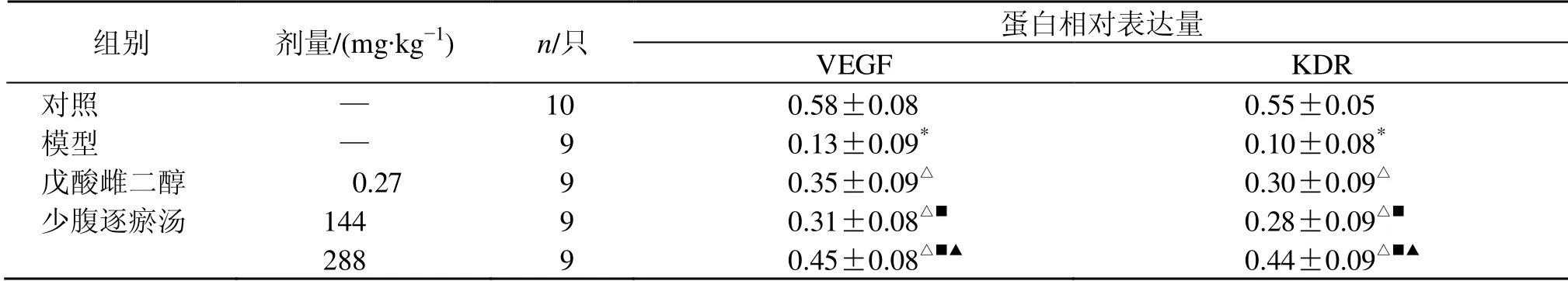
表5 少腹逐瘀汤对大鼠子宫内膜VEGF 和KDR 蛋白表达的影响 (±s)Table 5 Effect of Shaofu Zhuyu Decoction on expressions of VEGF and KDR in endometrium of rats (±s)
蛋白相对表达量组别 剂量/(mg·kg−1) n/只 VEGF KDR对照 — 10 0.58±0.08 0.55±0.05模型 — 9 0.13±0.09* 0.10±0.08*戊酸雌二醇 000.27 9 0.35±0.09△ 0.30±0.09△少腹逐瘀汤 144 9 0.31±0.08△■ 0.28±0.09△■288 9 0.45±0.08△■▲ 0.44±0.09△■▲
近年来,随着生殖医学快速发展,特别是体外受精-胚胎移植技术的不断完善,较多不孕夫妇生育问题得到解决,但不孕症患者临床妊娠率仍为30%~40%[7]。胚胎植入失败是影响临床妊娠率的关键,子宫内膜容受性不良是其常见诱因之一[8-9]。目前临床尚无有效治疗子宫内膜容受性不良的方法[10-12]。中医认为,子宫内膜容受性不良病因复杂,包括气血亏虚、气滞血瘀、肾气不足、任冲二脉失养、胞脉瘀滞等,其中血瘀证尤为多见[13]。少腹逐瘀汤为治疗妇科疾病的常用方剂,方中小茴香理气舒肝、散寒止痛,炮姜回阳通脉、温中散寒,肉桂温肾助阳,延胡索活血化瘀、理气舒肝,没药消肿生肌、活血祛瘀,赤芍、当归、川芎、五灵脂等活血行气、祛瘀散结,生蒲黄化瘀、通淋、止血,诸药合用,共奏活血化瘀、温阳散寒、理气疏肝之功效。研究表明,少腹逐瘀汤能够减轻原发性痛经大鼠宫腔组织炎症反应,且可促进子宫内膜异位症大鼠血管新生,营造良好宫腔环境[14-15]。
本研究发现,与模型组比较,少腹逐瘀汤组大鼠子宫腺体数、子宫血管数、子宫内膜厚度均明显升高,呈剂量相关性,提示少腹逐瘀汤可改善子宫内膜容受性不良大鼠的子宫内膜容受性;少腹逐瘀汤组大鼠胚胎着床率、平均胚胎着床数均明显升高,提示少腹逐瘀汤可提升大鼠胚胎着床率,与改善子宫内膜容受性有关。子宫内膜容受性不良与宫腔局部氧化应激、炎症反应密切相关[16]。机体缺氧状态时,巨噬细胞分泌TNF-α、IL-6 等炎症因子,产生免疫排斥作用,影响子宫内膜容受性,阻碍胚胎着床。ROS、丙二醛等氧化应激指标升高可促进细胞增殖,引发局部炎症反应,导致子宫内膜容受性降低。本研究结果显示,与模型组比较,少腹逐瘀汤组大鼠子宫内膜TNF-α、IL-6、IL-8、ROS、丙二醛水平均明显降低,提示少腹逐瘀汤可减轻子宫内膜氧化应激、炎症反应。董建新等[17]发现,少腹逐瘀汤中当归、川芎等具有抗氧化活性,可清除ROS,减轻氧化应激、炎症反应,与本研究结果一致。
子宫内膜发育、分化、植入均受血管生成的影响,且与胚泡着床、胎盘形成密切相关。炎症、氧化应激反应可促进子宫内膜细胞凋亡,抑制子宫内膜及血管发育,影响血管生成,使子宫内膜容受性降低。研究发现[18],围着床期VEGF 表达的升高可促使子宫内膜容受性增加,蜕膜化期VEGF 表达的升高可促进早期绒毛血管形成。王健等[19]提出,VEGF 通路不仅可调控细胞增殖、迁移、分化,还参与炎症、氧化应激、免疫等过程。VEGF 结合KDR受体后,可介导内皮细胞增殖,并促进血管生成[20]。Jing 等[21]发现,相较于未妊娠组,妊娠组大鼠子宫内膜VEGF 表达升高。辛明蔚等[22]发现,中药可通过作用于VEGF/KDR 通路调节血管生成,减轻炎症反应及氧化应激反应,提升子宫内膜容受性。以上研究表明,子宫内膜组织内VEGF/KDR 通路的表达,可影响子宫内膜容受性和胚胎着床率。本研究结果显示,少腹逐瘀汤组大鼠子宫内膜VEGF、KDR 蛋白表达水平明显升高,且呈剂量相关性,提示少腹逐瘀汤改善大鼠子宫内膜容受性、提升胚胎着床率的作用机制可能与调节VEGF/KDR 通路、促进血管形成有关。
综上所述,少腹逐瘀汤可减轻子宫内膜容受性不良大鼠氧化应激、炎症反应,改善子宫内膜容受性,提升胚胎着床率,其作用机制与调控VEGF/KDR 通路有关。
利益冲突所有作者均声明不存在利益冲突

