NaCl胁迫对5年生蜡梅生长及生理特性的影响1)
李海燕 邵金彩 王静 肖可 李庆卫
(北京林业大学,北京,100083)
土壤盐渍化已经成为当前全球性的生态环境难题之一,据联合国粮食及农业组织(FAO)[1]统计,全世界盐渍土总面积为3.97亿hm2,约占陆地总面积的3.10%;我国的盐渍土总面积达到3 630万hm2,接近我国可利用土地面积的4.88%[2],目前,仅有576.6万hm2已被开垦[3]。土壤盐渍化已成为限制我国花卉生产与园林绿化应用的主要环境因子之一。
蜡梅(Chimonanthuspraecox),又称腊梅、黄梅等,属蜡梅科(Calycanthaceae)蜡梅属落叶灌木,是第三纪孑遗植物,也是我国重要的传统名花,栽培历史悠久,被广泛应用于园林绿化、盆景、鲜切花、蜡梅香精等方面[4]。邵金彩等[5]研究了盐胁迫对蜡梅种子萌发及幼苗影响,认为蜡梅种子具有耐低盐胁迫(0.4% NaCl以下)的特性,但蜡梅成年植株能否在盐渍土上生长以及对盐胁迫耐受程度尚无定论。因此,拟通过研究盐胁迫对5年生蜡梅生长和生理特性的影响、探讨蜡梅对盐胁迫的响应机制和耐盐性,对于指导蜡梅在盐渍土地区的栽培应用具有一定的理论意义与实践价值。
1 材料与方法
试验场地位于北京林业大学苗圃内,场地避雨且有充足的自然光照。以5年生‘一品晚黄’蜡梅(Chimonanthuspraecox‘Yipin Wanhuang’)健壮实生苗为试材,选取生长健壮、生长形态一致的植株,以V(草炭)∶V(蛭石)∶V(珍珠岩)=4∶1∶1的混合土作为基质,种植在300 mm×350 mm(底径×高)的塑料花盆内,花盆底下放置托盘,种植密度均为1株·盆-1。依据预试验结果,共设0.3%、0.6%、0.9%、1.2%四个盐质量分数梯度处理,分别记为C1、C2、C3、C4,每个处理设5个重复,以蒸馏水为对照组,记为CK。试验前控制浇水使土壤干燥,于2016年5月16日开始进行第一次土壤盐化试验。依据试验设计配制相应质量分数盐溶液各1 500 mL,一次性加入盆中,若有溶液流入托盘则立即倒回花盆,每10 d浇相应质量分数的盐溶液或蒸馏水(均浇1 500 mL),处理40 d后结束试验。
每次浇盐水前取位于植株上部第4~5片叶,立即带回实验室处理,测定各项指标。于试验结束后第1天,选择长势中等的蜡梅实生苗观察其根部的变化情况。
生长指标测定:表观变化的观测主要于试验期间记录叶片颜色、落叶程度等受胁迫症状,在试验结束后,观测蜡梅根部表观差异,并拍照记录。生长量观测主要取株高、地径、叶长、叶宽等指标,分别于盐胁迫试验前和结束后测量,株高为植株基部到主干顶端的长度,采用钢卷尺测量,精度为0.1 cm;地径为植株离地表0~5 cm处的茎干直径,使用十字交叉的方式[6]用电子游标卡尺测定,精度为0.02 cm;取植株中上部成熟叶片,每个处理选10枚以上叶片进行叶片形态的测量,用直尺测量叶长、叶宽,精度0.1 cm。每个指标3个重复。
生理指标测定:分别于试验前、试验第10、20、30、40 d采取植物叶片,并将其置于-80 ℃的超低温冰箱中(其中叶片组织含水量、相对电导率在叶片采后立即测定),用于测定生理生化指标。其中叶片组织含水量采用烘干法测定[7]。相对电导率采用电导率仪测定。过氧化物酶(POD)活性测定采用愈创木酚法[8],超氧化物歧化酶(SOD)活性测定采用NBT法[8],丙二醛(MDA)质量摩尔浓度的测定采用巴比妥酸显色法[7],可溶性蛋白(SP)质量摩尔浓度测定采用考马斯亮蓝G-250染色法[8],可溶性糖(SS)质量摩尔浓度测定采用蒽酮比色法[8],游离脯氨酸(Pro)质量分数测定采用酸性茚三酮法[8]。每个指标3个重复。
叶绿素荧光参数测定:试验第10、20、30、40 d于08:00—11:00,用便携式调制叶绿素荧光仪PAM-2500测定各项叶绿素荧光参数,每个处理9个重复,每次测定相同叶片。测定前暗适应30 min后,进行最大光化学效率(Fv/Fm)、实际光合效率(Y(II))、光化学猝灭系数(qP)以及相对电子传递速率(rE,T,R)等的测定。测量时保持仪器角度一致,并使叶片平展。在9个重复中,去掉最高值和最低值,将剩余的5个值进行结果分析。
耐盐因子的综合分析:先对各项指标的原始数据进行无量纲化[9]。计算各指标的耐盐系数(α),若指标与植物耐盐性呈正相关,则该指标的α=(处理组平均值/测定组平均值)×100%;若指标与植物耐盐性呈负相关,则该指标的α=(测定组平均值/处理组平均值)×100%。之后对各项指标的α值进行Person相关性分析,在此基础上对各项指标的α值进行主成分分析得到不同主成分下各指标的负载权数及贡献率,获得综合指标。
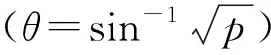
2 结果与分析
2.1 盐胁迫对蜡梅各生长指标的影响
对表观特征的影响:盐胁迫40 d后,C1处理后有少量下部叶片叶尖及边缘干枯,成活率100%,说明低盐胁迫对5年生蜡梅的生长影响不显著,在C1处理后能正常生长;C2处理后有50%植株的中下部叶片出现干枯,受害症状较严重;C3和C4处理后植株老叶片100%脱落,但有新叶继续形成,严重卷缩失水,直至干枯。由图1可知,0.3%质量分数下处理40 d后的蜡梅根系表观与对照无明显差异,在0.6%~1.2%质量分数下,蜡梅侧根的数量随盐质量分数的增加而减少。盐质量分数达到1.2%时,几乎已无侧根。
对生长量的影响:株高、地径、叶长和叶宽的生长量均随盐质量分数的增加呈现不同程度减小(表1)。在C1处理下,株高、地径、叶长和叶宽生长量降幅依次分别为4.29%、10.77%、5.26%、13.79%。在C2处理下,叶宽生长量的降幅达到50%以上,其余3个指标的降幅均在50%以下。在C1处理下,地径生长量的差异与对照达到极显著水平(P<0.01),株高、叶长与叶宽的生长量与对照的差异不显著(P<0.05);在C2、C3、C4处理下,植株各指标生长量与CK处理下的差异均达到了极显著水平(P<0.05)。不同盐质量分数处理下植株的株高、地径、叶长和叶宽生长量的差异均达到极显著水平(P<0.01)。

图1 不同质量分数盐胁迫处理40 d后根系状况对照图

表1 盐胁迫对5年生蜡梅生长量的影响
2.2 盐胁迫对蜡梅各生理指标的影响
对叶片组织含水量的影响:盐胁迫对叶片组织含水量的影响如表2所示,C1处理下与CK相比变化趋势稳定;C2、C3和C4处理下整体均随胁迫时间的延长表现出不同程度的减少。在C1处理下的叶片含水量数值较CK处理稍低,但二者之间差异不显著;在C2处理下,叶片含水量显著下降了31.13%(P<0.05)。在高质量分数盐胁迫下(0.9%~1.2%),叶片组织含水量在30d时均降至最低,同时在试验后期(40 d时)叶片全部干枯脱落。
对渗透调节物质的影响:盐胁迫对游离脯氨酸质量分数,可溶性蛋白、可溶性糖质量摩尔浓度的影响如表2所示。不同质量分数盐胁迫下,游离脯氨酸质量分数随胁迫时间的延长均逐渐升高,而可溶性蛋白、可溶性糖质量摩尔浓度随胁迫时间的延长先降低后增加。试验结束时(C1、C2于胁迫40 d时结束试验,C3、C4于胁迫30 d时结束试验),C1、C2、C3、C4处理的游离脯氨酸质量分数分别是0 d时的5.96、12.28、9.61、8.06倍(P<0.05)。胁迫10 d时,C1、C2、C3、C4处理下的可溶性蛋白质量摩尔浓度较0 d时依次显著下降了51.40%、51.13%、51.99%、54.75%(P<0.05)。10~40 d时,可溶性蛋白、可溶性糖质量摩尔浓度均转而加速上升,试验结束时(C1、C2于胁迫40 d时结束试验,C3、C4于胁迫30 d时结束试验),C1、C2、C3、C4处理下较10 d时的差异显著(P<0.05),可溶性蛋白质量摩尔浓度依次是10 d时的2.43、3.01、2.86、3.68倍,C1和C2处理下的值高于CK处理;可溶性糖质量摩尔浓度依次是10 d时的2.03、2.78、4.71、3.62倍(P<0.05),同时均显著高于CK处理(P<0.05)。说明在各质量分数胁迫下,蜡梅幼苗能通过增加渗透调节物质的含量来抵抗盐胁迫的伤害,且盐质量分数越大,渗透调节物质的增加量越大。
对细胞膜透性的影响:盐胁迫对相对电导率、MDA质量摩尔浓度和POD、SOD活性的影响如表2所示。叶片的相对电导率随胁迫时间的延长整体呈上升的趋势,胁迫10 d时,C2、C3、C4处理下叶片相对电导率骤升;20~40 d时,整体增速减缓;试验结束时(C1、C2于胁迫40 d时结束试验,C3、C4于胁迫30 d时结束试验),C1、C2、C3、C4处理下的值依次是0 d时的1.64、4.38、4.37、4.17倍(P<0.05),分别是CK处理下的1.85、4.38、4.09、4.12倍(P<0.05)。在不同盐质量分数处理下,胁迫10 d以后,MDA质量摩尔浓度均随胁迫时间的延长呈现显著的升高趋势。在40 d时,C1和C2处理下叶片的MDA质量摩尔浓度分别是0 d时的2.65倍和2.67倍(P<0.05);分别是CK处理下的2.55倍和2.83倍(P<0.05)。说明,蜡梅幼苗的叶片细胞膜透性在不同质量分数的盐胁迫下受到不同程度的影响,除0.3%质量分数外,其余盐质量分数胁迫均导致细胞膜稳定性下降。
对抗氧化酶的影响:盐胁迫对POD、SOD活性的影响如表2所示。POD、SOD活性在不同盐质量分数胁迫下,随胁迫时间的延长均逐渐增大。在试验初期POD活性与CK处理间差异不显著,随盐胁迫时间的延长,叶片POD活性在30 d时达到最大涨幅,C1、C2、C3、C4处理下较20 d依次增加55.58%、33.05%、26.46%、11.41%(P<0.05),盐质量分数越高,涨幅越小。在40 d时,C1、C2处理下的SOD活性分别是0 d时的2.11、2.62倍(P<0.05),分别是CK处理的2.08、2.50倍(P<0.05)。胁迫20 d后,C3、C4处理下的SOD活性均低于C2处理,C1处理下的POD活性则始终高于其他处理,说明当胁迫质量分数在0.3%~0.6%时,保护酶活性得到显著提高,当质量分数高于这个范围,保护酶活性受到抑制。

表2 盐胁迫对5年生蜡梅各生理指标的影响

盐质量分数/%游离脯氨酸质量分数/mg·g-10d10d20d30d40dCK(0.31±0.03)Cb(0.44±0.05)Dab(0.40±0.03)Cab(0.32±0.04)Cb(0.64±0.18)Ca0.3(0.45±0.02)Bd(1.00±0.03)Cc(1.61±0.11)BCb(2.33±0.28)Ba(2.68±0.14)Ba0.6(0.29±0.02)Cd(1.04±0.11)Cc(2.62±0.07)ABb(2.92±0.34)Bb(3.65±0.20)Aa0.9(0.36±0.03)Cb(2.26±0.15)Aa(3.37±0.71)Aa(3.46±0.68)ABa—1.2(0.53±0.03)Ad(1.66±0.10)Bc(2.61±0.53)ABb(4.27±0.03)Aa—
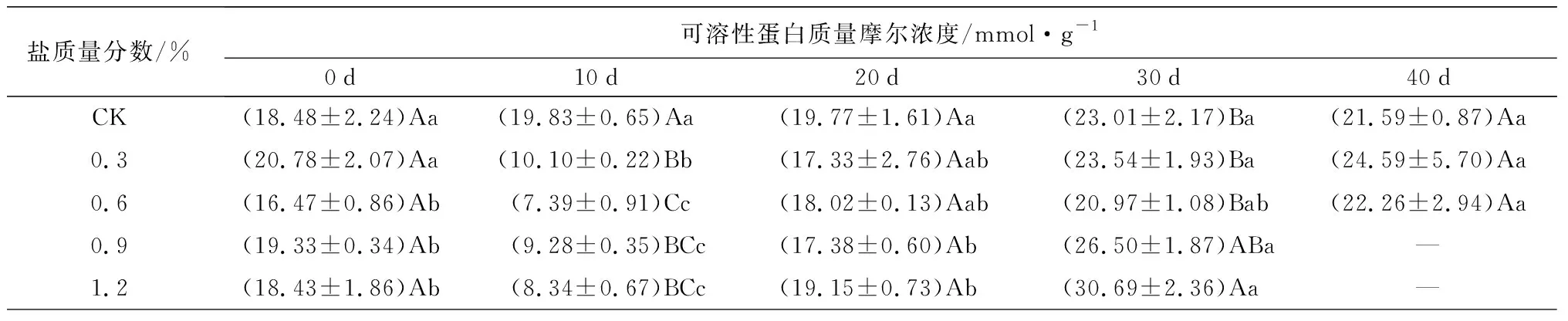
盐质量分数/%可溶性蛋白质量摩尔浓度/mmol·g-10d10d20d30d40dCK(18.48±2.24)Aa(19.83±0.65)Aa(19.77±1.61)Aa(23.01±2.17)Ba(21.59±0.87)Aa0.3(20.78±2.07)Aa(10.10±0.22)Bb(17.33±2.76)Aab(23.54±1.93)Ba(24.59±5.70)Aa0.6(16.47±0.86)Ab(7.39±0.91)Cc(18.02±0.13)Aab(20.97±1.08)Bab(22.26±2.94)Aa0.9(19.33±0.34)Ab(9.28±0.35)BCc(17.38±0.60)Ab(26.50±1.87)ABa—1.2(18.43±1.86)Ab(8.34±0.67)BCc(19.15±0.73)Ab(30.69±2.36)Aa—

盐质量分数/%可溶性糖质量摩尔浓度/mmol·g-10d10d20d30d40dCK(697.14±45.92)ABa(879.24±17.46)Aa(836.06±109.67)Ca(795.43±123.11)Da(700.19±151.30)Ba0.3(649.52±25.76)Bc(576.38±14.45)Bc(901.14±102.96)BCb(1111.30±120.16)Cab(1168.13±45.39)Aa0.6(640.79±25.80)Bc(507.49±52.01)Bc(942.73±57.79)BCb(1304.63±109.76)Ca(1411.62±132.11)Aa0.9(782.86±15.49)Ac(525.48±13.67)Bbc(1434.16±204.66)Ab(2476.70±56.52)Aa—1.2(773.33±35.74)Ac(524.00±13.74)Bd(1307.81±100.07)ABa(1897.65±53.98)Ba—
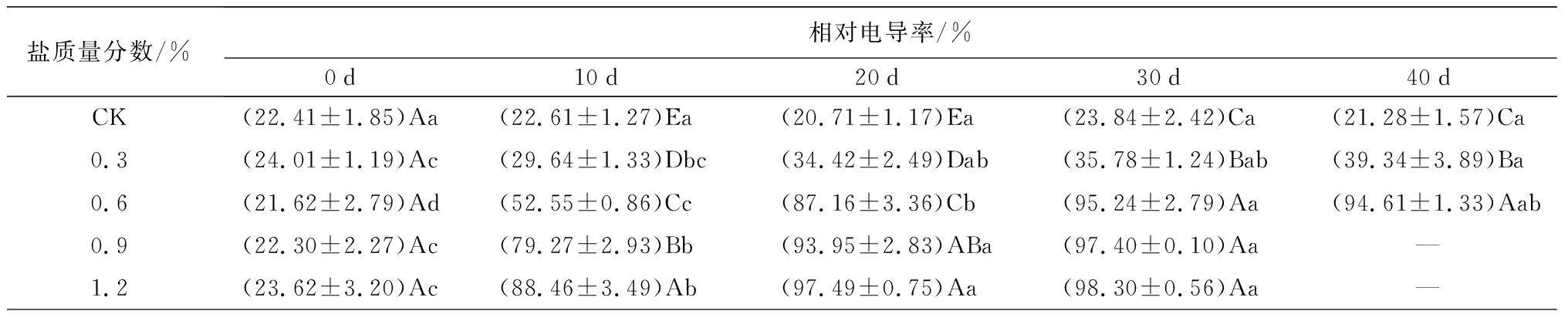
盐质量分数/%相对电导率/%0d10d20d30d40dCK(22.41±1.85)Aa(22.61±1.27)Ea(20.71±1.17)Ea(23.84±2.42)Ca(21.28±1.57)Ca0.3(24.01±1.19)Ac(29.64±1.33)Dbc(34.42±2.49)Dab(35.78±1.24)Bab(39.34±3.89)Ba0.6(21.62±2.79)Ad(52.55±0.86)Cc(87.16±3.36)Cb(95.24±2.79)Aa(94.61±1.33)Aab0.9(22.30±2.27)Ac(79.27±2.93)Bb(93.95±2.83)ABa(97.40±0.10)Aa—1.2(23.62±3.20)Ac(88.46±3.49)Ab(97.49±0.75)Aa(98.30±0.56)Aa—

盐质量分数/%MDA质量摩尔浓度/mmol·g-10d10d20d30d40dCK(16.53±0.44)Aa(15.93±1.95)Aa(17.49±0.98)Ba(13.72±2.24)Da(15.61±1.25)Ba0.3(15.20±0.98)Ac(17.75±2.89)Ac(22.73±2.68)Bbc(30.56±3.73)Cb(39.86±1.34)Ba0.6(16.51±1.64)Ab(18.24±2.31)Ab(23.46±3.38)Bb(38.55±1.27)Ba(44.15±2.46)Aa0.9(16.11±1.11)Ac(17.74±2.61)Ac(32.18±1.10)Ab(46.61±1.20)Aa—1.2(16.19±2.65)Ac(19.97±2.27)Ac(30.72±1.22)ABb(44.58±2.39)ABa—
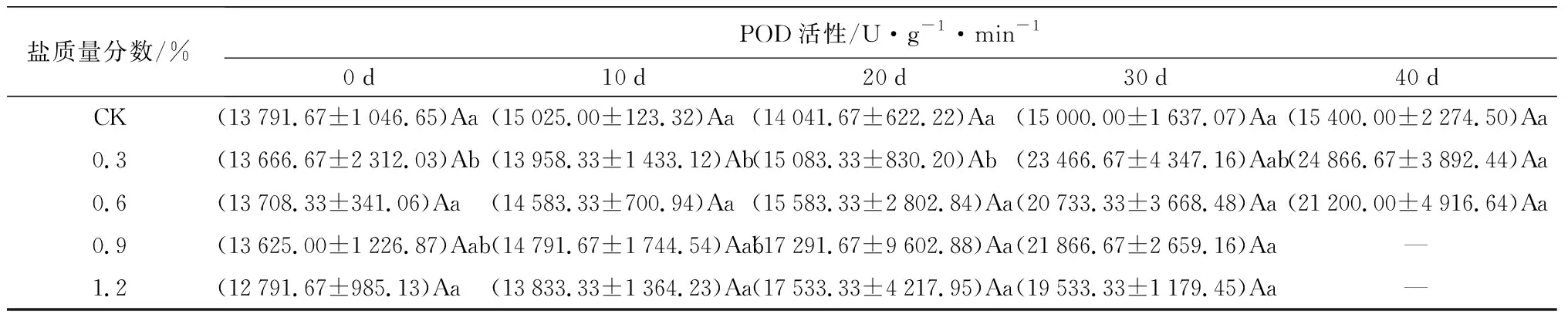
盐质量分数/%POD活性/U·g-1·min-10d10d20d30d40dCK(13791.67±1046.65)Aa (15025.00±123.32)Aa (14041.67±622.22)Aa (15000.00±1637.07)Aa(15400.00±2274.50)Aa0.3(13666.67±2312.03)Ab(13958.33±1433.12)Ab(15083.33±830.20)Ab(23466.67±4347.16)Aab(24866.67±3892.44)Aa0.6(13708.33±341.06)Aa(14583.33±700.94)Aa(15583.33±2802.84)Aa(20733.33±3668.48)Aa(21200.00±4916.64)Aa0.9(13625.00±1226.87)Aab(14791.67±1744.54)Aab(17291.67±9602.88)Aa(21866.67±2659.16)Aa—1.2(12791.67±985.13)Aa(13833.33±1364.23)Aa(17533.33±4217.95)Aa(19533.33±1179.45)Aa—
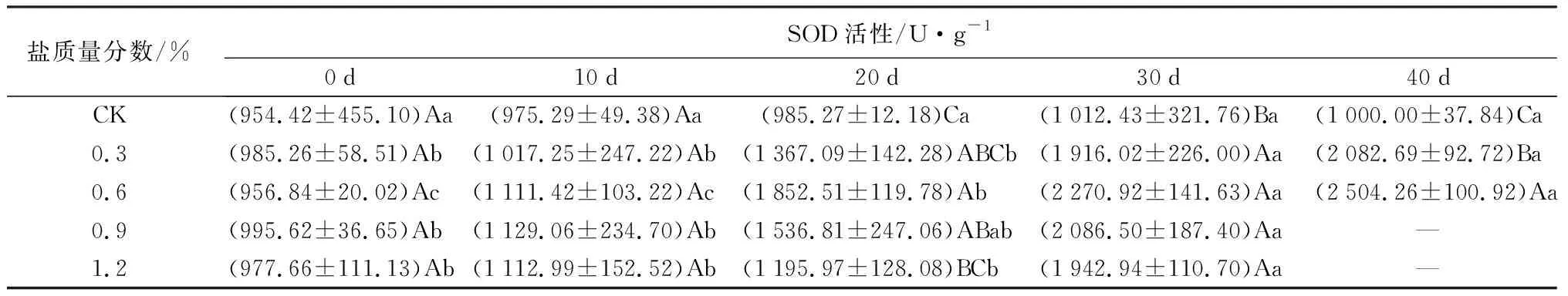
续(表2)
2.3 盐胁迫对蜡梅叶绿素荧光参数的影响
盐胁迫对叶绿素荧光参数的影响如表3所示。Fv/Fm和Y(II)变化趋势基本一致,C1处理下变化较稳定,与CK接近;C2、C3和C4处理下随胁迫时间的延长总体表现为下降趋势。试验结束时(C1、C2于胁迫40 d时结束试验,C3、C4于胁迫30 d时结束试验),除C1处理下与0 d时及CK处理间的差异不显著外,其他处理组的最终测量值均与0 d时及CK处理间存在显著差异(P<0.05),C2、C3和C4处理的Fv/Fm值比0 d时分别下降了33.33%、18.18%、44.16%,C2、C3和C4处理的Y(II)值比0 d时分别下降了58.33%、48.00%、88.00%。qP和rE,T,R的变化趋势也基本类似:C1处理在试验前30 d时,qP和rE,T,R的值逐渐下降,但在40 d时转而上升,向CK处理靠近;C2、C3和C4处理下随胁迫时间的延长呈明显下降趋势。C1处理在40 d时qP、rE,T,R的值较30 d时分别增长14.08%、4.87%,同时C1处理与CK处理下的差异不显著(P<0.05)。说明0.3%盐质量分数对蜡梅叶片PSII反应中心未造成明显伤害,随盐质量分数增大,加剧了胁迫对PSII反应中心活性的降低和电子传递效率的降低,造成不可逆的伤害。
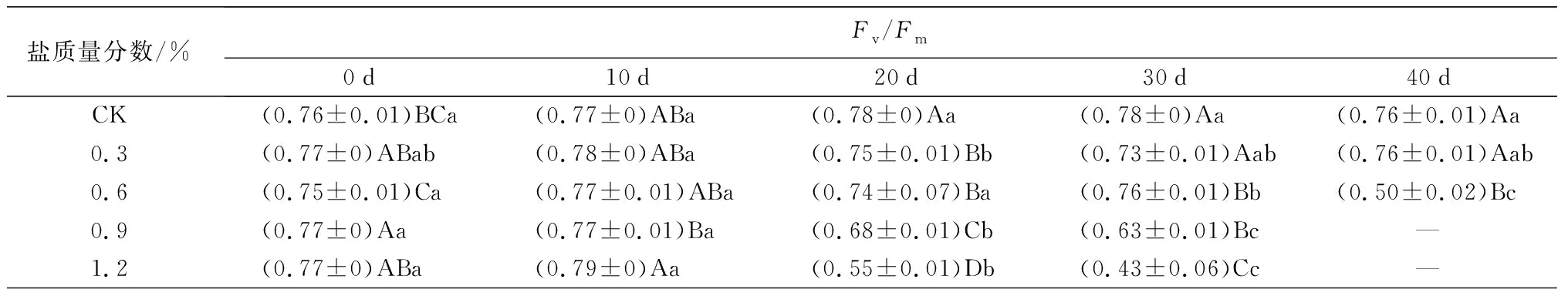
表3 盐胁迫对5年生蜡梅叶绿素荧光参数的影响
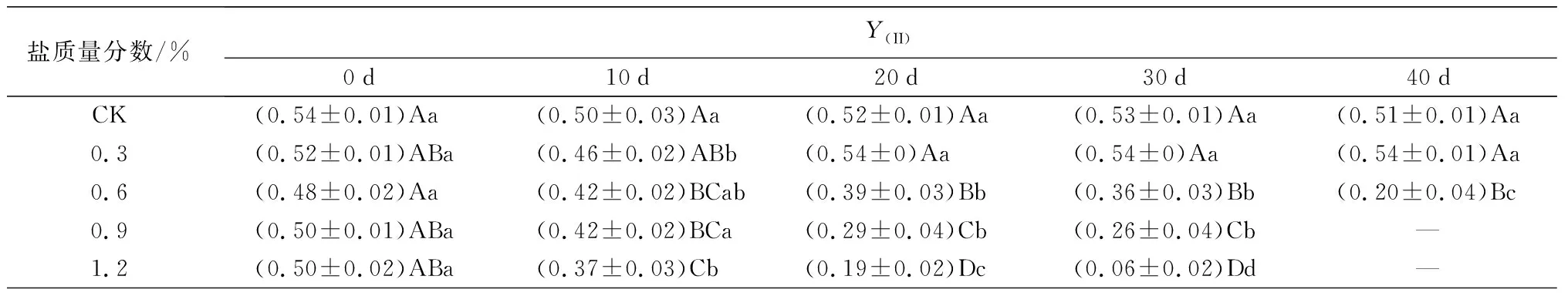
盐质量分数/%Y(II)0d10d20d30d40dCK(0.54±0.01)Aa (0.50±0.03)Aa(0.52±0.01)Aa(0.53±0.01)Aa(0.51±0.01)Aa0.3(0.52±0.01)ABa(0.46±0.02)ABb(0.54±0)Aa(0.54±0)Aa(0.54±0.01)Aa0.6(0.48±0.02)Aa(0.42±0.02)BCab(0.39±0.03)Bb(0.36±0.03)Bb(0.20±0.04)Bc0.9(0.50±0.01)ABa(0.42±0.02)BCa(0.29±0.04)Cb(0.26±0.04)Cb—1.2(0.50±0.02)ABa(0.37±0.03)Cb(0.19±0.02)Dc(0.06±0.02)Dd—
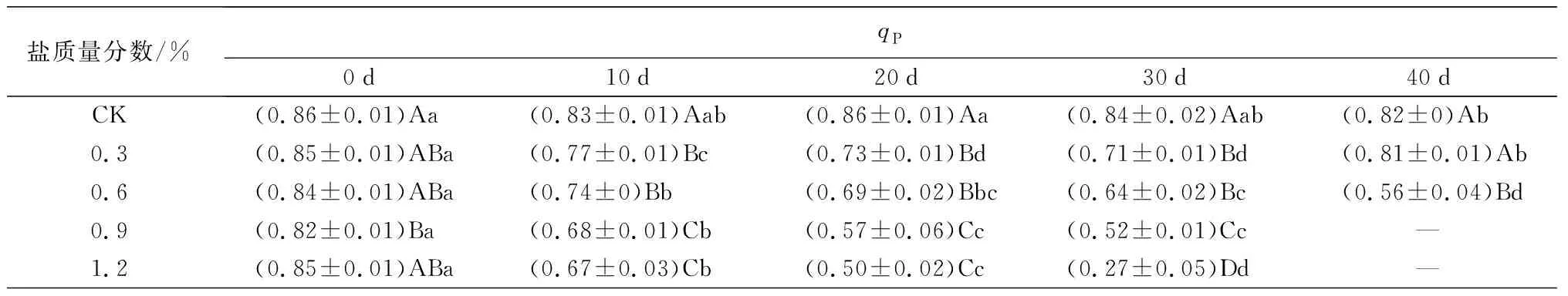
盐质量分数/%qP0d10d20d30d40dCK(0.86±0.01)Aa (0.83±0.01)Aab(0.86±0.01)Aa(0.84±0.02)Aab(0.82±0)Ab 0.3(0.85±0.01)ABa(0.77±0.01)Bc(0.73±0.01)Bd(0.71±0.01)Bd(0.81±0.01)Ab0.6(0.84±0.01)ABa(0.74±0)Bb(0.69±0.02)Bbc(0.64±0.02)Bc(0.56±0.04)Bd0.9(0.82±0.01)Ba(0.68±0.01)Cb(0.57±0.06)Cc(0.52±0.01)Cc—1.2(0.85±0.01)ABa(0.67±0.03)Cb(0.50±0.02)Cc(0.27±0.05)Dd—

盐质量分数/%rE,T,R0d10d20d30d40dCK(23.50±0.38)Aa(21.84±1.01)Aa (22.50±0.59)Aa (22.74±0.65)Aa (21.98±0.36)Aa0.3(22.50±0.59)Aa(20.58±0.63)ABab(19.26±0.76)ABb(18.48±0.98)Bb(19.38±0.89)Bb0.6(22.16±0.41)Aa(18.00±0.83)BCb(16.46±0.75)BCb(15.18±0.84)BCb(8.80±1.57)Cc0.9(21.36±0.53)Aa(18.10±0.78)BCa(13.24±2.19)Cb(11.84±2.01)Cb—1.2(22.00±1.11)Aa(16.12±1.12)Cb(8.42±1.06)Dc(2.48±0.66)Dd—
2.4 蜡梅耐盐因子综合分析
通过对蜡梅12个单项生理指标的耐盐系数进行Person相关性分析,从表4可以看出,各指标间存在一定的相关性,其中部分指标间己达到显著或极显著水平,即这些指标提供的耐盐信息发生了重叠[10]。植物耐盐性由多种因素决定,各项指标在耐盐性评价中所起的作用不同,单一指标的评价存在一定片面性,因此,需要对各项指标进行主成分分析。由表5可知,主成分1和主成分2的贡献率分别为79.819%和14.070%,累计贡献率高达93.889%,主成分1中含水量、POD活性,MDA、可溶性糖质量摩尔浓度,游离脯氨酸质量分数,Fv/Fm、Y(II)、rE,T,R的负载权数绝对值大于0.900;主成分2中可溶性蛋白质量摩尔浓度的负载权数大于0.700。
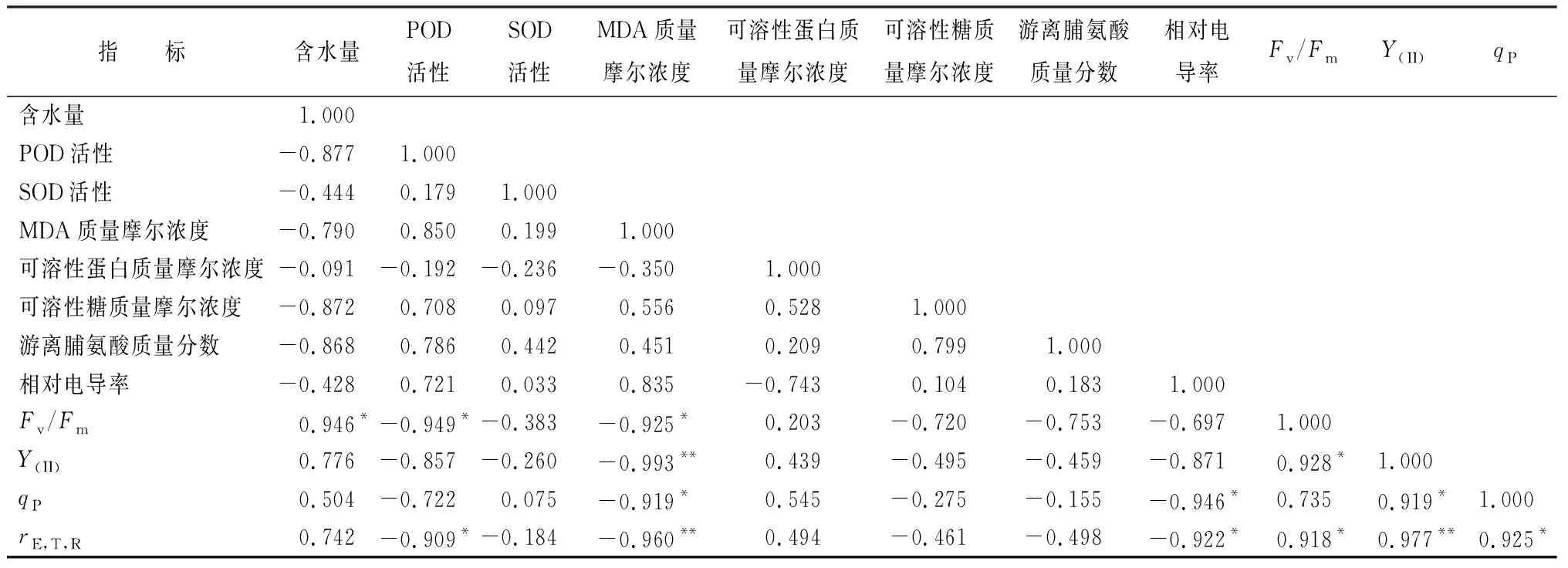
表4 蜡梅幼苗各测定指标的相关系数矩阵

表5 蜡梅各测定指标的主成分分析
3 结论与讨论
外部形态的变化是判断植物盐害程度最直观的指标[11],且植物能通过改变自身的形态来应对环境的变化并保证自我生存与茂盛生长[12]。本研究发现,蜡梅植株地上部分各部位生长量随盐质量分数增加而下降,叶片出现不同程度的萎蔫和脱落现象。0.3%盐质量分数处理组,少量下部叶片的叶尖与边缘出现暂时性萎蔫,存活率100%,与对照组相比差异不显著。当盐质量分数高于0.6%时,下部叶片萎蔫脱落,存活率降低,在1.2%的盐质量分数下,处理后期叶片全部脱落,植株死亡。这与多数研究结果一致,如梅花(Prunusmume)[13]和蚬木(Excentrodendronhsienmu)[14]。说明在低质量分数盐胁迫下,蜡梅幼苗能通过减缓生长速率来应对,但随着胁迫强度的增大,植物生长受到严重抑制,加速衰老及死亡。盐离子逐渐积累不仅抑制植物地上部分的生长,还严重影响根系伸长区与成熟区细胞的分裂与分化,并导致根系分泌的黏性物质减少,影响有益细菌的生长,进而影响植物根冠的生长[15]。在本研究中,植株根系的侧根数量随胁迫加剧而显著减少,说明在盐质量分数超过0.6%后,蜡梅根系生长受到明显抑制,这可能影响植物从土壤中吸取水分,进而导致蜡梅叶片萎蔫和地上部分生长受到抑制,但关于盐胁迫对根系影响的机理需进一步探讨。
植物对盐胁迫的响应是多种生理生化作用相互影响的结果,植物叶片的组织含水量能真实地反映植物体内水分亏缺情况。本研究中,叶片组织含水量随着盐胁迫程度加剧而逐渐下降,这与梅花(Prunusmume)[16]、夏蜡梅(Calycanthuschinensis)[11]的研究结果一致,说明在高盐质量分数胁迫下,由于土壤含水量的降低,导致植株细胞吸水困难,也可能是持续的盐胁迫(40 d)使蜡梅体内产生离子毒害,造成水分代谢的紊乱,造成细胞失水严重。当植物体内水分亏缺时,细胞可通过积累可溶性糖(SS)、可溶性蛋白(SP)、游离脯氨酸(Pro)等有机溶质来降低细胞内的渗透势,提高细胞保水性,维持自身水分平衡。本研究中,蜡梅幼苗叶片可溶性蛋白、可溶性糖质量摩尔浓度随盐胁迫时间的延长均呈先减少后增加的变化趋势,游离脯氨酸质量分数则持续上升。这与梅花(Prunusmume)[13]的持续增加趋势有所不同,说明蜡梅幼苗在盐胁迫初期,植物因合成渗透调节物质而消耗可溶性糖,随胁迫时间延长,细胞水分外渗,糖利用减少,可溶性糖质量摩尔浓度转而增加;叶片细胞受离子毒害,促使蛋白质分解[16],可溶性蛋白质量摩尔浓度大幅下降,可溶性蛋白具有脱水保护功能[17],随着植物的失水,细胞开始合成蛋白质[18],可溶性蛋白质量摩尔浓度转而增加。蛋白质被分解成各种氨基酸,使游离脯氨酸质量分数持续增加,降低叶片的渗透势,减轻植物的盐害程度[19]。
盐胁迫下植物体内产生大量活性氧自由基,对细胞膜脂造成直接损伤[20],电解质外渗率能反映膜系统的完整性,电解质外渗越多,细胞膜的损伤程度越大[21],电解质外渗程度通常用相对电导率来衡量;MDA是膜脂过氧化的主要产物,可衡量膜损伤程度的大小[22];POD和SOD是清除活性氧的主要抗氧化酶,较高的活性能保护膜系统不受自由基的伤害。本研究结果表明,MDA质量摩尔浓度和相对电导率随胁迫时间延长和胁迫程度加剧而逐渐增加,两者的变化趋势与观音竹(Bambusadeamultiplexvar.riviereorum)[20]的研究结果基本一致。另外,蜡梅幼苗的POD、SOD活性随盐胁迫程度加剧和时间的延长均呈现升高趋势,尤其是在胁迫20~30 d时急剧上升。这说明蜡梅叶片细胞膜在0.3%盐质量分数以下的低盐环境中受害程度较低,叶片能通过保护酶系统来维持细胞的正常代谢,当盐质量分数大于0.9%时,植株叶片焦枯脱落严重,高盐胁迫使蜡梅产生过多活性氧,超过保护酶系统的清除能力[23]。胁迫初期,蜡梅幼苗能通过保护酶的协同作用,使植物体不受活性氧自由基的伤害,随时间的延长,在高质量分数的盐胁迫下,膜系统遭到不可逆损伤,持续升高的POD和SOD活性不足以清除过量的自由基。
叶绿素荧光参数能有效反映光合作用能量捕获及电子传递等诸多方面的情况,可以作为内在探针研究植物光合作用与环境胁迫的关系[24]。本研究发现,在0.3%的盐质量分数下,Fv/Fm和Y(II)与对照间无显著差异,而qP和rE,T,R试验前30 d时逐渐下降,40 d时转而上升,靠近对照;在0.6%~1.2%的盐质量分数下,蜡梅的Fv/Fm、Y(II)、qP、rE,T,R总体上呈持续下降趋势。该结果与梅花(Prunusmume)自根苗、嫁接苗[25]的研究结果相符,表明蜡梅能适应0.3%质量分数的低盐胁迫,PSII潜在活性虽然受到暂时性抑制,但在后期恢复,在超过0.6%质量分数的高盐胁迫下,PSII光合中心受到不可逆的损伤,光合电子传递受到严重抑制,推测与蜡梅在高盐胁迫下糖的积累有关,盐胁迫下糖利用减少,使PSII潜在活性中心受到损伤,不利于激发能由捕光色素蛋白复合体(LHC)向PSII进行传递,进而抑制光合作用[26]。
由耐盐因子的综合分析可知,主成分反映了90%以上的耐盐信息,可将叶片组织含水量、POD活性、MDA质量摩尔浓度、Fv/Fm、Y(II)、rE,T,R、游离脯氨酸质量分数、可溶性糖质量摩尔浓度筛选为主要评定指标,而相对电导率、SOD活性、可溶性蛋白、qP归为蜡梅耐盐性的次要参考指标。
不同质量分数盐胁迫对5年生蜡梅的生长和生理特性试验结果表明,蜡梅有一定的耐盐能力,植株在低质量分数(0.3%)时表观特征、叶片组织含水量、相对电导率的变化不显著,通过提高POD、SOD活性来清除活性氧的危害和通过增加游离脯氨酸(Pro)质量分数、可溶性糖和可溶性蛋白质量摩尔浓度来减轻渗透胁迫的危害;随盐胁迫程度的加深,植株出现叶片发黄焦枯、卷曲、根系减少、植株死亡等表观症状,蜡梅植株的各器官生长量与盐质量分数间呈极显著负相关(P<0.01),相对电导率和MDA质量摩尔浓度增加,叶片组织含水量、各叶绿素荧光参数值显著降低,造成PSII中心的损伤,严重影响植株的光合作用。因此,蜡梅在低质量分数盐胁迫下能保持正常的代谢,但不适宜在重度盐碱地生长,同时筛选出叶片组织含水量、POD活性、MDA质量摩尔浓度、游离脯氨酸质量分数、可溶性糖质量摩尔浓度、Fv/Fm、Y(II)、rE,T,R作为评价蜡梅耐盐性的主要生理指标。

