硫唑嘌呤治疗炎症性肠病的疗效及骨髓抑制相关不良反应分析研究
郭玲,罗雪梅(.南京大学医学院附属口腔医院(南京市口腔医院)药学部,南京 0008;.南京大学医学院附属鼓楼医院药学部,南京 0008)
炎症性肠病(inflammatory bowel disease,IBD)是一类慢性非特异性肠道炎症,具有病程迁延,反复发作,活动期与缓解期交替存在的特点[1],主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)。目前其病因仍不十分明确,普遍认为是遗传、环境、免疫、心理等多种因素共同作用导致的[2]。近年来,我国IBD 发病率正逐年攀升[3]。传统认为IBD 好发于40 ~50 岁,而CD 相对年轻化,但也有研究发现<20 岁的少年患者和>60 岁的高龄患者发病率亦呈明显增高趋势,且各年龄段临床特点与疾病特征也有所不同[2]。硫唑嘌呤(azathioprine,AZA)常作为免疫抑制剂用于IBD 的治疗,在疾病发展的不同时期均有重要作用,但起效较慢,在缓解期帮助激素减量和撤离并维持缓解症状方面疗效突出[4-5]。然而,由于AZA 在临床应用过程中存在个体疗效差异显著、相关不良反应发生率高等问题,限制了其在临床的广泛应用。AZA 活性代谢产物6-硫鸟嘌呤核苷酸(6-thioguanine nucleotides,6-TGN)的血药浓度被认为与AZA 疗效及不良反应的发生密切相关[6];此外,有研究发现,女性患者服用AZA出现白细胞降低的概率是男性的5.98 倍[7]。本研究收集了131 例IBD 患者,通过统计分析其基本资料、生化指标、血药浓度等,初步探讨疾病活动度、年龄、性别、6-TGN 浓度对AZA 治疗IBD 的疗效以及骨髓抑制相关不良反应的影响,以期为临床安全合理用药提供参考。
1 资料与方法
1.1 研究对象
回顾性分析2017年11月至2019年6月南京鼓楼医院消化内科收治的IBD 住院患者共131例。纳入标准为:①年龄>14 岁;② 符合《炎症性肠病诊断与治疗的共识意见》的诊断标准(2018年,北京)[8];③ 无使用AZA 的禁忌证。排除标准为:① 严重的心脏、肝和/或肾功能不全的患者[6];② 患有严重精神疾病(如躁狂症、癫痫、精神分裂症等)的患者;③ 患有急性腹部疾病或其他手术适应证的患者;④ 接受AZA 治疗之前已出现骨髓抑制表现的患者[6]。
1.2 资料收集
AZA 的初始剂量为(1.24±0.16)mg/(kg·d),在AZA 疗程长于2 个月后,部分患者被采集外周静脉血样,进行红细胞(red blood cell,RBC)内6-TGN 浓度测定;同时收集所有患者的各项生化指标用于疗效和不良反应评估:疗效评估指标包括炎性指标白蛋白(albumin,ALB)、红细胞沉降率(erythrocyte sedimentation rate,ESR)和D-二聚体(D-dimer,D-D)[9-11],患者经治疗后,上述3 项指标中仍有两项及以上指标异常,则认为该患者经AZA 治疗无效,反之认为治疗有效[9]。AZA 引起的不良反应中,骨髓抑制为最常见的严重不良反应,主要表现为白细胞减少(WBC <4.0×109·L-1),中性粒细胞减少(NEUT<2.0×109·L-1),贫血[血红蛋白(HGB)浓度:女性<110 g·L-1,男性<120 g·L-1]以及血小板减少(PLT <100×109·L-1)[11-12]。
1.3 分组标准
对所纳入的患者进行浓度分组,具体分组标准如下:按照文献[13]推荐的6-TGN 目标血药浓度235 ~450 pmol/(8×108RBC),将接受6-TGN浓度测定的68 例患者分为3 组,其中低浓度组[C1 <235 pmol/(8×108RBC)] 16 例、中浓度组[235≤C2≤450 pmol/(8×108RBC)] 39例,高浓度组[C3 >450 pmol/(8×108RBC)] 13 例。
1.4 统计学分析
应用SPSS 22.0 软件进行统计分析,计量资料用±s表示,正态分布资料采用单因素方差分析,非正态分布资料采用非参数秩和检验;计数资料采用χ2检验;多因素分析采用二项Logistics回归分析。P<0.05 认为差异具有统计学意义。
2 结果
2.1 患者一般情况
共收集IBD 患者131 例,其中UC 31 例,CD 86 例,未确定症型14 例;男性78 例,女性53 例,平均年龄为(33.32±12.45)岁(15 ~71 岁),其中有68 例患者接受了6-TGN 血药浓度检测,平均浓度为(336.33±202.55)[50.10 ~1098.00 pmol/(8×108RBC)]。
2.2 AZA 疗效影响因素分析
2.2.1 疾病活动度与AZA 疗效的相关性 根据文献推荐[13-15],以患者入院时测得的血液指标超敏C 反应蛋白(CRP)6.0 mg·L-1为IBD 疾病活动度和严重程度评价标准,即CRP <6.0 mg·L-1为缓解期,CRP ≥6.0 mg·L-1为活动期,本研究纳入的131 例患者中共有80 例处于缓解期,51 例处于活动期。如表1所示,缓解期与活动期患者的疗效指标中ALB、D-D 差异具有统计学意义(P<0.05);90.0%的缓解期患者治疗有效,仅有39.2%的活动期患者治疗有效,差异具有统计学意义(P<0.001)。
表1 不同疾病活动度和不同性别患者疗效比较结果 (± s)Tab 1 Curative effect of male and female patients with different disease activities (± s)
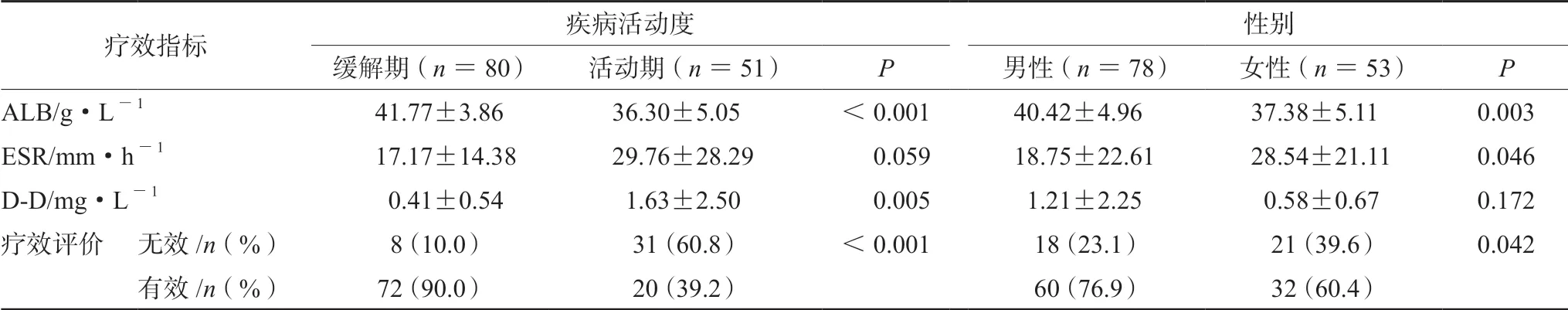
表1 不同疾病活动度和不同性别患者疗效比较结果 (± s)Tab 1 Curative effect of male and female patients with different disease activities (± s)
疗效指标 疾病活动度 性别缓解期(n =80) 活动期(n =51) P 男性(n =78) 女性(n =53) P ALB/g·L-1 41.77±3.86 36.30±5.05 <0.001 40.42±4.96 37.38±5.11 0.003 ESR/mm·h-1 17.17±14.38 29.76±28.29 0.059 18.75±22.61 28.54±21.11 0.046 D-D/mg·L-1 0.41±0.54 1.63±2.50 0.005 1.21±2.25 0.58±0.67 0.172疗效评价 无效/n(%) 8(10.0) 31(60.8) <0.001 18(23.1) 21(39.6) 0.042有效/n(%) 72(90.0) 20(39.2) 60(76.9) 32(60.4)
2.2.2 患者性别与AZA 疗效的相关性 结果如表1所示,男性与女性患者的疗效指标中ALB、ESR 的差异均具有统计学意义(P<0.05)。39例患者治疗无效,其中男性18 例,女性21 例;有39.6%的女性患者治疗无效,23.1%男性患者无效,差异具有统计学意义(P<0.05)。
2.2.3 患者年龄与AZA 疗效的相关性 131 例患者中共有92 例治疗有效,总有效率70.2%,有效组患者平均年龄(33.90±12.78)岁;39 例治疗无效,患者的平均年龄为(31.95±11.69)岁。两组患者的年龄分布差异无统计学意义(P>0.05)。
2.2.4 6-TGN 浓度与AZA 疗效的相关性 经计算,各组间疗效指标差异无统计学意义(P>0.05),但68 例测定浓度的患者中,有55 例治疗有效,平均6-TGN 血药浓度为(348.84±194.73) [50.10~1098.00 pmol/(8×108RBC)];13 例治疗无效,患者6-TGN浓度明显偏低,仅为(283.42±233.87) [50.10 ~757.00 pmol/(8×108RBC)]。且 低 浓 度 组 中 有31.3%(5 例)的患者治疗无效,而中、高浓度组患者中治疗无效率在15%左右,如图1所示,提示6-TGN 浓度低导致治疗失败的概率更大。
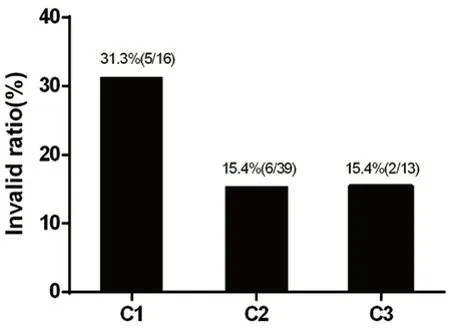
图1 不同6-TGN 浓度组的治疗无效率差异Fig 1 Ineffective treatment rate in groups with different 6-TGN concentrations
2.2.5 AZA 疗效影响因素的Logistics 回归分析结果如表2所示,提示疾病活动度是影响AZA疗效的关键因素。
2.3 AZA 致骨髓抑制相关不良反应影响因素分析
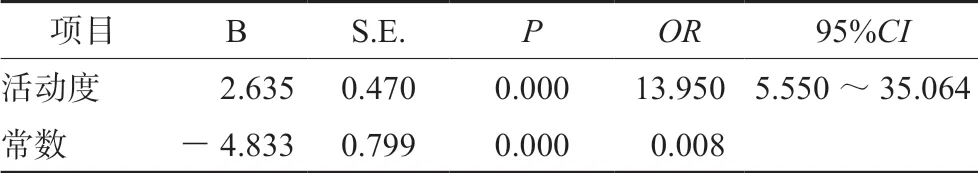
表2 AZA 疗效影响因素的多因素Logistics 分析结果Tab 2 Logistics analysis of influencing factors on AZA curative effect
2.3.1 疾病活动度与AZA 致骨髓抑制的相关性
缓解期与活动期患者的各项骨髓抑制不良反应发生率如表3所示,仅显示活动期患者较缓解期患者,女性患者较男性患者贫血发生率较高(P<0.05)。
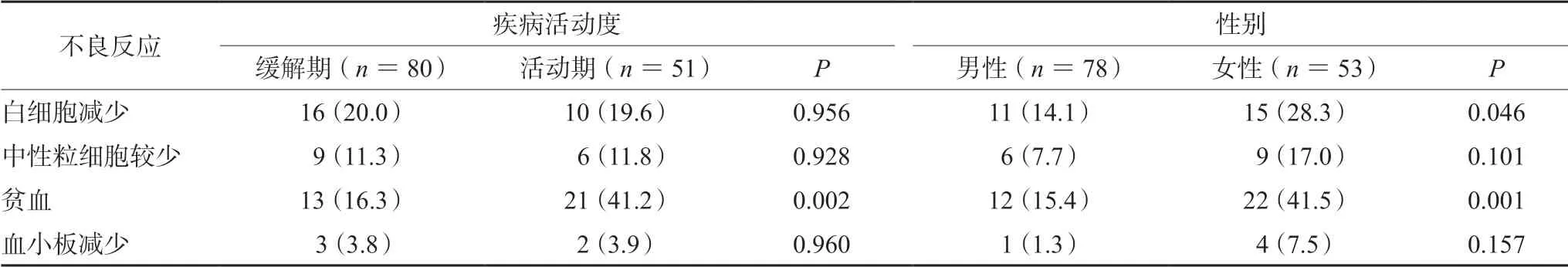
表3 不同疾病活动度和不同性别患者骨髓抑制不良反应发生率[n(%)]Tab 3 Adverse reaction related to bone marrow suppression in male and female patients with various disease activities [n(%)]
2.3.2 患者性别与AZA 致骨髓抑制的相关性共有26 例患者出现白细胞减少症,发生率为19.8%,其中女性患者15 例,发生率显著高于男性(P<0.05);共有34 例患者出现贫血症状,发生率为26.0%,其中女性患者22 例,发生率也显著高于男性(P<0.05);共出现15 例中性粒细胞减少,5 例血小板减少,该两项不良反应在男女性患者中发生率差异均无统计学意义(P>0.05)。
2.3.3 患者年龄与AZA 致骨髓抑制的相关性如表4所示,发生白细胞减少的26 例患者的年龄显著高于未发生该不良反应的患者(P=0.004),其他3 种不良反应发生与否与患者的年龄无关(P>0.05)。以患者年龄为检验变量绘制ROC 曲线预测白细胞减少症的发生,结果如图2所示,曲线下面积大于0.68,P<0.05,折点为39.5 岁,提示40 岁以上的老年患者更容易出现白细胞减少症。

表4 骨髓抑制相关不良反应发生与否的患者年龄分布情况Tab 4 Age of patients with or without bone marrow suppression related adverse reactions
2.3.4 6-TGN 血药浓度与AZA 致骨髓抑制的相关性 不同浓度组患者的WBC、NEUT、HGB、PLT 比较结果如表5所示,6-TGN 浓度越高的患者,WBC 水平越低,3 组总体WBC 水平差异具有统计学意义(P<0.05);68 例测定浓度的患者中共有19 例患者发生白细胞减少症,其中低浓度组3 例,发生率为18.8%(3/16),中浓度组11 例发生率为28.2%(11/39),高浓度组5 例,发生率为38.5%(5/13),随着6-TGN 浓度的升高,白细胞减少症的发生率也不断升高,如图3所示。
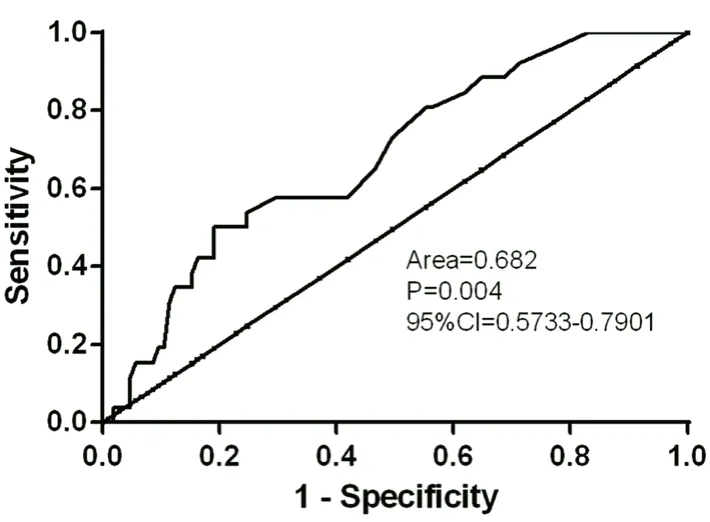
图2 年龄预测白细胞减少的ROC 曲线Fig 2 ROC curve of age predicting the incidence of leukopenia
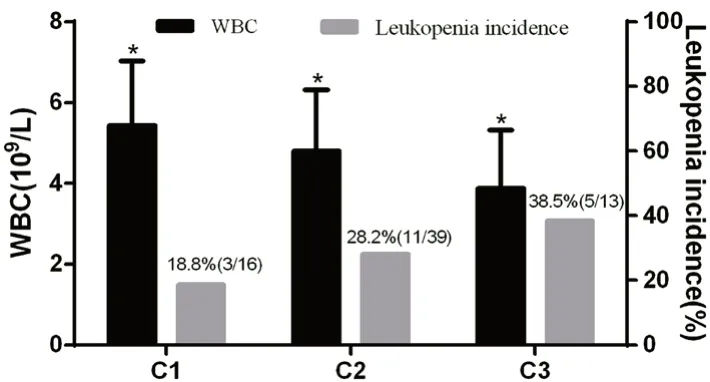
图3 不同浓度组患者白细胞计数水平及白细胞减少症发生率Fig 3 WBC count and incidence of leukopenia in patients with different 6-TGN concentrations
2.3.5 白细胞减少症影响因素的Logistics 回归分析由以上分析可知,患者性别、年龄、6-TGN 浓度均与白细胞减少症的发生存在相关性,通过多因素Logistics 回归分析,结果显示,年龄是AZA 致白细胞减少症发生的危险因素,如表6所示。
3 讨论
3.1 活动度对疗效的影响
本研究统计发现,处于IBD 活动期的患者服用AZA 较难获得理想疗效,这是由于AZA 作用机制为经过多种途径代谢后影响核酸合成从而起到免疫抑制作用,导致该药在用药2 ~3 个月后才能达到稳态血药浓度,产生稳定疗效,故AZA不适用于急性活动期单药治疗活动性病变,联合糖皮质激素治疗时有助于糖皮质激素的减量和撤离,并维持缓解[16]。因此该药在缓解期患者中疗效较好。
表5 不同6-TGN 浓度组患者骨髓抑制不良反应指标 (± s)Tab 5 Adverse reaction indicators related to bone marrow suppression in patients with different 6-TGN concentrations (± s)
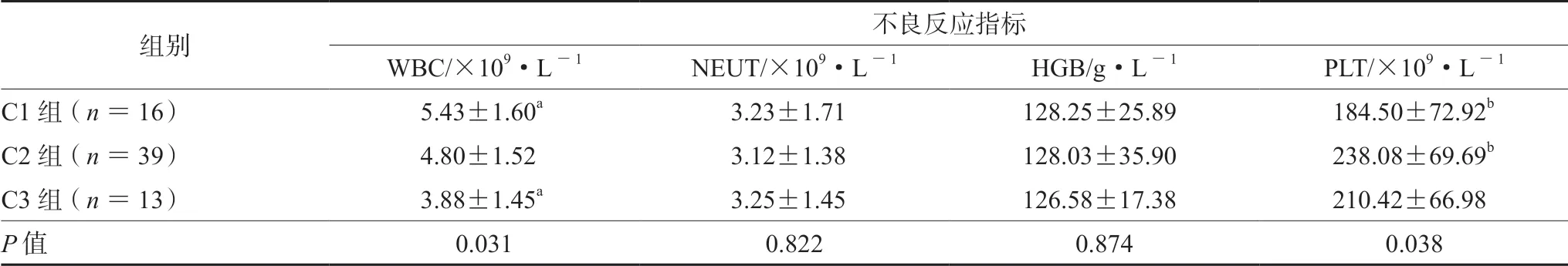
表5 不同6-TGN 浓度组患者骨髓抑制不良反应指标 (± s)Tab 5 Adverse reaction indicators related to bone marrow suppression in patients with different 6-TGN concentrations (± s)
注(Note):a.C1 与C3 组WBC 比较,P =0.009;b.C1 与C2 组PLT 比较,P =0.013(a.P =0.009 when comparing WBC of C1 and C3 group; b.P =0.013 when comparing PLT of C1 and C2 group)。
组别 不良反应指标WBC/×109·L-1 NEUT/×109·L-1 HGB/g·L-1 PLT/×109·L-1 C1 组(n =16) 5.43±1.60a 3.23±1.71 128.25±25.89 184.50±72.92b C2 组(n =39) 4.80±1.52 3.12±1.38 128.03±35.90 238.08±69.69b C3 组(n =13) 3.88±1.45a 3.25±1.45 126.58±17.38 210.42±66.98 P 值 0.031 0.822 0.874 0.038
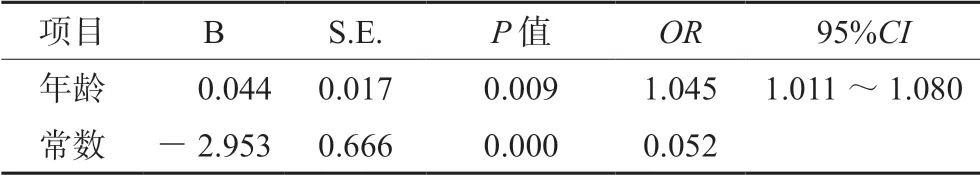
表6 白细胞减少症影响因素的多因素Logistics 分析结果Tab 6 Logistics analysis of influencing factors for leukopenia
在评估IBD 活动度及严重程度时,通常克罗恩病患者采用CDAI 评分,UC 患者采用修正的Truelove-Witts 评分,然而本研究在收集以上评分时,由于数据欠缺导致评分缺失值较多,影响统计效能,故选择了更易获得的血液指标CRP 作为活动度指标。很多研究显示[13-15],CRP 水平与评分成正相关,相关系数达0.8 以上,使用该指标便于在初次检查诊断中有效地筛选患者,判断IBD 炎症活动度,及早展开治疗,这为以后IBD活动度评价指标的选取提供了新思路。
3.2 年龄对骨髓抑制发生风险的影响
对年龄的研究发现,40 岁以上中老年患者更容易出现白细胞减少症等骨髓抑制相关不良反应,与蒙特利尔年龄分型折点及文献研究结果一致[2],可能是由于年龄较大的患者身体机能和代谢功能下降。有文献称老年IBD 患者普遍存在维生素D的代谢失衡,血清 25-羧维生素D 水平显著低于正常人群,维生素 D1-α羟化酶(CYP27B1)表达升高,这些都参与了IBD 的发生发展,与疾病进程密切相关[17]。还有研究显示60 岁以上IBD 患者的临床表现、治疗及预后与其他年龄组有很大的差异[2,18],也佐证了本文的结论。
3.3 6-TGN 浓度的影响
AZA 是一类前体药物,其活性代谢产物6-TGN 被认为与疗效和骨髓抑制相关不良反应密切相关[19-20],Hiroyuki 等[21]认为6-TGN 浓度较低的患者容易出现IBD 病情反复,而骨髓抑制在浓度高的患者中更易发生。Thierry 等[22]认为6-TGN浓度高于450 pmol/(8×108RBC)的患者出现白细胞减少症的风险增加。本研究也发现6-TGN 浓度较低的患者疗效较差,而高浓度组患者白细胞减少症发生风险高。此外,6-TGN 浓度个体差异大也是该药物代谢特点之一,本文纳入的68 例患者浓度范围为50.10 ~1098.00 pmol/(8×108RBC),最高浓度与最低浓度相差近20 倍,其他研究也曾提出过类似观点[23],对于不同个体来说,剂量对血药浓度不具有可预估性。这提示对服用AZA 的患者进行血药浓度监测并依据其调整给药方案是十分有必要的。
3.4 临床意义
本文结论提示,若患者处于缓解期可选择低剂量AZA 进行治疗以避免不良反应的出现;若患者病情严重或年龄大于40 岁,需要使用较大剂量AZA 时,则推荐同时定期检测6-TGN 血药浓度,若发现浓度高于450 pmol/(8×108RBC),需立即减量,提高警惕,密切观察有无骨髓抑制相关反应出现,并及时予以纠正。
3.5 不足与展望
首先,样本量少限制了一些亚组分析的进行:本研究收集的患者中仅有6 例年龄在60 岁以上,不足以进行该年龄组的亚组分析或与已有文献进行比较[2,18];对于疾病活动度的研究只进行了分期讨论,而未能对活动期患者再进行轻、中、重度分级讨论;仅考虑了疾病活动度、性别、年龄、6-TGN 浓度等因素,未能考虑基因型、心理状态、合并疾病等其他因素,可能不够全面,但对临床用药仍具有一定参考价值,后期将扩大样本量进行更深入全面的研究。
总之,AZA 治疗个体差异大,活动期患者疗效较差,中老年患者更易出现白细胞减少症等不良反应,需要关注患者基础生理条件,在有条件的情况下建议进行6-TGN 血药浓度检测和基因多态性检测,综合分析,以避免不良反应的发生并优化IBD 治疗效果。

