rhPA/GH双转基因兔的制备及rhPA表达检测
宋绍征,于康英,张婷,陆睿,潘生强,成勇,周鸣鸣
双转基因兔的制备及表达检测
宋绍征1,于康英1,张婷2,陆睿2,潘生强1,成勇2,周鸣鸣1
1无锡太湖学院护理学院基础医学系,江苏无锡 214064;2扬州大学兽医学院/江苏省转基因动物制药工程研究中心,江苏扬州 225009
【】双基因共整合可协同促进转基因生物的目的基因表达水平提高,研究获得双转基因兔,并比较分析目的基因的表达水平及兔个体生长发育情况,为制备高表达转基因动物和遗传育种提供新思路。利用ⅠⅠ双酶切PCL25/GH质粒和QIAGEN DNA胶纯化试剂盒回收显微注射用基因片段。以3只单转基因兔(标号K06、K10、K17)作为供体兔,通过FSH/hCG超数排卵、受精卵原核显微注射、胚胎移植、苯酚/氯仿抽提新生仔兔耳尖组织基因组、PCR整合检测等方法获得双转基因兔。经ELISA和Western blotting对转基因兔乳清进行表达检测,比较分析单、双基因表达rhPA水平。测量不同月龄的转基因兔体重,通过监测双转基因兔不同生长阶段的体重来分析对兔生长发育的影响。成功获得了约16 700 bp 大小的显微注射用基因片段,共超排3只供体兔获得122枚卵,其中103枚受精卵,受精率为84.4%(103/122),显微注射后挑取形态较好的81枚移植6只同步发情受体兔,5只兔怀孕,妊娠率为83.3%(5/6),妊娠到期共出生32只仔兔。通过PCR检测鉴定有19只携带基因的转基因兔,其中有11只双转基因兔(7♂,4♀),双基因整合率为34.4%(11/32),且4只rhPA/GH双转基因母兔来源亲代分别为K06供体兔2只(标号K06-1、K06-2)、K10供体兔1只(标号K10-1)、K17供体兔1只(标号K17-1)。K06号单转基因兔乳清中表达量为42.2μg·mL-1,K06-1和K06-2号双转基因兔乳清中rhPA表达量分别为432、444μg·mL-1;K10号rhPA单转基因兔乳清中rhPA表达量为42.8μg·mL-1,K10-1号双转基因兔乳清中rhPA表达量为636μg·mL-1;K17号rhPA单转基因兔乳清中rhPA表达量为15.2 μg·mL-1,K17-1号rhPA/GH双转基因兔乳清中rhPA表达量为248 μg·mL-1。4只rhPA/GH双转基因母兔(K06-1、K06-2、K10-1、K17-1)乳腺表达rhPA含量在248-636μg·mL-1之间,远远高于单转基因母兔(K06、K10、K17)乳腺的表达含量(15.2-42.8μg·mL-1),表达水平显著提高了约10.2-16.3倍,说明能够协同促进目的基因在转基因兔乳腺中的表达水平。Western blotting结果显示出现一约39.0 kD大小的条带,与目的蛋白rhPA大小相同,进一步证明转基因兔乳腺中表达的这种蛋白为目标产物rhPA。对双转基因兔从出生到6个月的体重进行连续测量,发现与正常非转基因兔的体重没有明显的差异,绘制生长曲线进一步表明4只整合的转基因兔与2只未整合的正常兔在生长发育的不同阶段体重上没有显著性差异,成长至6个月的体重均在4.0-5.0 kg之间,这证明的导入并不影响转基因兔的存活和正常生长发育至成年。成功地制备了双转基因兔,并证明了GH基因的导入能够显著地提高目的基因的表达量,且不会对转基因兔的生长发育产生影响,这为将来制备高表达转基因兔及其它动物奠定了基础,也为转基因动物乳腺生物反应器和转基因育种建立提供了新思路、新方法。
双转基因兔;表达;超数排卵;显微注射;生长曲线
0 引言
【研究意义】血栓病是一种严重威胁人类生命健康的常见多发病,溶栓疗法是目前临床上应用最广泛而有效的一种治疗方法[1-3]。人组织纤溶酶原激活剂(tissue-type plasminogen activator, tPA)是由血管内皮细胞合成并分泌的一种丝氨酸蛋白酶,能够高效特异地溶解血栓,属于一种良好的第二代溶栓药物[4]。重组人纤溶酶原激活剂(recombinant human plasminogen activator, rhPA)是天然tPA的重组突变体,属于新型第三代溶栓药物,具有较天然tPA更加优越的溶栓功效[5]。随着医学的不断发展,高产优质的新型溶栓药物日趋重要。因此,研究如何稳定提高rhPA的表达水平和产量,对于开发新型溶栓药物具有重要的指导意义,也为今后其它重组医药蛋白的高效表达研究和工业化生产奠定了基础。【前人研究进展】转基因技术可应用于动物遗传育种、生物反应器、疾病模型和器官移植等领域。目前,外源目的基因的表达沉默是转基因动物研究遇到的一个重要瓶颈,虽然利用友好位点(Rosa26、Hipp11、Pifs501)、定点整合(ZFNs、TALENs、CRISPR/Cas9)、优化顺式作用元件(启动子、内含子、增强子)等措施可克服或减轻基因表达沉默现象,但仍然存在一定的局限性[6-7]。因此,在优化提高转基因生物目的基因表达水平方面需要有针对性地灵活选择应用合理的技术手段。有研究证明,通过双基因共整合获得的转基因生物能够产生协同促进作用,提高目的基因的表达水平[8-9]。例如王林楠等[10]通过慢病毒介导和双基因转染大鼠神经干细胞,结果显示和mRNA相对表达量及蛋白表达量均明显地高于单基因转染。陈宁等[11]将与双基因转染大鼠BMSCs,显示双基因转染组的目的蛋白表达量明显地提高。徐莉等[12]利用双启动子构建人补体调节蛋白和转染小鼠成纤维细胞NIH3T3,和双基因均能够协同高效共表达,且表达水平明显得到提高。周慧[13]和吕本浩[14]等其他研究者也得出了双基因转染的目的蛋白表达水平高于单基因这一结论。【本研究切入点】家兔是一种应用最广泛的实验动物之一,与大型动物牛羊相比,具有排卵多、妊娠期短、繁殖力强、全年多发情等优点;与小鼠相比,具有泌乳量高、适合于生产重组医药蛋白等优点,可以填补大型和小型动物间的“空白”[15]。生长激素(growth hormone, GH)是一种由垂体前叶分泌的类似催乳素结构的蛋白质,控制着β-casein与α-LA受体的激活,产生协同作用,具有促进乳腺生长发育及维持泌乳的功能[16-17],这预示着将转入动物体内可能会在一定程度上提高目的基因的表达水平。因此,在转基因动物遗传育种方面发挥着重要的作用。但是,将和双基因共整合入转基因兔体内以期提高rhPA表达量的相关研究较少见报道,是否能够协同促进目的基因在转基因兔乳腺中高效表达值得进一步研究。【拟解决的关键问题】本研究以单转基因兔[15](PCL25/rhPA乳腺特异性表达载体,以作为调控序列)为试验兔,其超排获得的受精卵通过显微注射的方法额外转入,旨在提高转基因兔乳腺表达rhPA的含量,为将来制备高表达转基因动物和遗传育种提供了新思路、新方法,也为其他重组医药蛋白的生产奠定了基础。
1 材料与方法
试验于2018—2019年在扬州大学江苏省转基因动物制药工程研究中心实验室和无锡太湖学院基础医学实验室完成。
1.1 材料
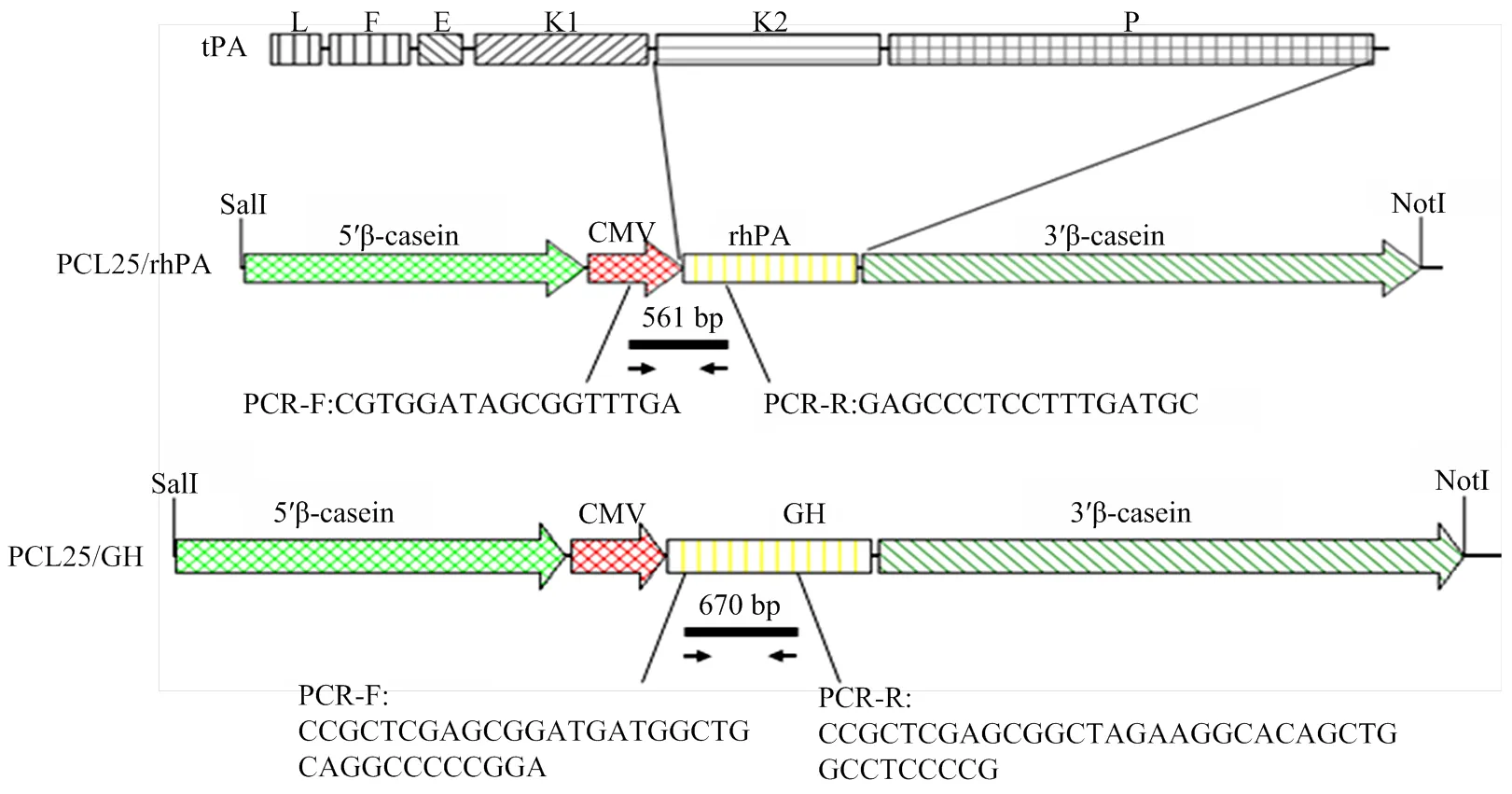
图1 乳腺特异性表达载体PCL25/rhPA与PCL25/GH构建图及PCR检测原理图
1.1.2 引物PCR 引物设计借助于Primer Premier 5.0 软件完成,引物由上海生工生物工程技术有限公司合成(表1)。
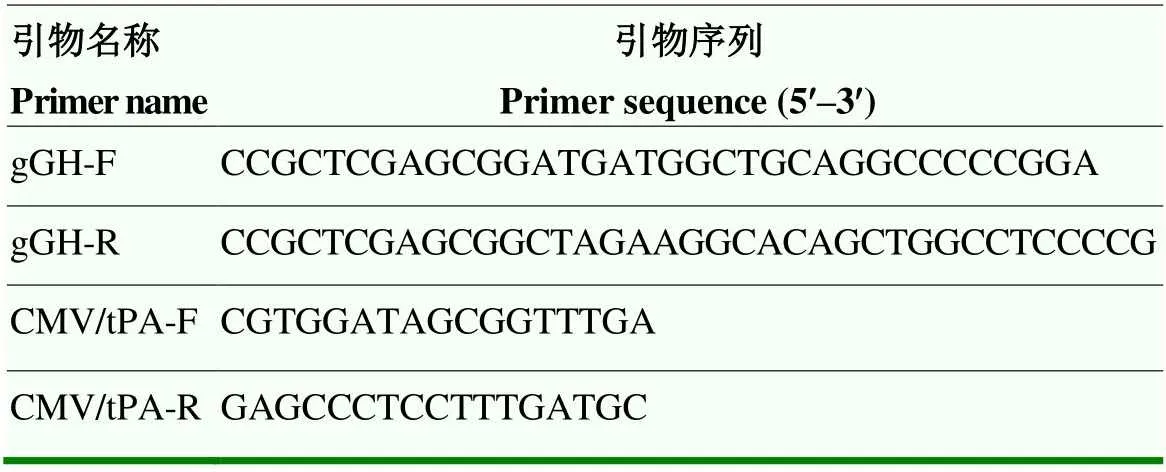
表1 PCR扩增引物序列
1.1.3 主要试剂 FSH(宁波三生药业),HCG(丽珠制药厂),速眠新II(军需大学兽医研究所),FBS(HyClone),透明质酸酶(Sigma),Zoletil50(Virbac),蛋白酶K(Sigma),M2(Sigma),M16(Sigma),鼠抗tPA单克隆抗体(Santa Cruz),羊抗鼠单克隆抗体IgG-HRP(Santa Cruz);DNA 胶纯化回收试剂盒购自QIAGEN 公司;各种限制性内切酶和DNA聚合酶购自宝生物工程(大连)有限公司;其他未说明试剂均为国产分析纯,分别购自上海药剂,上海生工生物工程有限公司,南京生兴生物有限公司。
1.1.4 实验动物单转基因兔(品种为新西兰兔,标号K06、K10、K17,以山羊为调控元件,且已验证表达)和正常非转基因新西兰兔,均单笼饲养于江苏省转基因动物制药工程研究中心清洁级兔房,温度20℃,光照12 h(7:00—19:00),颗粒饲料,自由饮水,环境良好。
1.2 方法
1.2.1 显微注射用基因片段的准备 PCL25/GH质粒通过Ⅰ/Ⅰ双酶切而线性化,1%琼脂糖凝胶电泳分离不同大小分子量的基因片段,去除原核基因片段,使用QIAGEN DNA胶纯化回收试剂盒回收真核基因片段供显微注射用。使用TE缓冲液(5 mmol·L-1Tris,pH 7.4 0.1 mmol·L-1EDTA)溶解稀释至 5 ng·μL-1,-20℃保存。
1.2.2 兔超数排卵与同期发情 挑取未发情的单转基因兔(K06、K10、K17)作为供体,后肢肌肉注射FSH,每次10 IU/只,早晚各一次(间隔12 h),连续3 d。第4天上午7:00肌肉注射FSH 5 IU/只,晚上19:00耳缘静脉注射hCG 100 IU/只,人工辅助与正常新西兰公兔配种后再合笼。第5天中午12:00无菌手术取卵[18]。在供体兔配种的同时,挑取8—10月龄自然发情的成年健康新西兰母兔作为受体,耳缘静脉注射hCG 100 IU/只,以备次日手术移植。母兔发情的主要标志为阴道黏膜呈潮红色、分泌粘液较多。
1.2.3 双转基因兔的制备 供体兔注射hCG后17 h,麻醉(皮下注射阿托品1 mg·kg-1,15 min后耳缘静脉注射zoletil-50 7.5 mg·kg-1),仰卧保定,无菌手术输卵管冲卵,回收受精卵,在体视显微镜下观察、计数。在荧光倒置显微镜(IX70,Olympus)下,将显微注射基因片段导入受精卵的原核内,置于38 ℃、5% CO2、饱和湿度的培养箱中培养 30 min后,手术移植到同步发情的受体母兔输卵管内,待孕。
1.2.4 转基因兔的整合筛选 无菌剪取新生仔兔的耳尖组织约2 mm3,添加含200 μg蛋白酶K的组织裂解液,55℃消化过夜,苯酚/氯仿抽提法提取基因组,-20℃预冷的无水乙醇沉淀DNA,进行PCR检测。针对和两种基因,分别设计了两对引物(表1),检测位点示意图如图1所示,其中CMV/tPA引物用于转基因检测,PCR 参数为:95℃预变性 5 min ;94℃变性 45 s,55℃退火 45 s,72℃延伸 1 min,共30个循环;72℃延伸10 min。gGH引物用于转基因检测,PCR 参数为:95℃预变性 5 min ;94℃变性 45 s,58℃退火30 s,72℃延伸 45 s,共30个循环;72℃延伸10 min。PCR反应产物进行1%琼脂糖凝胶电泳,确定条带大小是否正确。
1.2.5 ELISA 表达检测 转基因母兔配种怀孕,分娩后挤奶,收集乳汁。乳汁离心,10 000×g,30 min,去除上层脂肪及下层浑浊,吸取乳清,PBS稀释100倍用于检测。96-孔酶标板中每孔添加100 μL乳清和100 μL包被液(1.696 g·L-1Na2CO3, 2.856 g·L-1NaHCO3, pH 9.6),4℃过夜。弃去包被液,使用含0.05% Tween-20的PBS洗涤3次,拍干。每孔加入200 μL封闭液(含10%胎牛血清的PBS),37℃水浴2 h。使用鼠抗tPA单克隆抗体作为一抗(sc-59721, Santa Cruz)、羊抗鼠单克隆抗体IgG-HRP作为二抗(sc-2005, Santa Cruz),分别37℃水浴2 h。洗涤后,每孔加入50 μL的显色液(5 mg OPD, 15 μL30% H2O2, 28.4 g·L-1Na2HPO4, 19.2 g·L-1柠檬酸),37℃避光孵育20 min,显色后酶标仪测定OD450值,并以阿替普酶(alteplase)作为标准品,绘制标准曲线,计算rhPA表达量,比较双转基因兔和单转基因兔的表达水平。
以百香果、胡萝卜、白砂糖和鲜乳为主要原料研制复合型酸奶,风味独特、营养价值高,是一种良好的保健酸奶。通过试验得到的最佳配方为百香果汁添加量4.5%,胡萝卜汁添加量23%,白砂糖添加量9%,黄原胶与CMC(1∶1)的复合稳定剂添加量0.1%,菌种接种量0.5%,于43℃条件下发酵6 h。产品呈浅橘黄色,凝固性良好,质地均匀、细腻,酸甜适中,并具兼有百香果和胡萝卜的香味。
1.2.6 Western blotting检测 按照常规方法对PBS稀释100倍的转基因兔乳清进行12% SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)[18]。使用转移缓冲液(1.93 g·L-1tris, 9 g·L-1glycine)将丙烯酰胺凝胶转移至PVDF膜,250 mA,转印3.5 h。超纯水冲洗后,37℃封闭(20 mmol·L-1Tris, 137 mmol·L-1NaCl, 0.1 % Tween-20, 10% fetal bovine serum,pH 7.6),2 h。加入一抗稀释液(1﹕2 000稀释,鼠抗tPA单克隆抗体,sc-59721,Santa Cruz),37℃孵育2 h。TTBS(20 mmol·L-1Tris, 137 mmol·L-1NaCl,1 % Tween-20, pH 7.6)洗涤3次后,加入二抗-HRP稀释液(1﹕2 000稀释,羊抗鼠单克隆抗体IgG-HRP,sc-2005,Santa Cruz)中,37℃孵育2 h。取出PVDF膜,PBS洗净后,添加显色液(DAB 50 mg, 0.05 mol·L-1TB100mL, 30 μL 30% H2O2, pH7.6),室温15 min,晾干后拍照、记录并保存。
1.2.7 双转基因兔的生长发育监测 在相同的断奶时间和饲养条件下,分别对不同生长发育阶段的双转基因兔和正常非转基因兔的体重进行测量,从出生开始连续测量至6个月龄,以时间(月)为横坐标、体重(g)为纵坐标,绘制生长曲线,比较双转基因兔与正常非转基因兔的生长发育情况。
2 结果
2.1 显微注射用基因片段的纯化回收
经Ⅰ/Ⅰ双酶切质粒 PCL25/GH,使用胶纯化回收试剂盒回收后的基因片段电泳图谱见图2所示,从图中可见一约16 700 bp 大小的明亮条带,与目标显微注射基因片段的大小相同。电泳结果表明,成功地酶切和回收了大小约16 700 bp显微注射用的基因片段。
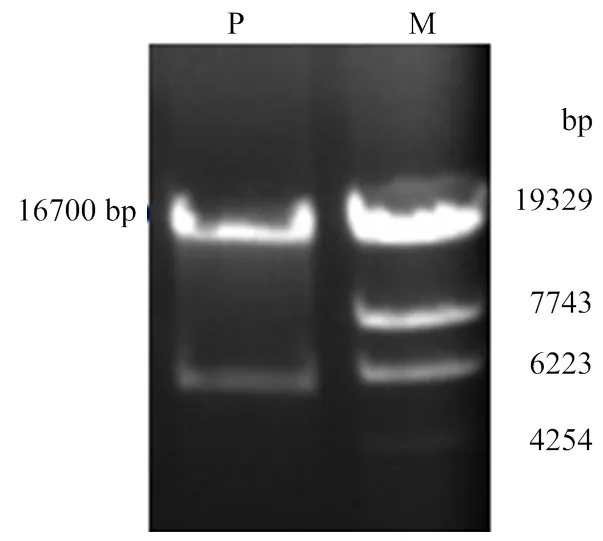
P:PCL25/GH质粒双酶切;M:λ-EcoT14 DNA Marker.
2.2 受精卵的显微注射
正常兔受精卵为卵圆形,透明带较厚且外围一厚层粘蛋白,判断受精的标志是能够看见两个相互靠近的原核(胞质凹陷部分),雌原核一般小于雄原核,如图3-A所示,在卵的中间部位可见两个相邻的明显凹圆,即雌雄原核。将显微注射用基因片段导入原核的操作如图3-B所示,可见注射的原核瞬间膨胀变大。

图3 兔受精卵原核显微注射
2.3 PCR整合检测
通过对3只单转基因供体兔(标号K06、K10、K17)的超数排卵获得122枚卵,其中有103枚受精卵,受精率为84.4%(103/122)。挑选较好的94枚受精卵进行显微注射,经培养30 min后再挑选其中形态较好的81枚卵移植到6只同步发情的母兔输卵管中,有5只怀孕并顺利分娩,妊娠率为83.3%(5/6),妊娠到期共出生32只仔兔。经PCR检测,共获得19只携带的转基因兔,其中11只兔(7♂,4)整合双基因,通过PCR检测分别扩增出561 bp()和670 bp()大小条带(图4、图5),双基因整合率为34.4%(11/32)。其中,4只双转基因母兔来源亲代分别为K06供体兔2只(标号K06-1、K06-2)、K10供体兔1只(标号K10-1)、K17供体兔1只(标号K17-1),详见表2。
2.4 ELISA检测
转基因兔乳清经ELISA检测表达水平的结果如图6和表2所示,其中K06兔乳清中rhPA表达量为42.2 μg·mL-1,K06-1和K06-2兔乳清中rhPA表达量分别为432、444 μg·mL-1,表达水平分别提高了约10.2倍(432/42.2)和10.5倍(444/42.2);K10兔乳清中rhPA表达量为42.8 μg·mL-1,K10-1兔乳清中rhPA表达量为636 μg·mL-1,表达水平提高了约14.9倍(636/ 42.8);K17兔乳清中rhPA表达量为15.2 μg·mL-1,K17-1兔乳清中rhPA表达量为248 μg·mL-1,表达水平提高了约16.3倍(248/15.2)。3只单转基因兔表达rhPA水平为15.2—42.8 μg·mL-1,而双转基因兔表达rhPA水平为248—636 μg·mL-1,表达水平提高了10.2—16.3倍左右。ELISA检测结果表明,双转基因兔乳腺表达rhPA水平明显高于单转基因兔,可协同促进在转基因兔乳腺中的高效表达。

1,4:正常非转基因兔(阴性对照);2:K06-1转基因兔;3:K06-2转基因兔;5:K10-1转基因兔;6:K17-1转基因兔;M:DL2000 Marker;7:PCL25/rhPA质粒(阳性对照)
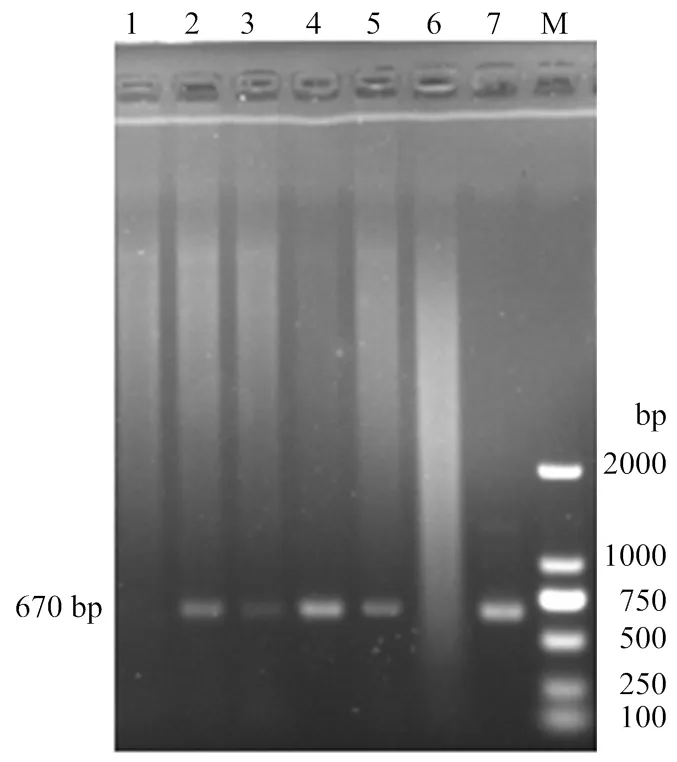
1:正常非转基因兔(阴性对照);2:K06-1转基因兔;3:K06-2转基因兔;4:K10-1转基因兔;5:K17-1转基因兔;6:rhPA单基因整合兔(K06);7:PCL25/GH质粒(阳性对照);M:DL2000 Marker

表2 单、双转基因兔乳腺表达rhPA含量情况统计表
2.5 Western blotting检测
单、双转基因兔乳清的Western blotting检测结果如图7所示,可见一大小约39.0 kD的条带,与阳性对照的条带大小相同。结果表明,该转基因兔乳清中成功表达的蛋白为目标产物rhPA,且其蛋白分子量大小正确,与目标蛋白一致。
2.6 rhPA/GH双转基因兔的生长发育情况
对整合双基因的转基因兔连续测量体重6个月(表3),并与正常非转基因兔的体重进行比较,未见明显的差异存在。其中,K10-1转基因兔前3个月体重偏轻(明显低于正常兔体重),是由于该兔在出生的第20天生病所致,恢复健康之后,后期体重增长也恢复至正常。从兔的生长曲线(图8)上可以看出,4只整合GH的转基因兔(K06-1、K06-2、K10-1、K17-1)与2只未整合GH的正常非转基因兔(N1、N2)相比,在生长发育的不同阶段未见明显的体重差异,成长至6个月的体重均在4.0—5.0 kg之间。结果表明,的转入未影响兔的正常生长发育,双转基因兔能够存活、正常生长发育至成年。
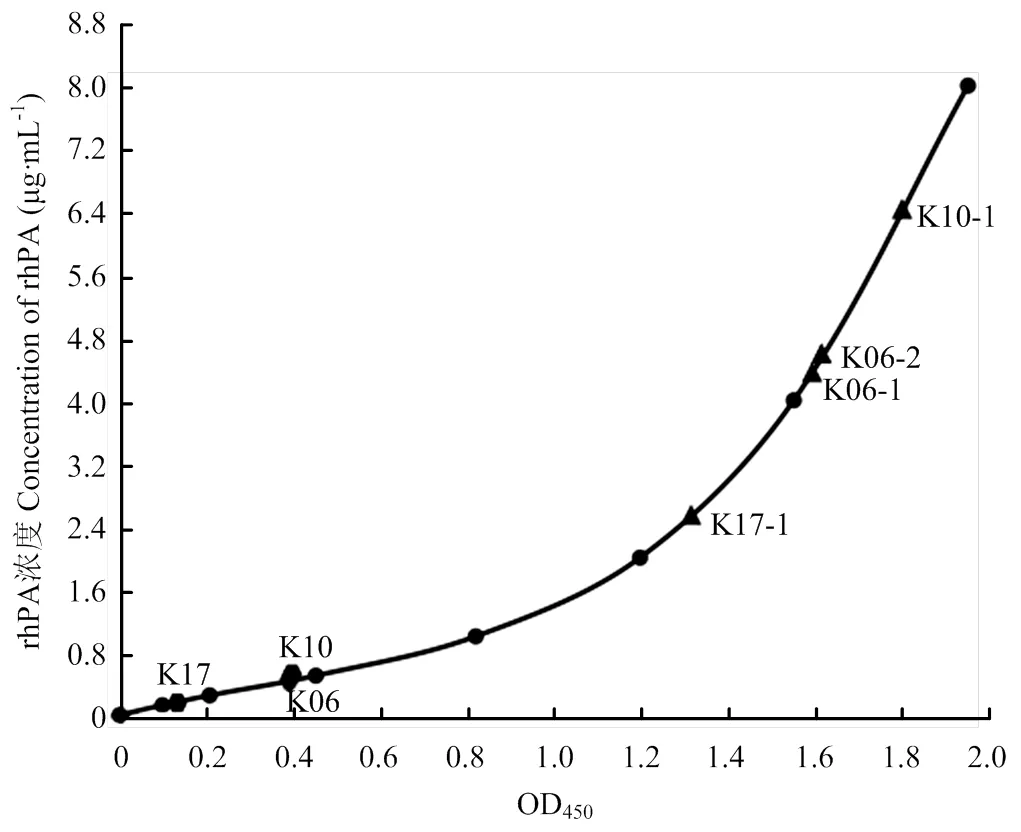
阿替普酶浓度分别是0、0.125、0.25、0.5、1.0、2.0、4.0、8.0 μg·mL-1。所有兔乳清均使用PBS稀释100倍
3 讨论
据世界卫生组织(WHO)统计分析,全球每年由于心血管病死亡的人数约为1 300 万,其中血栓类疾病占半数以上,且呈现明显的上升趋势[5,19]。目前,临床上主要采用阿替普酶(tPA)、瑞替普酶、孟替普酶、兰替普酶、替尼普酶等溶栓药物治疗血栓病。本研究的重组人纤溶酶原激活剂(rhPA)是一种新开发的第三代重组溶栓药物,具有高效、安全、特异、副作用小等优点,临床使用的溶栓药物大多是通过原核生物或哺乳动物细胞表达来生产,存在产量低、价格高等局限性,大众使用推广一直受到限制[18-20]。因此,如何高效、便捷地低成本生产rhPA一直是科学研究的热点。自20世纪90年代,WRIGHT等[21]在羊乳腺中成功地表达了人α-抗胰蛋白酶以来,乳腺生物反应器显示出诱人的前景,为生产重组溶栓药物提供了较大的可能性。但是rhPA或tPA在动物乳腺中的表达水平一直偏低[22]。因此,积极探索提高非乳蛋白rhPA在动物乳腺中的表达水平尤为重要。
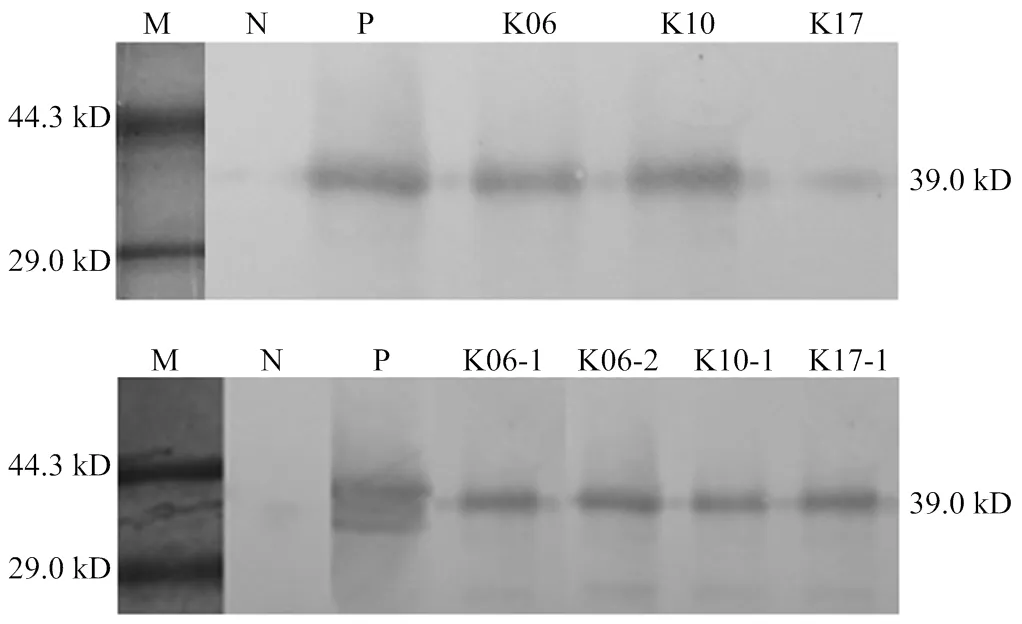
所有兔乳清均使用PBS稀释100倍
目前,提高动物转基因表达效率的方法较多[6],双转基因生物体内的两个基因能够产生协同促进作用,调控生物体基因网络系统,使外源目的基因表达水平提高[23],这是一种良好的提高目的基因表达的策略,为提高转基因兔乳腺中rhPA的表达量提供了新思路。自1920年,EVANS首次证实垂体中具有促生长的物质为生长激素以来,学者们对进行了广泛而深入的研究,并取得了重要成果[24]。有报道证明生长激素()能够与的序列结合,促进受体激活,协同提高乳蛋白的特异性表达[17,25]。虽然近年来,已有关于双基因提高外源目的基因表达水平的研究报道,例如韩操等[26]对和双基因、王林楠等[10]对和双基因、陈宁等[11]对与双基因的研究结果显示,双基因导入生物体内能够明显地提高目的基因的表达水平。但是,关于和双基因整合兔的相关研究报道较少见。
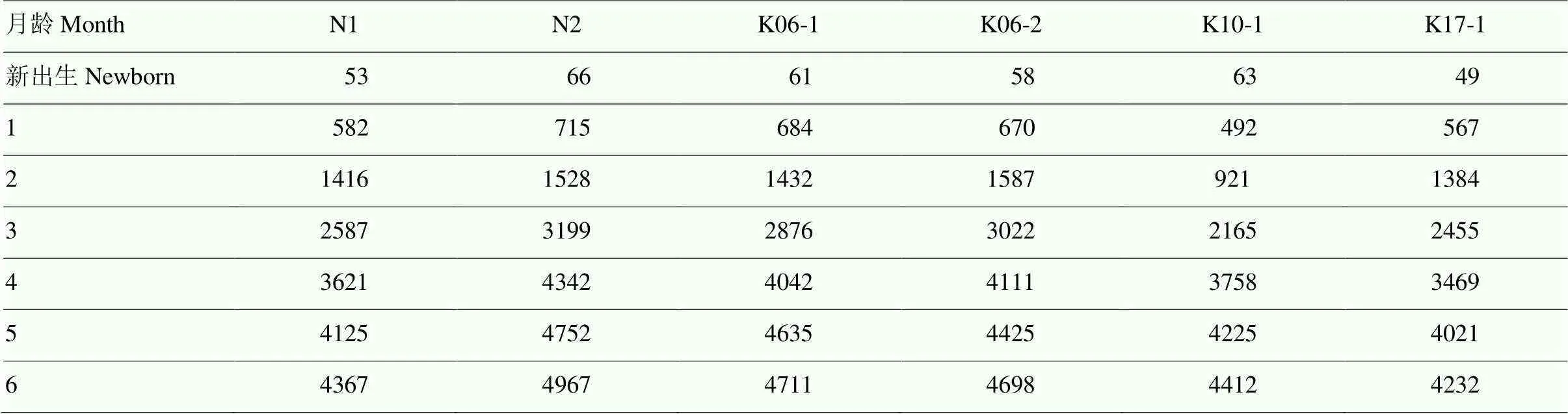
表3 正常兔和rhPA/GH双转基因兔不同生长阶段的体重测量
N1和N2是正常非转基因兔,K06-1、K06-2、K10-1、K17-1是双转基因兔
N1 and N2 were normal non-transgenic rabbits, K06-1, K06-2, K10-1 and K17-1 weredouble-transgenic rabbits
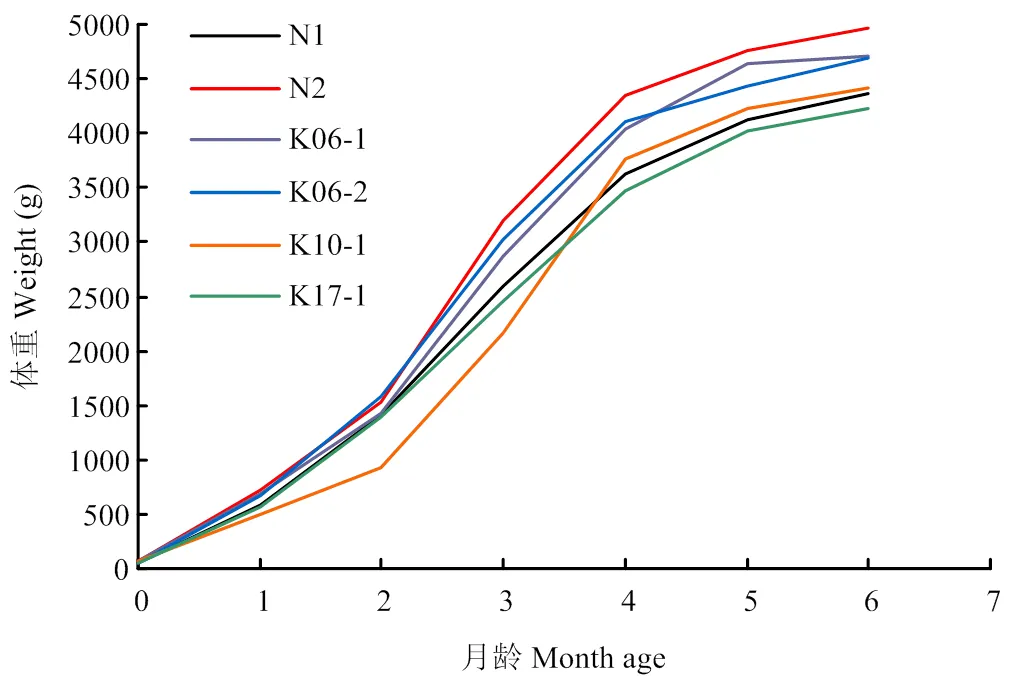
N1和N2是正常非转基因兔,K06-1、K06-2、K10-1、K17-1是rhPA/GH双转基因兔
家兔是转基因试验中常用的模式生物,也是胚胎工程和乳腺生物反应器研究中应用最广泛的实验动物之一。本研究尝试利用转基因动物进行二次转基因,选择以单转基因兔(以山羊作为调控序列,且已验证表达)作为供体兔[15],通过FSH/hCG进行超数排卵获取103枚受精卵,通过原核显微注射,分别移植到同步发情的新西兰受体母兔体内,顺利分娩获得32只仔兔。经PCR整合检测获得11只双转基因兔(7♂,4),双基因整合率达到34.4%,这与目前国内外报道的转基因兔整合效率相一致[15,27-29]。对其中4只双转基因母兔(K06-1、K06-2、K10-1、K17-1)的乳腺表达水平检测结果显示,双转基因兔表达目的蛋白rhPA的含量为248—636 μg·mL-1,远远高于单转基因兔(K06、K10、K17)的表达水平(15.2—42.8 μg·mL-1)。这一结果证明了的导入,能够大大地促进转基因兔乳腺中rhPA基因表达水平的提高。
此外,很多转基因动物的研究报道集中于生长激素能够调节机体生长,从而获得个体大小超越一般野生型的“超级”物种[30]。但是,本研究中获得的双转基因兔通过与正常非转基因兔的生长发育情况比较,发现并没有对转基因兔的生长发育产生影响,整合的转基因兔能够正常地生长发育至成年。一般情况下,新西兰成年兔的体重为4.0—5.0 kg[31],本试验的4只双转基因兔成长至6个月的体重均在4.0—5.0 kg之间,与正常非转基因兔的体重增长没有明显的差异。分析原因可能是试验选择的来源于山羊,不能够产生与在山羊体内类似的生理学作用,也不会对兔的生长发育造成影响。而且,基因表达是涉及到整合位点、表观遗传、外源基因拷贝数、相关激素水平及基因网络等多方面的影响[32],因此,相关研究仍需继续进行。
4 结论
通过二次转基因成功制备的双转基因兔,不仅使双基因整合率得到了保证,也使rhPA表达水平更具有比较性。通过对兔乳清中表达rhPA含量和不同生长发育阶段的体重监测,证明了双转基因兔能够明显地提高目的基因的表达量,同时GH对兔的生长发育没有造成明显的影响,这为将来制备高表达转基因兔及其它动物奠定了基础,也为转基因动物乳腺生物反应器和转基因育种建立提供了新技术、新方法。
[1] THIEBAUT A M, GAUBERTI M, ALI C, MARTINEZ DE LIZARRONDO S, VIVIEN D, YEPES M, ROUSSEL B D. The role of plasminogen activators in stroke treatment: fibrinolysis and beyond. Lancet Neurology, 2018, 17(12):1121-1132.
[2] OHTA T, OKADA K, FUKUDA M, MASAHIRA N, MATSUOKA T, TSUNO T, TAKEMURA M. Safety and efficacy of intravenous low-dose alteplase in relative contraindication patients with acute ischemic stroke.Journal of Stroke & Cerebrovascular Diseases, 2018, 27(7):1844-1851.
[3] GRUMMISCH J A,GRUMMISCH J A, JADAVJI N M,JADAVJI N M, SMITH P D,SMITH P D. The pleiotropic effects of tissue plasminogen activator in the brain: implications for stroke recovery. Neural Regeneration Research, 2016, 11(9):1401-1402.
[4] WYSOCKI N A, BAMBHROLIYA A, ANKROM C, VAHIDY F, ASTUDILLO C, TREVINO A, MALAZARTE R, COSSEY T C, JAGOLINO-COLE A, SAVITZ S, WU T C, SHARRIEF A.Outcomes among patients with ischemic stroke treated with intravenous tPA (Tissue-Type Plasminogen Activator) via telemedicine. Stroke, 2019, 50(4):895-900.
[5] VANDELLI L, MARIETTA M, TRENTI T, VARANI M, BIGLIARDI G, ROSAFIO F, DELL'ACQUA M L, PICCHETTO L, NICHELLI P, ZINI A. Fibrinogen concentrate replacement in ischemic stroke patients after recombinant tissue plasminogen activator treatment. Advances in Clinical and Experimental Medicine, 2019, 28(2):219- 222.
[6] 赵旭东, 黄永志, 毕延震, 董发明.动物转基因高效表达策略研究进展.生物技术通报, 2020, 36(03):45-53.
ZHAO X D, HUANG Y Z, BI Y Z, DONG F M. Strategies for efficient exogenous gene expression in transgenic animals.Biotechnology Bulletin, 2020, 36(03):45-53. (in Chinese)
[7] LI C, MISHRA A S, GIL S, WANG M, GEORGAKOPOULOU A, PAPAYANNOPOULOU T, HAWKINS R D, LIEBER A. Targeted integration and high-level transgene expression in AAVS1 transgenic mice afternivo HSC transduction with HDAd5/35++ vectors. Molecular Therapy, 2019,27(12):2195-2212.
[8] BAO Z, LIN J, YE L, ZHANG Q, CHEN J, YANG Q, YU Q. Modulation of mammary gland development and milk production by growth hormone expression in GH transgenic goats. Frontiers in Physiology, 2016, 7:278.
[9] 李志然, 马强, 马利民. VEGF和Smad7双基因过表达慢病毒载体的构建. 交通医学, 2019, 33(02):107-110.
LI Z R, MA Q, MA L M. The construction of lentiviral vector with over-express of VEGF gene and Smad7 gene. Medical Journal of Communications, 2019, 33(02):107-110. (in Chinese)
[10] 王林楠, 汪雷, 宋跃明, 刘立岷, 杨曦, 丰干均, 周春光. 慢病毒介导NEP1-40及NT-3双基因转染神经干细胞的实验研究. 中国修复重建外科杂志, 2018, 32(04):420-427.
WANG L N, WANG L, SONG Y M, LIU L M, YANG X, FENG G J, ZHOU C G. Experimental study of lentivirus-mediated Nogo extracellular peptide residues 1-40 gene and neurotrophin 3 gene co-transduction in neural stem cells. Chinese Journal of Reparative and Reconstructive Surgery, 2018, 32(04):420-427. (in Chinese)
[11] 陈宁, 蒋林彬, 粟谋, 徐威, 李朝旭, 王锐英, 唐际存, 贝朝涌. 双基因pCDNA 3.1-NGF-IRES-BMP2真核质粒转染 大鼠BMSCs诱导成骨的研究. 中国矫形外科杂志, 2016, 24 (04):345-351.
CHEN N, JIANG L B, SU M, XU W, LI C X, WANG R Y, TANG J C, BEI C Y. Transfected double gene pCDNA3.1-NGF-IRES-BMP2 eukaryotic plasmid and its inductive effects for osteo-genesis in rat BMSCs. Orthopedic Journal of China, 2016, 24(04):345-351. (in Chinese)
[12] 徐莉, 赵舟宙, 刘辉, 蒋达和, 李文鑫. 人补体调节蛋白DAF、MCP在哺乳动物细胞中的共表达及协同作用研究.生物工程学报, 2008(2):220-225.
XU L, ZHAO Z Z, LIU H, JIANG D H, LI W X. Co-expression and synergic effect of human complement regulatory proteins DAF and MCP. Chinese Journal of Biotechnology, 2008(2):220-225. (in Chinese)
[13] 周慧, 孙利波, 尹若峰, 张明磊. 骨形态发生蛋白-2与血管内皮生长因子双基因质粒转染鼠骨髓间充质干细胞的研究. 中华实验外科杂志, 2015, 32(7): 1531-1533.
ZHOU H, SUN L B, YIN R F, ZHANG M L. Bone marrow mesenchymal stem cells transfected by a dual-gene coexpression plasmid of bone morphogenetic protein-2 and vascular endothelial growth factor. Chinese Journal of Experimental Surgery, 2015, 32(7): 1531-1533. (in Chinese)
[14] 吕本浩, 李劲峰, 马源, 李成, 尚国伟, 李月白, 王义生. 双基因重组载体转染乙醇诱导的兔干细胞对其成脂与成骨基因表达的影响. 中华实验外科杂志, 2017, 34(12): 2187-2190.
Lü B H, LI J F, MA Y, LI C, SHANG G W, LI Y B, WANG Y S. Influence of double gene recombinant vector transfected alcohol- induced rabbit stem cells on expressions of adipogenic and osteogenic genes. Chinese Journal of Experimental Surgery, 2017, 34(12): 2187-2190. (in Chinese)
[15] SONG S Z, GE X, CHENG Y B, LU R, ZHANG T, YU B L, JI X Q, QI Z Q, RONG Y, YUAN Y G, CHENG Y. High-level expression of a novel recombinant human plasminogen activator (rhPA) in the milk of transgenic rabbits and its thrombolytic bioactivity. Molecular Biology Reports, 2016, 43(8):775-783.
[16] NISHIHARA K, KOBAYASHI R, SUZUKI Y, SATO K, KATOH K, ROH S. Post-prandial decrease in plasma growth hormone levels is not related to the increase in plasma insulin levels in goats.Asian-Australasian Journal of Animal Sciences, 2017, 30(12): 1696-1701.
[17] LI L, HE M L, LIU Y, ZHANG Y S. Buffering agent-induced lactose content increases via growth hormone-mediated activation of gluconeogenesis in lactating goats. Physiological Research, 2018, 67(2): 317-329.
[18] 宋绍征. 转基因兔乳腺特异性表达重组人纤溶酶原激活剂(rhPA)及其药效学研究[D]. 扬州: 扬州大学, 2015.
SONG S Z. The studies on transgenic rabbits mammary gland-specific expression of recombinant human plasminogen activator (rhPA) and pharmacodynamics[D]. Yangzhou: Yangzhou University, 2015. (in Chinese)
[19] FISCHER U, KAESMACHER J, MOLINA C A, SELIM M H, ALEXANDROV A V, TSIVGOULIS G. Primary thrombectomy in tPA (Tissue-Type Plasminogen Activator) eligible stroke patients with proximal intracranial occlusions. Stroke, 2018, 49(1):265-269.
[20] JAVARAN V J, SHAFEINIA A, JAVARAN M J, GOJANI E G, MIRZAEE M. Transient expression of recombinant tissue plasminogen activator (rt-PA) gene in cucurbit plants using viral vector. Biotechnology Letters, 2017, 39(4):607-612.
[21] WRIGHT G, CARVER A, COTTOM D, REEVES D, SCOTT A, SIMONS P, WILMUT I, GARNER, COLMAN A. High level expression of active human alpha-1-antitrypsin in the milk of transgenic sheep. Biotechnology (N Y), 1991, 9(9):830- 834.
[22] HE Z, LU R, ZHANG T, JIANG L, ZHOU M, WU D, CHENG Y. A novel recombinant human plasminogen activator: Efficient expression and hereditary stability in transgenic goats and in vitro thrombolytic bioactivity in the milk of transgenic goats. PLoS One, 2018, 13(8): e0201788.
[23] TORRES V, BARRA L, GARCES F, ORDENES K, LEAL-ORTIZ S, GARNER C C, FERNANDEZ F, ZAMORANO P. A bicistronic lentiviral vector based on the 1D/2A sequence of foot-and-mouth disease virus expresses proteins stoichiometrically. Journal Biotechnology, 2010, 146(3): 138-142.
[24] DUCHEN K, LINDBERG A, KIPLOK K, KRISTROM B. Using a spontaneous profile rather than stimulation test makes the KIGS idiopathic growth hormone deficiency model more accessible for clinicians. Acta Paediatrica, 2017, 106(9):1481-1486.
[25] ZHOU Y, AKERS R M, JIANG H. Growth hormone can induce expression of four major milk protein genes in transfected MAC-T cells. Journal of Dairy Science, 2008, 91(1): 100-108.
[26] 韩操, 王正东, 颜南. 慢病毒介导bFGF和BMP-2双基因转染对兔骨髓间充质干细胞增殖的影响. 解剖科学进展, 2019, 25(01):25-31.
HAO C, WANG Z D, YAN N. Effect of transfected BMP-2 and b FGF double gene lentivirus vectors on the proliferation of bone marrow mesenchymal stem cells in rabbit. Progress of Anatomical Sciences, 2019, 25(01):25-31. (in Chinese)
[27] HAMMER R E, PURSEL V G, REXROAD C E, WALL R J, BOLT D J, EBERT K M, PALMITER R D, BRINSTER R L. Production of transgenic rabbits, sheep and pigs by microinjection., 1985, 315(6021):680-683.
[28] 陆睿, 宋绍征, 祁正强, 葛欣, 邵宾, 成勇. 重组人纤溶酶原激活剂转基因兔的制备及其表达产物的检测. 生物技术通报, 2015, 31(10):216-221.
LU R, SONG S Z, QI Z Q, GE X, SHAO B, CHENG Y. Preparation of recombinant human plasminogen activator in rabbit mammary gland and detection of expressed products. Biotechnology Bulletin, 2015, 31(10):216-221. (in Chinese)
[29] 马延, 郭金耀. 显微注射人基质金属蛋白酶-9转基因家兔制备及在动脉粥样硬化中的作用. 临床和实验医学杂志, 2019, 18(1):24-28.
MA Y, GUO J Y. Modeling of matrix metalloproteinases-9 rabbits by DNA microinjection and its effect against atherosclerosis. Journal of Clinical and Experimental Medicine, 2019, 18(1):24-28. (in Chinese)
[30] PALMITER R D, NORSTEDT G, GELINAS R E, HAMMER R E, BRINSTER R L. Metallothionein-human GH fusion genes stimulate growth of mice. Science, 1983, 222(4625):809-814.
[31] RODRIGUEZ-DE LARA R, FALLAS-LOPEZ M, GARCIA-MUNIZ J G, MARTINEZ-HERNANDEZ P A, RANGEL-SANTOS R, MALDONADO-SIMAN E, CADENA-MENESES J A. Sexual behavior and seminal characteristics of fertile mature New Zealand White male rabbits of different body weights. Animal Reproduction Science, 2015, 152:90-98.
[32] ROCHA-MARTINS M, CAVALHEIRO G R, MATOS-RODRIGUES G E, MARTINS R A. From Gene Targeting to Genome Editing: Transgenic animals applications and beyond. Anais Da Academia Brasileira De Ciencias, 2015, 87(2):1323-1348.
Preparation and Expression ofDouble Transgenic Rabbits
SONG ShaoZheng1, YU KangYing1, ZHANG Ting2, LU Rui2, PAN ShengQiang1, CHENG Yong2, ZHOU MingMing
1School of Nursing, Wuxi Taihu University, Wuxi 214000, Jiangsu;2Jiangsu Provincial Research Center for Animal Transgenesis and Biopharming/College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, Jiangsu
【】The integration of the double genes is able to promote the expression level of the target genes in the transgenic organisms. The aim of this study was to obtain thedouble transgenic rabbits, and then the expression level of the target geneand the individual growth and development of these rabbits were compared and analyzed, so as to provide a new new approach for preparation of high expressiontransgenic animals and genetic breeding. 【】double enzyme digestion PCL25/GH plasmid and QIAGEN DNA gel purification kit were used to recover gene fragments for microinjection. The threesingle-transgenic rabbits (K06, K10 and K17) were used as donors. Thedouble-transgenic rabbits were obtained by FSH/hCG superovulation, pronuclear microinjection of fertilized eggs, embryo transfer, phenol / chloroform extraction of newborn rabbit’ ear tip tissue genome and PCR integrated detection. In addition, the expression levels of rhPA in single-transgenic rabbit and double-transgenic rabbit whey were compared by ELISA and Western blotting. The body weight of transgenic rabbits at different months was measured, and the effects ofon growth and development of rabbits were analyzed by body weight at growth stage. 【】The about 16 700 bp of microinjection gene fragments were successfully obtained. A total of 122 eggs were obtained from 3 donor rabbits, 103 of which were fertilized, and the fertilization rate was 84.4% (103/122). After microinjection, 81 fertilized eggs with good morphology were selected and transplanted into 6 recipient rabbits by synchronous estrus. Five rabbits were pregnant and the pregnancy rate was 83.3% (5/6). A total of 32 offspring were born at the end of pregnancy. There were 19transgenic rabbits identified by PCR, and 11 of them were thedouble transgenic rabbits (7, 4), so the double-gene integration rate was 34.4% (11/32). The fourdouble-transgenic female rabbits were derived from K06 donor rabbits (labelled K06-1 and K06-2), K10 donor rabbit (labeled K10-1) and K17 donor rabbit (labeled K17-1), respectively. The rhPA expression in single transgenic rabbit whey of No. K06 was 42.2 μg·mL-1, and the rhPA expression in the double transgenic rabbit whey of No. K06-1 and K06-2 was 432 and 444 μg·mL-1, respectively. The rhPA expression in the single transgenic rabbit whey of No. K10 was 42.8μg·mL-1, and the rhPA expression in the double transgenic rabbit whey of No. K10-1 was 636 μg·mL-1. The rhPA expression in single transgenic rabbit whey of No. K17 was 15.2μg·mL-1, and which in double transgenic rabbit whey of No. K17-1 was 248 μg·mL-1. The expression of rhPA in mammary glands of four femaledouble-transgenic rabbits (K06-1, K06-2, K10-1, and K17-1) were 248-636 μg·mL-1, which was much higher than that ofsingle-transgenic rabbits (K06, K10, K17, expression levels: 15.2-42.8μg·mL-1). That is to say, the expression level significantly increased about 10.2 to 16.3 times, and it showed thatcould synergistically promote the expression level of target genein the mammary glands of transgenic rabbits. Besides, the western blotting results showed a band of about 39.0 kDa, which was the same size as the target protein rhPA, further proving that this protein expressed in the breast of transgenic rabbits was the target product rhPA. By measuring the weight ofdouble-transgenic rabbits from their birth to 6 months continuously, it was found that the weight was no significant difference between thetransgenic rabbits and the normal non-transgenic rabbits. The growth curve was drawn to further indicate that 4 transgenic rabbits with integratedand 2 normal rabbits without integratedhad no significant difference in body weight at different stages of growth and development. The body weight for 6 months was about 4.0-5.0 kg. This proved that the introduction ofdid not have harmful influence on their survival and normal growth and development to adulthood. 【】In this experiment,double-transgenic rabbits were successfully prepared, and it has been proved that the introduction ofcould significantly increase the expression level of. Moreover, it could not affect the growth and development of transgenic rabbits. This laid a foundation for the preparation of high expression transgenic rabbits and other animals in the future, and also provided a new idea and method for the establishment of transgenic animal mammary gland bioreactors and transgenic breeding..
double transgenic rabbits; expression; superovulation; microinjection; growth curve

10.3864/j.issn.0578-1752.2021.02.016
2019-07-14;
2020-11-25
江苏省高校自然科学基金面上项目(19KJB180030)、国家转基因生物新品种培育重大专项 (2014ZX08008-004)
宋绍征,E-mail:ssz0610@163.com。通信作者成勇,E-mail:chengyong12@yeah.net。通信作者周鸣鸣,E-mail:zmm19770@126.com
(责任编辑 林鉴非)

