基于高通量测序的土壤微生物群落结构对土地利用方式的响应
邓楚璇, 周英, 李上官, 刘星科, 王文娟, 李西, 孙凌霞, 罗春兰, 李向, 黄玉梅*
1. 四川农业大学风景园林学院,四川 成都 611130;
2. 彭州市规划和自然资源局,四川 彭州 611900
土壤是地球上大多数生物生存和发展的基础载体,是地球表层系统中生物多样性最丰富的生命层。土壤微生物作为土壤生态系统中最为活跃的一部分,是参与生物地球化学循环的重要动力,对维持土壤生态系统稳定性、生态修复等具有一定作用[1-3]。细菌是土壤中数量最多、分布最广泛的微生物类群,在土壤生态过程中发挥重要的作用;真菌不仅与植物共生,也是有机物的重要分解者之一[3-5]。二者均是表征环境变化的敏感指标,常用于预测土壤养分和环境质量的变化[6]。大量研究证明土地利用方式是影响土壤微生物生物量及群落结构的重要因子[7-8]。目前国内外学者在微生物物种及结构多样性[9-11]、功能多样性[12-13]、与环境因子关联性方面研究较多[14-15],多为同区域单一土地利用类型[11,13,15]或同区域少数土地利用类型的对比[9,16],但欠缺对宏观区域内多种土地利用方式的研究[17]。
本研究基于Illumina MiSeq高通量测序平台,对取自彭州市5种典型土地利用方式的土壤细菌和真菌多样性及群落结构进行了探究,试图探索土壤微生物在不同利用方式及土壤理化性质下的群落结构特征,提出土地利用结构优化措施,为探索可持续的土地利用方式提供理论依据。
1 材料和方法
1.1 研究区概况
彭州市(103°10′—104°40′E,30°54′—31°29′N)位于四川省成都市西北部,地处成都平原与龙门山过渡地带,属中亚热带季风性湿润气候,气候温和,四季分明。年平均气温15.6 ℃,全年无霜期276 d,年平均降水量932.5 mm。地貌以山地、平原为主,土壤为砂岩发育而成的山地黄壤。地带性森林植被类型为常绿阔叶林。
1.2 研究方法
1.2.1 样地设置与样品采集
2019年10月,分别在城市绿地(Urban Greenland,UL)、农业用地(Farmland,FL)、人工林地(Plantation Woodland,PL)、滩涂地(Tidal Wetland,TL)、撂荒地(Abandoned Farmland,AL)生境下设置3个重复样地,共15个固定样地。样地分布见图1,生境概况见表1。取土前除去土壤表面的覆盖物,用内径为5 cm的取样器以“五梅花”形采集0~10 cm土壤样品,去掉植物根系、石砾等杂物后充分混匀,用无菌袋盛装并置于便携式保鲜箱内保存。将采集的土样带回实验室,过2 mm筛后,一部分保存于−80 ℃的冰箱用于分子生物学研究,一部分于干燥常温环境保存用于土壤理化性质的测定。
1.2.2 土壤理化指标测定
按照常规土壤农化分析方法[18]测定土壤基本理化性质,见表2。土壤容重(Bulk density,Bd)采用环刀法测定,土壤pH值(1:2.5)采用酸度计电位法,土壤含水率(Water content,Wc)采用烘干法测定。土壤铵态氮(Ammonium nitrogen,NH4+-N)、速效磷(Available Phosphorus,AP)和速效钾(Available Potassium,AK)用BSL-2C2土壤养分速测仪测定。

图 1 样地分布图Fig. 1 Distribution map of sampling sites

表 1 土地利用方式基本概况Tab. 1 Basic characteristics of different land use types

表 2 不同土地利用方式下土壤理化特性Tab. 2 Physical and chemical characteristics of soil under different land use types
1.2.3 土壤微生物区系测定
采用 MP-bio 公司的 Fast DNA® SPIN Kit for Soil试剂盒提取土壤微生物基因组总DNA,用引物338F 和806R 扩增土壤细菌16S rRNA基因的V3-V4区,用引物ITS1F 和ITS2R 扩增土壤真菌18S rRNA基因的ITS1区,基于Illumina MiSeq 测序平台进行高通量测序。测序委托上海美吉生物医药科技有限公司进行。
1.3 数据分析
用Excel2013处理基础数据,SPSS24.0进行分析,GraphPad Prism5进行制图。利用Mothur软件计算土壤微生物的Shannon指数[19]、Simpson指数[20]、ACE指数[21]和Chao1指数[22]进行多样性分析。采用单因素方差分析(One-Way ANOVA)和Duncan新复极差法进行差异显著性检验(ɑ=0.05),分析得出不同生境土壤理化性质、微生物多样性及群落结构的差异。对土壤微生物多样性指数和土壤理化性质进行Pearson相关性分析,并采用冗余分析法(RDA)探明微生物群落对环境因子的响应机制。
2 结果与分析
2.1 不同土地利用方式细菌群落结构特征
如图2A,各生境土壤在门水平上的主要菌群如下:变形菌门(Proteobacteria,31.19%)、放线菌门(Actinobacteria,22.08%)、酸杆菌门(Acidobacteria,15.99%)、绿弯菌门(Chloroflexi,12.77%)、己科河菌门(Rokubacteria,3.6%)。其中,前4个菌门的相对丰度均大于10%,约占所有细菌的82%,是细菌中的优势菌门。由图2A可知,变形菌相对丰度在农业用地生境中最低(P<0.05);且在滩涂地和撂荒地间存在显著差异(P<0.05),但分别与城市绿地和人工林地无显著差异。放线菌在城市绿地最高(P<0.05),农业用地次之(P<0.05),人工林地最低(P<0.05),但滩涂地与撂荒地无显著差异。绿弯菌在农业用地生境中最高(P<0.05),滩涂地显著高于城市绿地和人工林地(P<0.05),其余无显著差异。酸杆菌在城市绿地和人工林地间差异显著(P<0.05),其余不存在显著差异。己科河菌在人工林地生境中最高(P<0.05),滩涂地与农业用地、撂荒地差异显著(P<0.05),但其他无显著差异。
如图2B,各生境土壤在目水平上的主要菌群如下:根瘤菌目(Rhizobiales,10.32%)、Subgroup_6菌目(8.15%)、β-变形菌目(Betaproteobacteriales,5.95%)、Gaiellales(4.74%)、Rokubacteriales菌目(3.56%)。由图2B可知,除Subgroup_6菌外,其他4种细菌目在各生境下均有显著差异。根瘤菌在农业用地中最低(P<0.05),但人工林地与滩涂地,城市绿地与撂荒地间无显著差异。β-变形菌在农业用地生境中最低(P<0.05),但与人工林地无显著差异;城市绿地与撂荒地存在显著差异(P<0.05),其余无显著差异。Gaiellales在农业用地中分布较多(P<0.05),但与城市绿地无显著差异;在滩涂地最低(P<0.05),其余差异不显著。Rokubacteriales在人工林地最高、滩涂地最低(P<0.05),而城市绿地、农业用地和撂荒地间无显著差异。
2.2 不同土地利用方式细菌群落多样性
对15个样地的土壤样品所得测序序列,以97%相似性阈值进行OTU聚类,共检测到细菌群落7 422个OTU,分属37门106纲278目491科959属2 137种,15个样地的细菌群落多样性见表3。由表3可知,人工林地土壤细菌群落的Shannon指数、Simpson指数、Ace指数、Chao1指数均与其他4种生境存在显著差异(P<0.05)。其中,Shannon指数为最低值,Simpson指数为最大值,表明人工林地土壤的细菌群落多样性最低。Ace指数和Chao1指数常用来估计物种总数,两者均与群落丰富度呈正比。人工林地土壤的Ace指数和Chao1指数均为最低值(见表3),表明人工林地土壤的细菌群落丰富度最低。滩涂地、撂荒地和城市绿地的多样性与丰富度均较高。综上,各生境下的土壤细菌群落多样性与丰富度排序基本一致,表现为人工林地<农业用地<撂荒地<滩涂地<城市绿地。

图 2 不同土地利用方式下的土壤细菌群落组成Fig. 2 Composition of soil bacterial community under different land use types
2.3 不同土地利用方式真菌群落结构特征
如图3A,各生境土壤在门水平上的主要菌群如下:子囊菌门(Ascomycota,59.45%)、担子菌门( Basidiomycota, 15.61%)、 被 孢 霉 门( Mortierellomycota, 15.24%)、 未 知 菌 门( unclassified_k_Fungi, 7.86%)、 隐 真 菌 门(Rozellomycota,1.44%)。其中,优势真菌门是子囊菌门、担子菌门和被孢霉门,约占所有真菌的90%。由图3A可知,子囊菌和担子菌的相对丰度在各生境分布无显著差异,而被孢霉菌在农业用地生境的相对丰度显著高于其他生境(P<0.05),同时,其相对丰度在城市绿地与撂荒地间有显著差异。未知菌门在人工林地与滩涂地生境中的相对丰度差异不显著,但均高于其他生境(P<0.05)。隐真菌在人工林地生境中分布较多,显著高于其他生境(P<0.05),而其他4种生境无显著差异。
如图3B,各生境土壤在目水平上的主要菌群如下:子囊菌门下目(unclassified_p_Ascomycota,16.00%)、被孢霉目(Mortierellales,15.21%)、肉座菌目(Hypocreales,14.97%)、未知菌目(unclassified_k_Fungi,7.86%)、丝孢酵母目(Trichosporonales,6.36%)。其中,优势真菌目是未分类子囊菌门下目、被孢霉目和肉座菌目,约占所有真菌目的46.18%。由图3B可知,除肉座菌外,其他4种菌群在各生境分布均有显著差异。未知子囊菌门下目的相对丰度在人工林地、滩涂地与撂荒地3种生境间无显著差异,但均显著高于农业用地(P<0.05),且农业用地与城市绿地有显著差异(P<0.05)。被孢霉菌在农业用地生境中分布较多,远高于其他生境(P<0.05),同时城市绿地与撂荒地存在显著差异(P<0.05)。未知菌目在人工林地与滩涂地间无显著差异,但均高于其他3种生境(P<0.05)。丝孢酵母目相对丰度在撂荒地最高(P<0.05),而在其他4种生境中分布较少。

图 3 不同土地利用方式下的土壤真菌群落组成Fig. 3 Composition of soil fungal community under different land use types
2.4 不同土地利用方式真菌群落多样性
对15个样地的土壤样品所得测序序列,以97%相似性阈值进行OTU聚类,共检测到真菌群落5 360个OTU,分属17门46纲118目295科627属1 033种,15个样地的真菌群落多样性见表4。由表4可知,5种生境的土壤真菌群落多样性指数均存在显著差异。Shannon指数和Simpson指数在城市绿地与农业用地间均存在显著差异(P<0.05),同时Shannon指数在人工林地与撂荒地间存在显著差异(P<0.05),其余差异不显著。ACE和Chao1指数均表示丰富度,可知农业用地的丰富度指数显著低于其他生境(P<0.05),滩涂地最高(P<0.05),但与人工林地无显著差异,同时城市绿地与人工林地、撂荒地差异不显著。综上,各生境下的土壤真菌群落多样性表现为撂荒地<农业用地<滩涂地<人工林地<城市绿地,丰富度表现为农业用地<撂荒地<城市绿地<人工林地<滩涂地。虽各生境下的菌群多样性与丰富度存在一定差异,但可以得知人工林地真菌群落多样性和丰富度均较高,而农业用地和撂荒地均较低。

表 4 不同土地利用方式下土壤真菌群落多样性分析Tab. 4 Diversity analysis of soil fungal community under different land use types
2.5 环境因子对土壤微生物的影响
土壤微生物多样性与土壤环境因子的相关性分析表明,除Bd以外的各理化性质均与细菌多样性有显著差异,且均与Shannon指数存在极显著相关性(P<0.01),而真菌多样性仅与pH存在显著相关性(见表5)。Wc和AK均与细菌多样性呈极显著相关(P<0.01),其中,与Simpson指数呈正相关,与Shannon指数和丰富度指数呈负相关。由表5可知,Wc、NH4+-N和AK是影响细菌群落多样性和丰富度的关键性环境因素;pH是影响真菌群落多样性的唯一环境因子,而各环境因子与丰富度指数的相关性均不强。
为揭示微生物群落与环境因子的关系,以门分类水平上的微生物群落作为响应变量,土壤理化因子作为环境解释变量进行了冗余分析(RDA)。可知影响细菌菌群组成的主要环境因子是pH、Wc、AK、Bd,而对真菌菌群影响较大的是pH、Bd(见图4)。如图4A,人工林地生境的己科河菌与AK、Wc、AP及NH4+-N均有显著的正相关性,与Bd和pH呈负相关。撂荒地生境中除己科河菌之外的4种优势菌群均与pH呈正相关,变形菌与pH的相关性最强。农业用地与除Bd以外的环境因子均呈负相关,而与Bd有一定正相关性。城市绿地的放线菌和绿弯菌与pH和Bd存在一定正相关。如图4B,城市绿地、人工林地、滩涂地生境的子囊菌与pH、Wc和AK有一定正相关性,而与AP、NH4+-N呈负相关。农业用地生境的被孢霉菌与NH4+-N呈正相关,与AK、Wc和pH负正相关。撂荒地生境的担子菌与pH存在较强的正相关,且与Wc和AK有一定正相关性,但与Bd呈负相关。
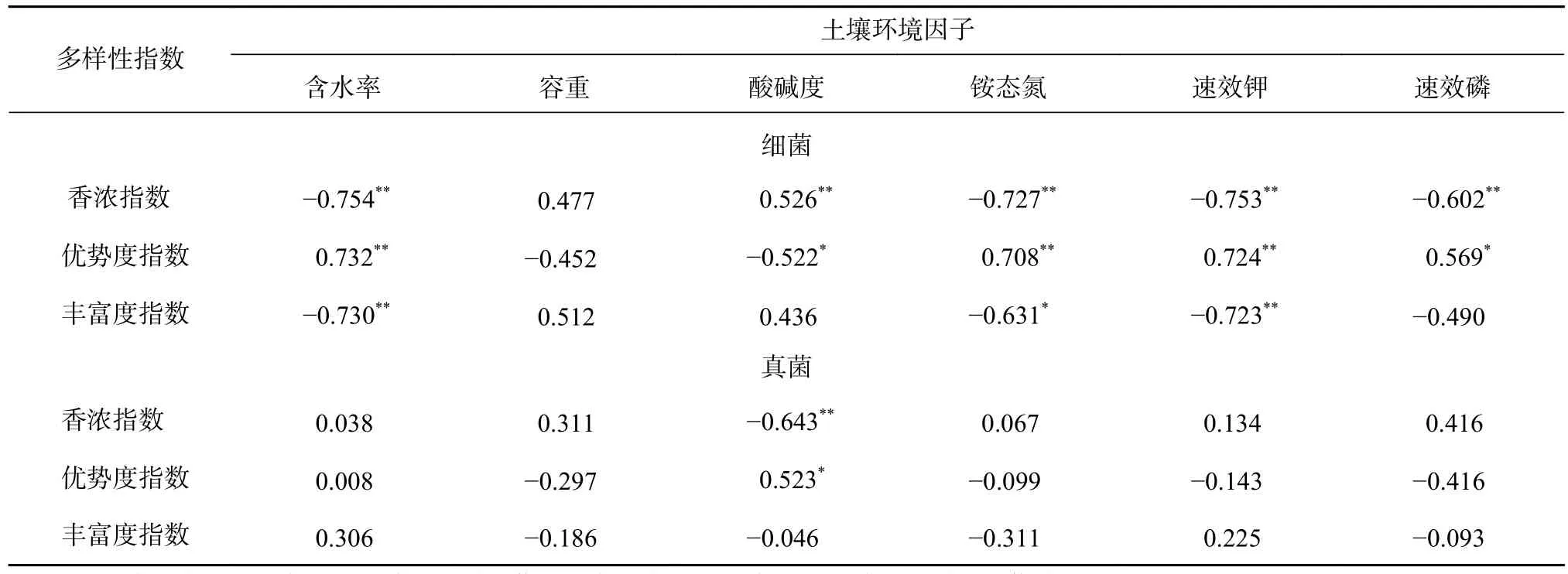
表 5 土壤微生物多样性与环境因子的相关性分析Tab. 5 Correlation analysis between soil microbial diversity and environmental factors
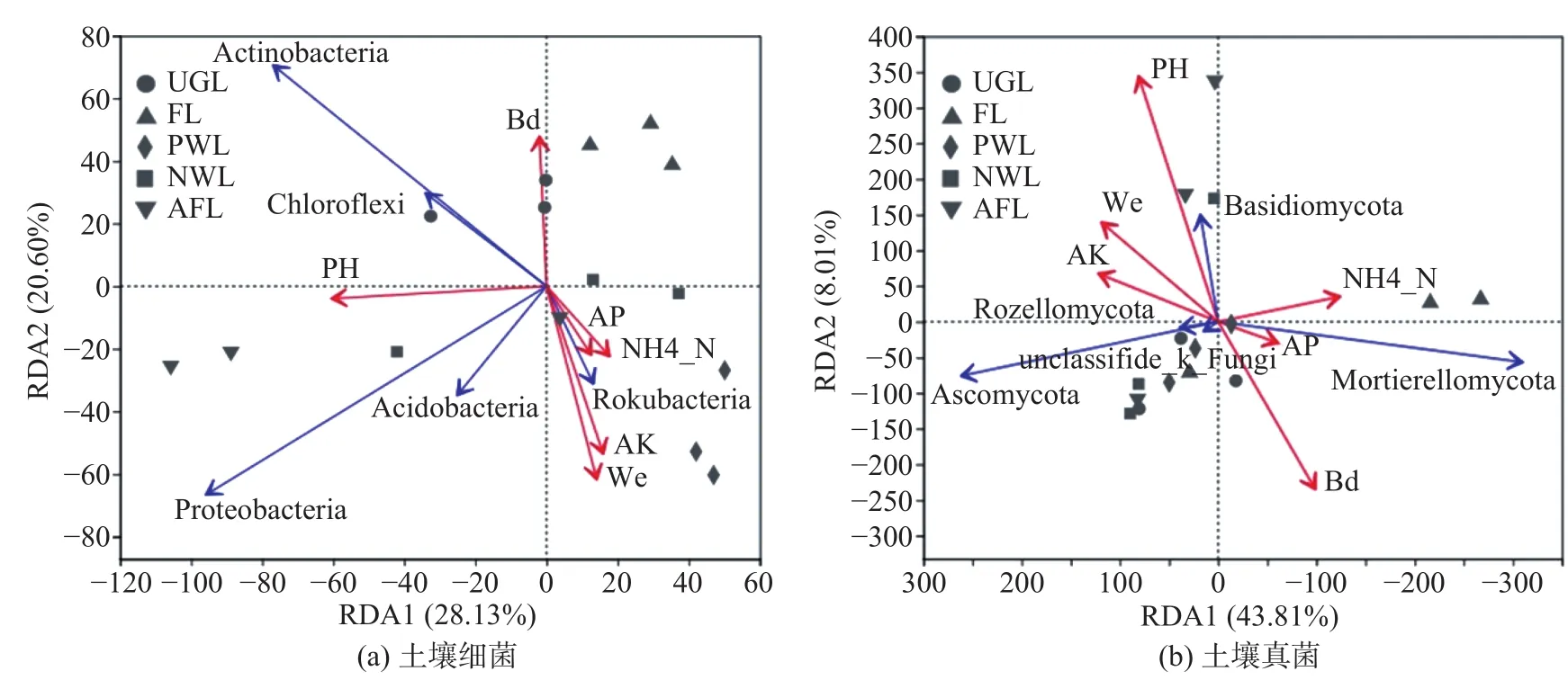
图 4 门水平上的土壤菌群与环境因子的冗余分析Fig. 4 Redundancy analysis (RDA) of soil bacterial community at phyla level and environmental factors
3 讨论
3.1 土地利用方式对土壤微生物群落结构特征的影响
研究发现,5种生境土壤细菌群落主要为变形菌门、放线菌门、酸杆菌门和绿弯菌门等类群,真菌群落包括子囊菌门、担子菌门和被孢霉门等菌群。与多数研究结果基本一致[16,23-24],但在相对丰度上存在一定差异。人工林地生境具有较高的酸杆菌丰度和较低的放线菌丰度,原因可能是杉木根系分泌的酚酸类物质有利于部分酸杆菌菌群生长[25-26],而对于森林凋落物的分解,放线菌主要参与半分解有机物的分解过程,前期由细菌和真菌主导[3,27]。城市绿地生境的酸杆菌丰度较低、变形菌较高。这与Fierer假说观点吻合,由于研究样地存在历史较长,土壤生态环境渐趋稳定,导致富营养型细菌(如变形菌门)丰度增加,寡营养型细菌(如酸杆菌门、绿弯菌门)相应减少[28]。研究表明连作牡丹会导致其根际土壤微生物群落结构失衡,群落多样性下降[29]。由于长期栽种同种作物,农业用地土壤腐殖质含量下降,导致耐贫瘠的微生物菌群增多,减少了富养型菌群多样性,因此表现为变形菌丰度偏低、绿弯菌较高[17]。滩涂地生境具有较高的变形菌丰度,与多数研究结果[11,30]相吻合。本研究所有样地的真菌中子囊菌占比最大,属优势菌门。研究表明子囊菌门真菌多数为腐生菌,对降解土壤有机质具有重要作用,同时也是土壤中主要的真菌分解者[24,31]。
3.2 土地利用方式对土壤微生物群落多样性的影响
大量研究表明,土地利用方式是影响土壤质量的关键因素,通过植被的多样性和异质性、管理措施的不同来影响土壤理化性质,进而对土壤微生物多样性及其组成结构产生影响[7,32]。微生物多样性指数越高表明群落多样性越高。本研究发现人工林地具有较低的细菌多样性和较高的真菌多样性。研究表明凋落物分解的不同时期可能形成不同的微生物群落结构[27]。由于杉木枝叶残体富含木质素、纤维素等难分解有机物,前期易利用的凋落物被消耗后,主要由真菌进行后期木质素含量高、质量低的有机物分解活动[10,33];同时土壤细菌和真菌是碎屑食物链的组成部分,土壤动物的牧食对两种菌群的群落结构也具有一定影响,本研究发现人工林地土壤动物丰度显著高于其余几种生境,这可能是导致人工林地细菌丰度及多样性较低的原因之一。本研究中,城市绿地与滩涂地生境均具有较高的微生物多样性。Huang等认为城市土壤保持了丰富的地下生物群落[34]。由于城市绿地建成历史较长,土壤理化结构渐趋稳定,且均为乔灌草复合型配置模式,具有较丰富的植物群落,土壤养分供给充足,有利于土壤微生物的活动。Gomez认为土壤微生物的功能多样性在自然植被条件下要高于植被扰动情况[35]。因滩涂地为自然形态,有一定的植被生物量和盖度,有机质积累丰富,同时干扰较少,因此表现出较高的微生物丰富度和多样性[36]。同时,发现农业用地生境的细菌、真菌均存在多样性较低的现象,可能是由于源物质回收处理致使土壤有机质输入减少,人为耕作管理方式破坏真菌菌丝生长,影响土壤团聚体的稳定性,导致微生物多样性降低[12]。
3.3 土壤微生物与土壤环境因子的关系
土壤微气候环境是影响土壤微生物群落的关键因素,如土壤温度、湿度、pH等,土壤养分作为微生物生存发展的必要营养元素,在土壤中的有效性也成为影响或制约土壤微生物群落结构的重要因子[37-38]。研究发现Ws、pH、NH4+-N、AK、AP 5种环境因子均对细菌群落多样性有显著影响,而与真菌群落多样性显著相关的仅pH。大量研究认为植被类型与土壤特性是影响微生物的重要因素[32],细菌与土壤性质的相关性更强,而真菌与植物群落的关系更密切[24,39]。同时,土壤pH与细菌多样性呈正相关,与真菌呈负相关,真菌相比细菌更偏好在酸性土壤环境中生存,这与大多数研究结果吻合[10,24,40],原因可能与微生物对pH的选择性适应有关。pH对细菌与真菌的群落组成也有重要影响。pH与除己科河菌外的4种优势细菌门均存在正相关性,证实了大部分细菌适宜在pH值较高的土壤中生存。Bd可影响土壤透气性、水分及其有效性,进而影响到微生物生命活动[41]。研究发现放线菌、绿弯菌和被孢霉菌与Bd存在一定正相关,表明3种菌群具有较强的生态适应性。己科河菌与AK、AP、NH4+-N、Ws存在正相关,反映了己科河菌对于养分丰富的土壤环境的偏好。由于子囊菌和担子菌偏好通气性好的土壤条件,是土壤有机质的主要分解者[42],因此其与Ws、AK呈正相关,与Bd负相关,与乌拉山油松根际真菌群落结构[14]的研究结果一致。综上,土壤pH是土壤微生物群落结构、组成和多样性的主要作用因子,与多数研究结果一致[16,23,37]。
4 结论
土地利用方式影响土壤理化性质及土壤微生物群落结构,土壤微生物变化对生态环境具有重要的指示作用,土壤pH可作为预测微生物群落变化和土壤质量的指标之一。本研究区内微生物多样性较高的生境是城市绿地与滩涂地,一改人们对城市建成区破坏严重、环境恶化的固有印象,而滩涂地自然化高、受人为影响较少。这两种生境均为土壤微生物的活动提供了较好的栖息环境,对提升微生物多样性、维持生态系统稳定性有着突出的作用,应重视并维护好此类土地的发展。人工杉木林连栽及农作物连作均会导致土壤微生物多样性下降,必须摒弃不合理的营林模式和农耕模式,优化资源利用方式。

