不同品种羊血液和肺脏中TLRs基因转录水平差异分析
唐沙 陈静 岳筠 李涛 李梅 文明 张双翔 程振涛


摘要:【目的】分析不同品種羊Toll样受体(TLRs)基因转录水平的差异性,为揭示TLRs基因转录水平与羊疫病间的关联性提供参考依据。【方法】选取贵州省主要饲养的贵州黑山羊、贵州白山羊、黔北麻羊、波尔山羊和湖羊为研究对象,根据GenBank已公布的TLRs基因序列设计荧光定量PCR特异性扩增引物及TaqMan探针引物,利用TaqMan探针荧光定量PCR检测不同品种羊血液和肺脏中TLR1~TLR10基因转录水平差异。【结果】TLR1~TLR10基因在不同品种羊血液和肺脏中均有转录表达。不同品种羊血液和肺脏中的TLRs基因转录水平均存在差异性,在波尔山羊血液中TLR2、TLR4和TLR5基因转录水平均极显著低于其他4种羊(P<0.01,下同),TLR7和TLR8基因转录水平则极显著低于除黑山羊外的其他3种羊;在白山羊血液中TLR4、TLR7、TLR8和TLR9基因转录水平极显著高于其他4种羊;在湖羊肺脏中TLR2、TLR3、TLR4、TLR5和TLR8基因转录水平极显著低于其他4种羊,而在黔北麻羊肺脏中TLR5和TLR8基因转录水平极显著高于其他4种羊。此外,在5种羊血液中TLR2、TLR4、TLR7和TLR8基因转录水平均极显著高于其他TLRs基因转录水平;羊肺脏中TLR2、TLR3、TLR4、TLR5和TLR8基因转录水平相对较高,在贵州白山羊、贵州黑山羊和波尔山羊均表现为极显著高于其他TLRs基因转录水平。【结论】不同品种羊血液和肺脏中TLRs基因转录水平具有差异性,以TLR2、TLR3、TLR4、TLR5和TLR8基因转录水平相对较高,提示TLRs在不同品种羊机体中发挥着清除病原体及维持机体稳态的作用,而TLRs基因转录水平差异可能是造成不同品种羊对疫病易感差异的原因之一。
关键词: 羊;Toll样受体(TLRs);血液;肺脏;转录水平
中图分类号: S858.26 文献标志码: A 文章编号:2095-1191(2021)11-3130-09
Differential analysis of transcript levels of TLRs genes in the blood and lungs of different breeds of sheep
TANG Sha1, CHEN Jing1, YUE Jun2, LI Tao2, LI Mei1, WEN Ming1,3,
ZHANG Shuang-xiang2*, CHENG Zhen-tao1 ,3 *
(1College of Animal Science, Guizhou University, Guiyang 550025, China; 2Animal Disease Prevention and Control Center in Guizhou Province, Guiyang 550008, China; 3Key Laboratory of Animal Diseases and Veterinary
Public Health in Guizhou Province, Guiyang 550025, China)
Abstract:【Objective】To analyze the variability of transcript levels of Toll-like receptors (TLRs) genes in different breeds of sheep, and to provide a reference basis for revealing the association between the transcript levels of TLRs genes and epidemic diseases in sheep. 【Method】In this study, Guizhou black goat, Guizhou white goat,Qianbei Ma goat,Boer goat and Hu sheep, which are the main breeding species in Guizhou Province, were selected for the study, and fluorescent quantitative PCR specific amplification primers and TaqMan probe primers were designed according to the published TLRs gene sequences in GenBank, and the differences in transcript levels of TLR1-TLR10 genes in blood and lung of different breeds of sheep were detected by using TaqMan probe fluorescent quantitative PCR.【Result】TLR1-TLR10 genes were transcriptionally expressed in the blood and lungs of different breeds of sheep. Differential transcript levels of TLRs genes were in both blood and lung of different breeds of sheep,the transcript levels of TLR2, TLR4 and TLR5 genes in the blood of Boer goats were extremely significantly lower than those of the other four species (P<0.01, the same below),the transcript levels of TLR7 and TLR8 genes were extremely significantly lower than those of the other three species of sheep except black goats. The transcript levels of TLR4, TLR7, TLR8 and TLR9 genes in the blood of white goats were extremely significantly higher than those of the other four species. The transcript levels of TLR2, TLR3, TLR4, TLR5 and TLR8 genes in the lungs of Hu sheep were extremely significantly lower than those of the other four sheep species, while the transcript levels of TLR5 and TLR8 genes were extremely highly significant higher in the lungs of Qianbei Ma sheep than in the other four species. In addition, the transcript levels of TLR2, TLR4, TLR7 and TLR8 genes in the blood of five sheep species were all extremely significantly higher than the transcript levels of other TLRs genes. Transcript levels of TLR2, TLR3, TLR4, TLR5 and TLR8 genes in sheep lungs were relatively high, in Guizhou white goat, Guizhou black goat and Boer goat all showed extremely significantly higher transcript levels than other TLRs genes. 【Conclusion】The transcript levels of TLRs genes in the blood and lungs of different breeds of sheep are different, with TLR2, TLR3, TLR4, TLR5 and TLR8 genes having relatively high transcript levels. It is suggested that TLRs play a role in the organism of different breeds of sheep in scavenging pathogens and maintaining the homeostasis of the organism, and the difference in the transcription level of TLRs genes may be one of the reasons for the difference in susceptibility of different breeds of sheep to epidemic diseases.
Key words: sheep; Toll-like receptors (TLRs); blood; lung; transcription level
Foundation item: National Natural Science Foundation of China (31660723, 32060786); Guizhou Provincial Scien-ce and Technology Project (Qiankehejichu〔2019〕1181, Qiankehezhicheng〔2018〕2271)
0 引言
【研究意義】贵州黑山羊、贵州白山羊和黔北麻羊具有生产性能优、适应范围广、抗病性强及耐粗饲等特点,是贵州省养羊业重点发展的地方种质资源(刘彬等,2014);波尔山羊和湖羊具有适应性好、繁殖力强和耐粗饲等特点,是贵州省引进的外来品种(陈其新等,2012)。近年来,贵州省羊疫病的频发与蔓延极大阻碍其产业的健康发展。Toll样受体(Toll-like receptors,TLRs)作为一类模式识别受体,能通过识别病原微生物保守的分子相关模式而实现对外来病原体的早期识别,具有激活机体天然免疫和调节机体获得性免疫的能力(Vidya et al.,2018;赵飞等,2019)。疫病流行病学调查显示,在应对羊疫病发生时不同品种的易感性存在明显差异,可能与不同品种羊的TLRs基因转录水平差异具有一定的相关性。因此,分析不同品种羊TLRs基因转录水平差异,对探究TLRs基因与羊疫病发生的关联性具有重要意义。【前人研究进展】至今,已知TLRs家族包括TLR1~TLR10,共10个成员,针对家畜TLRs的研究多见于马、牛和猪等物种(Wassef et al.,2004;Alvarez et al.,2006;Tirumurugaan et al.,2010)。赵一萍等(2012)对蒙古马不同组织器官中TLR4、TLR2、TLR1和TLR6的转录水平进行检测,结果发现TLRs基因mRNA在蒙古马各组织器官的转录水平差异明显,可能与其识别和抵抗病原体的能力有关。李鹏和王雅春(2019)对猪TLRs的种类、进化特点及免疫相关研究现状进行系统分析,发现猪TLRs广泛分布在各种组织细胞内,且在免疫相关组织或细胞上的数量较多,在抵御病原入侵的过程中发挥重要作用。唐娜等(2020)研究表明,TLRs在水牛组织中也有广泛分布,在脾脏、肺脏和肝脏等组织中均有表达,并证实TLR1、TLR2及TLR4在牛抗病免疫方面发挥重要作用。近年来,TRL2和TLR4作为抗病原体免疫应答功能的家族成员得到广泛关注及深入研究(Barton and Medzhitov,2003;O'Neill et al.,2013)。TLR2可调控细胞内的信号传导,且在机体识别病原微生物方面发挥重要作用,在抗菌抗病毒过程中能直接或间接对炎症因子的合成与释放起促进作用,与机体的免疫作用紧密相关(杨庆利和冷静,2021)。TLR4能介导革兰氏阴性菌及其脂多糖(LPS)的宿主反应,还能刺激机体产生相关细胞因子以抵抗病毒侵入,对机体识别病原体和增强抗病性能具有重要意义(赵明明等,2016)。刘洁等(2020)对支原体肺炎小鼠的TLR2/TLR4、MYD88和NF-κB20P65表达水平及其相关性进行分析,结果发现TLR2和TLR4表达水平在支原体肺炎小鼠中升高,且参与支原体感染的免疫损伤修复。【本研究切入点】目前,关于羊TLRs基因转录水平的研究尚无详细报道,针对不同品种羊TLRs基因转录水平与其疫病易感性差异的研究更是鲜见报道。【拟解决的关键问题】选取贵州省主要饲养的5种羊为研究对象,基于TaqMan探针荧光定量PCR分析不同品种羊TLR1~TLR10基因转录水平的差异性,为揭示TLRs基因转录水平与羊疫病间的关联性提供参考依据。
1 材料与方法
1. 1 试验材料
每个品种羊10份抗凝血液及10份肺脏组织,分别采自健康无病的贵州黑山羊、贵州白山羊、黔北麻羊、波尔山羊和湖羊;各品种羊样本则由贵州省各品种羊规模养殖场提供,3月龄,未注射任何疫苗,且利用PCR和血清学诊断方法(赵萍等,2010;冯杰等,2016)对25只羊进行山羊支原体山羊肺炎亚种(Mccp)、丝状支原体山羊亚种(Mmc)、绵羊肺炎支原体(MO)、布氏杆菌(Brucella)、口蹄疫(FAM)、小反刍兽疫(PPR)、山羊痘(GP)的病原学和血清抗体检测,结果均呈阴性。RNAprep Pure血液总RNA提取试剂盒购自天根生化科技(北京)有限公司;RNAiso Plus组织总RNA提取试剂和PrimeScript™ RT Master Mix购自TaKaRa公司。
1. 2 引物设计与合成
参考GenBank已公布的TLRs基因序列,选择5种羊TLRs基因保守区域序列,使用Primer Premier 5.0分别设计TLR1~TLR10基因特异性扩增引物和TaqMan探针引物(表1),并委托生工生物工程(上海)股份有限公司合成。
1. 3 RNA提取及cDNA合成
参照RNAprep Pure血液总RNA提取试剂盒说明提取5种羊50份血液样本总RNA,同时采用TRIzol法提取5种羊50份肺脏组织总RNA,以PrimeScriptTM RT Master Mix试剂盒制备cDNA。反转录过程:0.1~2.0 μg总RNA加RNase-free ddH2O至8.0 μL,再加入5×PrimeScriptTM RT Master Mix 2.0 μL,混匀。37 ℃反转录15 min,然后85 ℃灭活5 s,-20 ℃保存备用。
1. 4 不同品种羊血液及肺脏组织中TLRs基因转录水平检测
将已制作好的TLR1~TLR10标准质粒稀释成整数倍,再按10倍梯度进行稀释,选取其中5个梯度(107~103)绘制标准曲线,并拟合回归方程。采用TaqMan探针荧光定量PCR对不同品种羊的10份血液和肺脏样本cDNA进行TLR1~TLR10基因检测,根据回归方程与样品检测得到的Ct,计算出待测样品中的基因拷贝数,分别记录5种羊血液及肺脏组织中TLR1~TLR10基因的拷贝数。
1. 5 TLRs基因转录水平差异显著性分析
运用SPSS 20.0对TLR1~TLR10基因在不同品种羊血液及肺脏组织中的转录水平进行差异显著性分析,并以Graphpad Prism 6.4进行绘图。
2 结果与分析
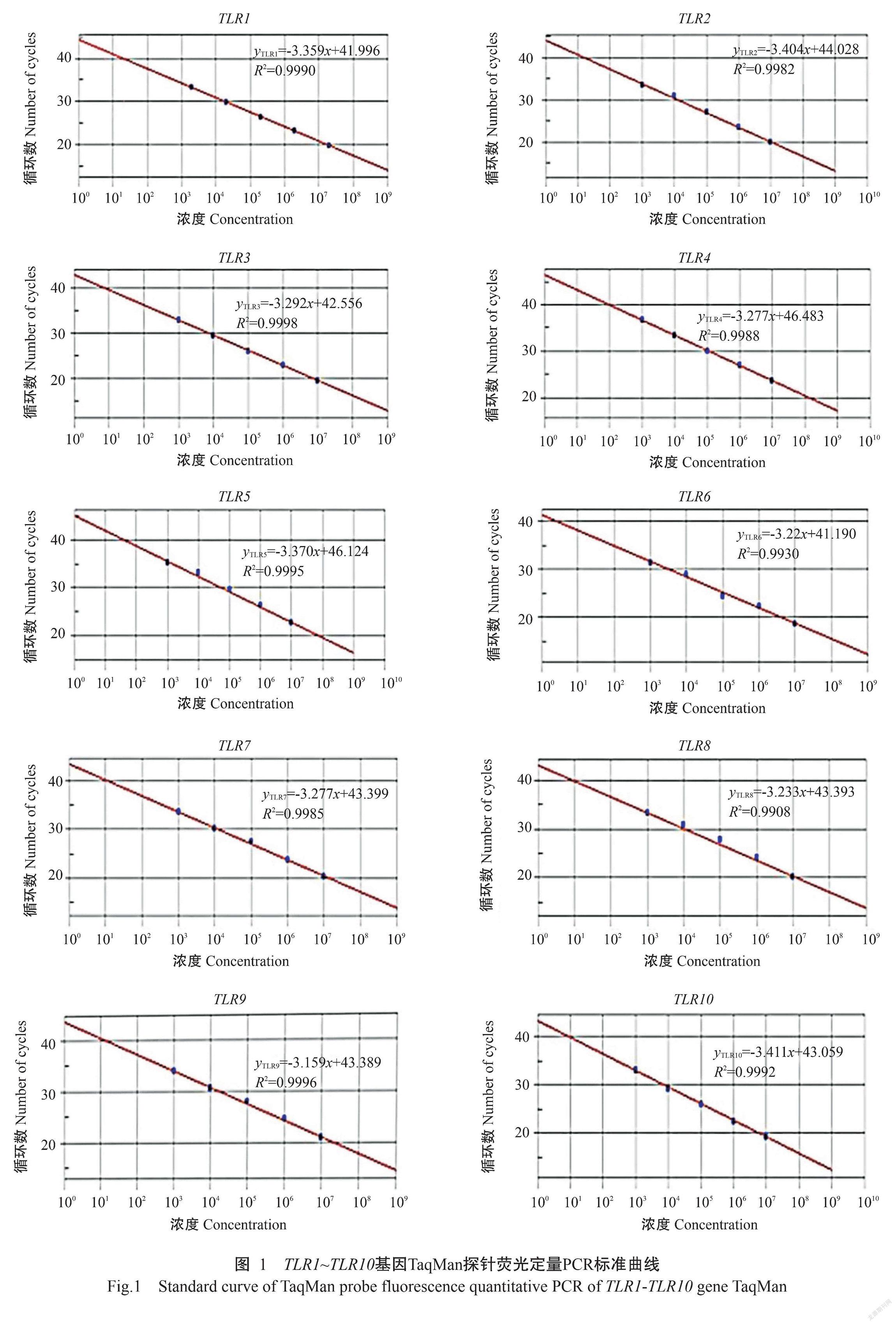
2. 1 TaqMan探针荧光定量PCR标准曲线
TLR1~TLR10基因TaqMan探针荧光定量PCR标准曲线见图1,对应的回归方程分别为:yTLR1=-3.359x+41.996(R2=0.9990);yTLR2=-3.404x+44.028(R2=0.9982);yTLR3=-3.292x+42.556(R2=0.9998);yTLR4=-3.227x+46.483(R2=0.9988);yTLR5=-3.370x+46.124(R2=0.9995);yTLR6=-3.220x+41.190(R2=0.9930);yTLR7=-3.277x+43.399(R2=0.9985);yTLR8=-3.233x+43.393(R2=0.9908);yTLR9=-3.159x+43.389(R2=0.9996);yTLR10=-3.411x+43.059(R2=0.9992)。
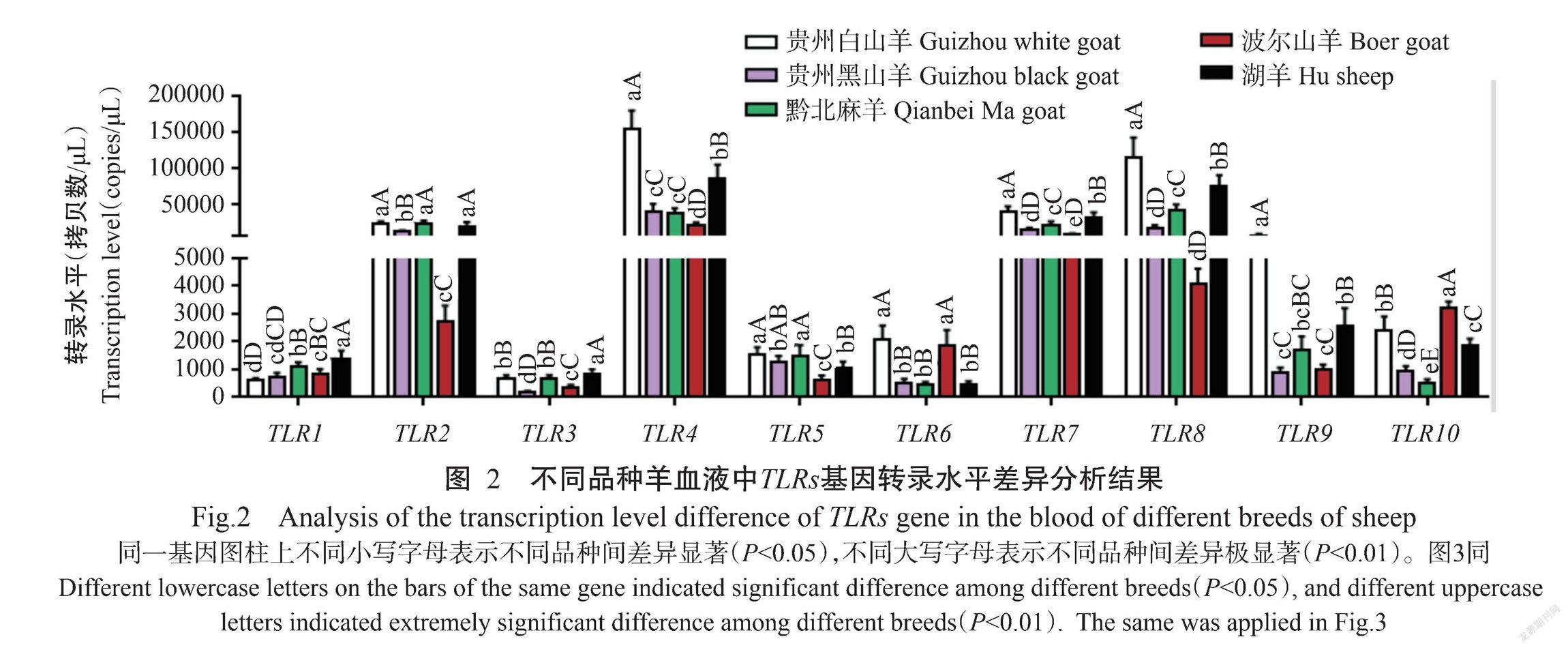
2. 2 不同品种羊血液中TLRs基因转录水平差异
对5种羊血液中的TLR1~TLR10基因转录水平差异进行分析,结果(图2)显示,不同品种羊血液中TLR1基因转录水平排序为贵州白山羊<贵州黑山羊<波尔山羊<黔北麻羊<湖羊,TLR2基因转录水平排序为波尔山羊<贵州黑山羊<湖羊<贵州白山羊<黔北麻羊,TLR3基因转录水平排序为贵州黑山羊<波尔山羊<黔北麻羊<贵州白山羊<湖羊,TLR4基因转录水平排序为波尔山羊<黔北麻羊<贵州黑山羊<湖羊<贵州白山羊,TLR5基因转录水平排序为波尔山羊<湖羊<贵州黑山羊<黔北麻羊<贵州白山羊,TLR6基因转录水平排序为黔北麻羊<湖羊<贵州黑山羊<波尔山羊<贵州白山羊,TLR7基因转录水平排序为波尔山羊<贵州黑山羊<黔北麻羊<湖羊<贵州白山羊,TLR8基因转录水平排序为波尔山羊<贵州黑山羊<黔北麻羊<湖羊<贵州白山羊,TLR9基因转录水平排序为贵州黑山羊<波尔山羊<黔北麻羊<湖羊<贵州白山羊,TLR10基因转录水平排序为黔北麻羊<贵州黑山羊<湖羊<贵州白山羊<波尔山羊。在波尔山羊血液中TLR2、TLR4和TLR5基因转录水平均极显著低于其他4种羊(P<0.01,下同),TLR7和TLR8基因转录水平则极显著低于除黑山羊外的其他3种羊;在白山羊血液中TLR4、TLR7、TLR8和TLR9基因转录水平极显著高于其他4种羊。
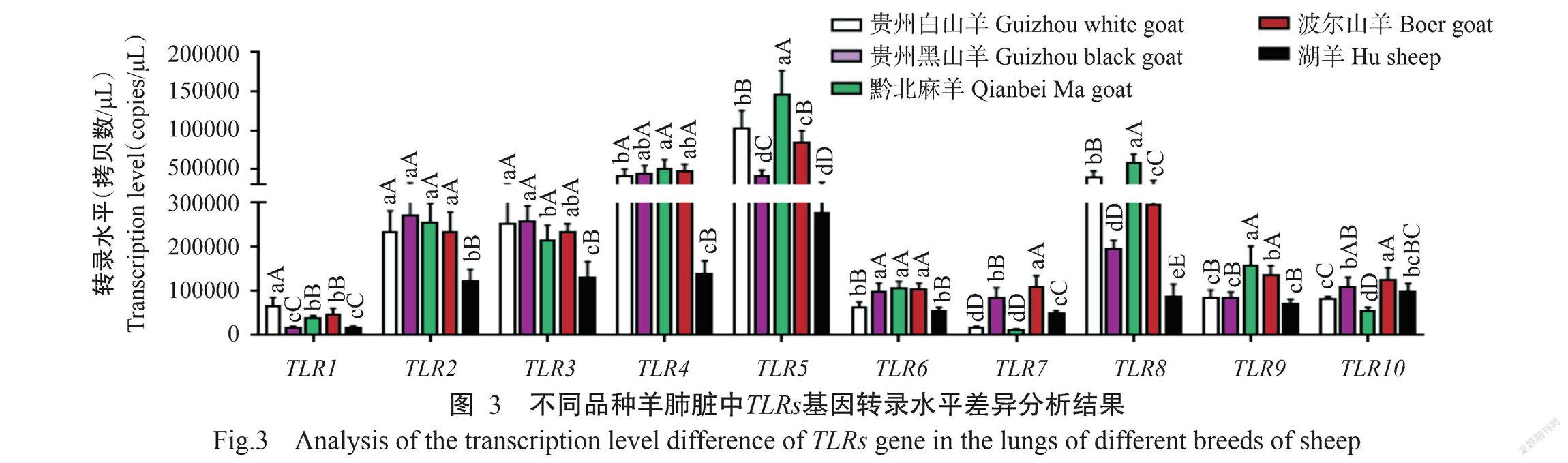
2. 3 不同品种羊肺脏中TLRs基因转录水平差异
对5种羊肺脏中的TLR1~TLR10基因转录水平差异进行分析,结果(图3)显示,不同品种羊肺脏中TLR1基因转录水平排序为贵州黑山羊<湖羊<黔北麻羊<波尔山羊<贵州白山羊,TLR2基因转录水平排序为湖羊<波尔山羊<贵州白山羊<黔北麻羊<贵州黑山羊,TLR3基因转录水平排序为湖羊<黔北麻羊<波尔山羊<贵州白山羊<贵州黑山羊,TLR4基因转录水平排序为湖羊<贵州白山羊<贵州黑山羊<波尔山羊<黔北麻羊,TLR5基因转录水平排序为湖羊<贵州黑山羊<波尔山羊<贵州白山羊<黔北麻羊,TLR6基因转录水平排序为湖羊<贵州白山羊<波尔山羊<贵州黑山羊<黔北麻羊,TLR7基因转录水平排序为黔北麻羊<贵州白山羊<湖羊<贵州黑山羊<波尔山羊,TLR8基因转录水平排序为湖羊<贵州黑山羊<波尔山羊<贵州白山羊<黔北麻羊,TLR9基因转录水平排序为湖羊<贵州白山羊<贵州黑山羊<波尔山羊<黔北麻羊,TLR10基因转录水平排序为黔北麻羊<贵州白山羊<湖羊<贵州黑山羊<波尔山羊。在湖羊肺脏中TLR2、TLR3、TLR4、TLR5、TLR6、TLR8和TLR9基因转录水平均低于其他4种羊,其中TLR2、TLR3、TLR4、TLR5和TLR8基因转录水平极显著低于其他4种羊;而在黔北麻羊肺脏中TLR5和TLR8基因转录水平极显著高于其他4种羊。
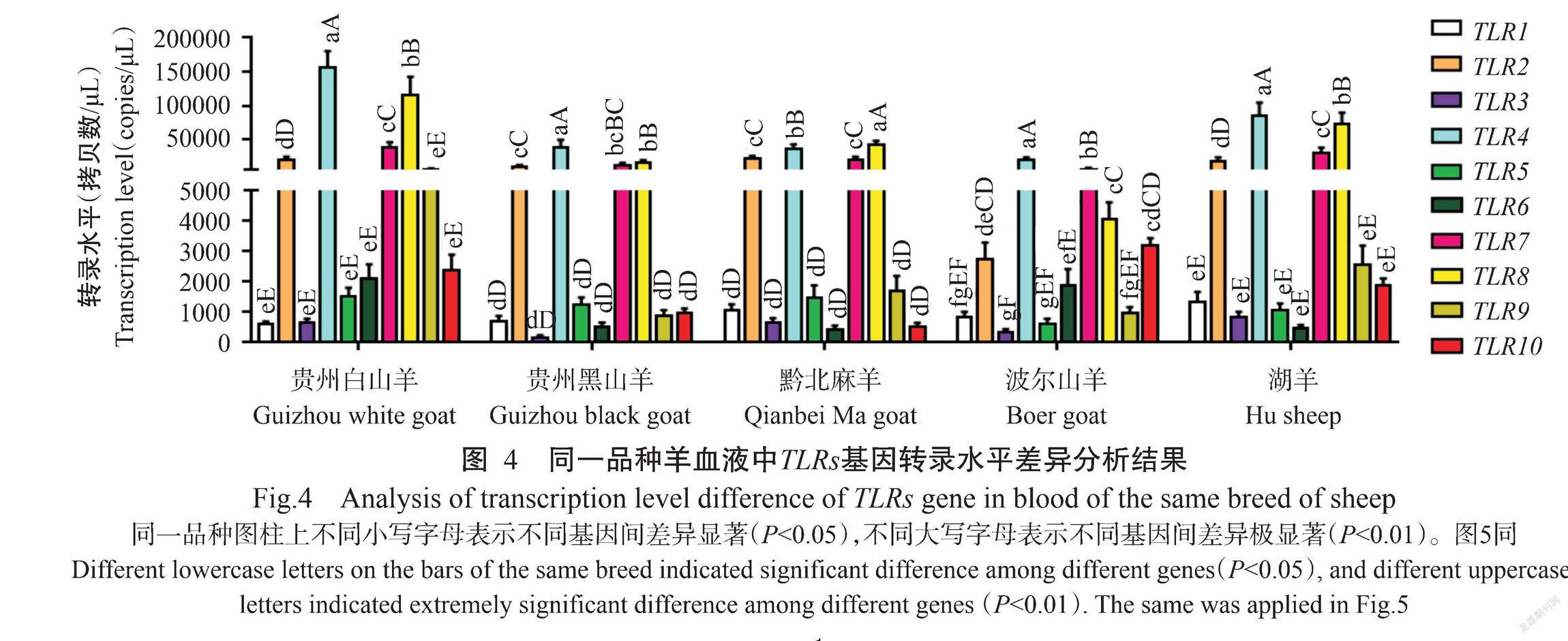
2. 4 同一品种羊血液中TLRs基因转录水平差异
对同一品种羊血液中的TLR1~TLR10基因转录水平差异进行分析,结果(图4)显示,在波尔山羊血液中TLR2、TLR4、TLR7、TLR8和TLR10基因转录水平较高,均极显著高于其他TLRs基因转录水平;在其他4种羊血液中TLR2、TLR4、TLR7和TLR8基因转录水平也极显著高于其他TLRs基因转录水平。TLR2、TLR4、TLR7和TLR8基因转录水平在贵州白山羊、贵州黑山羊和湖羊血液中均表现为TLR2基因<TLR7基因<TLR8基因<TLR4基因,在黔北麻羊血液中表现为TLR7基因<TLR2基因<TLR4基因<TLR8基因,在波尔山羊血液中表现为TLR2基因<TLR8基因<TLR7基因<TLR4基因。可见,在黔北麻羊血液中TLR8基因具有相对较高的转录水平,而其他4种羊均以TLR4基因具有相对较高的转录水平。
2. 5 同一品种羊肺脏中TLRs基因转录水平差异
对同一品种羊肺脏中的TLR1~TLR10基因转录水平差异进行分析,结果(图5)显示,羊肺脏中TLR1基因轉录水平相对较低,而TLR2、TLR3、TLR4、TLR5和TLR8基因转录水平相对较高,在贵州白山羊、贵州黑山羊和波尔山羊均极显著高于其他TLRs基因。TLR2、TLR3、TLR4、TLR5和TLR8基因转录水平在贵州白山羊肺脏中表现为TLR2基因<TLR3基因<TLR8基因<TLR4基因<TLR5基因,在贵州黑山羊肺脏中表现为TLR8基因<TLR3基因<TLR2基因<TLR5基因<TLR4基因,在黔北麻羊肺脏中表现为TLR3基因<TLR2基因<TLR4基因<TLR8基因<TLR5基因,在波尔山羊肺脏中表现为TLR3基因<TLR2基因<TLR8基因<TLR4基因<TLR5基因,在湖羊肺脏中表现为TLR8基因<TLR2基因<TLR3基因<TLR4基因<TLR5基因。可见,TLR4基因在贵州黑山羊肺脏中具有相对较高的转录水平,但在其他4种羊肺脏中均表现为TLR5基因具有相对较高的转录水平。
3 討论
TLRs可激活机体免疫应答并对其免疫功能进行调节,在机体的炎症反应及相关信号传导过程中发挥重要作用(赵飞等,2019)。TLRs在哺乳动物各组织中广泛表达,已证实TLRs可减少和清除机体的细菌性病原感染(Albiger et al.,2010)。TLRs家族对不同组织病原体的识别作用直接受其在该组织中转录水平的影响,即TLRs转录水平决定了动物个体或组织器官应对外源微生物侵染的能力(Menzies and Ingham,2006;Tirumurugaan et al.,2010)。赵一萍等(2012)对蒙古马不同组织器官的TLR3、TLR7、TLR8和TLR9基因转录水平进行研究,结果发现TLRs基因转录水平在蒙古马各组织器官中存在明显差异,可能与其对病原体的识别和抵抗能力有关;陈亚冰等(2014)对牦牛不同组织TLR3和TLR5基因转录水平进行研究,发现TLRs基因在不同组织器官的转录水平差异明显,推测其与病原体识别有关。本研究采用TaqMan探针荧光定量PCR检测TLR1~TLR10基因在贵州黑山羊、贵州白山羊、黔北麻羊、波尔山羊及湖羊等5种羊血液和肺脏组织中的转录水平差,与程晓薇等(2017)检测家禽β-连环蛋白基因在不同脏器表达水平应用的绝对荧光定量PCR相同,但与陆珂静等(2019)检测小鼠TLRs mRNA表达量的相对荧光定量PCR不同。与相对荧光定量PCR相比,绝对荧光定量PCR更准确,且特异性更好(朱振洪等,2011)。
病原致病性存在种间和种内差异,即不同物种或同物种不同品种对同一病原的感染存在易感差异性,如Mmc在自然状态下只感染山羊,一般不感染绵羊(樊庆德等,2011)。陶岳等(2006)对新疆石河子地区湖羊流行病学进行调查,结果发现传染性胸膜肺炎对不同品种羊的感染性存在明显差异。本研究结果表明,不同品种羊血液和肺脏中的TLRs基因转录水平均存在差异,其中,波尔山羊血液中TLR2、TLR4和TLR5基因转录水平均极显著低于其他4种羊,TLR7和TLR8基因转录水平则极显著低于除黑山羊外的其他3种羊。这与本课题组前期对贵州省山羊支原体肺炎易感性调查发现波尔山羊较其他品种山羊具有更高发病率的结论相吻合,提示波尔山羊对羊支原体肺炎易感性可能受TLRs基因转录水平差异的影响。
越来越多研究证实,同一TLRs基因在同科不同属,甚至同种动物间也存在微小的差异(曾爽等,2015)。TLRs基因在不同品种羊中的转录水平具有一定差异性,可能是造成不同品种羊对疫病易感差异的原因之一。本研究发现,在贵州黑山羊、贵州白山羊、黔北麻羊、波尔山羊及湖羊等5种羊血液中TLR2、TLR4、TLR7和TLR8基因具有较高的转录水平,均极显著高于其他TLRs基因转录水平;肺脏中TLR2、TLR3、TLR4、TLR5和TLR8基因转录水平相对较高,在贵州白山羊、贵州黑山羊和波尔山羊均极显著高于其他TLRs基因转录水平。TLR3具有识别病原双链RNA的能力,云云和黄升海(2007)从转录水平证实TLR3基因显著上调表达受呼吸道合胞病毒感染的影响;TLR5是细菌鞭毛蛋白受体,家禽各组织中TLR5基因表达能促进机体针对病原菌的免疫反应(王琨等,2020);TLR7和TLR8能促进树突状细胞的分化与迁移,进而产生TNF-α、IFN-α和IL-2等炎性细胞因子(Crespo et al.,2013)。在黔北麻羊肺脏中TLR5和TLR8基因转录水平极显著高于其他4种羊,是否与黔北麻羊在抵抗细菌及产生炎性细胞因子方面具有优势尚有待进一步探究。
血液作为检测TLRs基因转录水平的样本具有易获得且对动物个体伤害小等优点,而肺脏是羊感染MO和Mmc后发生病变的主要器官。本研究以不同品种羊血液及肺脏为样本进行TLR1~TLR10基因转录水平差异检测,结果发现TLR2和TLR4基因在不同品种羊血液及肺脏中均有较高的转录水平,与Lanki等(2018)、石安惠和牟杰(2020)的研究结果一致,进一步证实TLR2和TLR4是免疫应答的重要调控因子,有助于机体抵抗病原菌侵染。可见,TLRs在不同品种羊机体中发挥着清除病原体及维持机体稳态的作用,为探究不同品种羊TLRs基因转录水平与羊疫病的相关性提供了重要的参考依据。
4 结论
不同品种羊血液和肺脏中TLRs基因转录水平具有差异性,以TLR2、TLR3、TLR4、TLR5和TLR8基因转录水平相对较高,提示TLRs在不同品种羊机体中发挥着清除病原体及维持机体稳态的作用,而TLRs基因转录水平差异可能是造成不同品种羊对疫病易感差异的原因之一。
参考文献:
陈其新,张建红,宋彦军,董济福. 2012. 我国主要肉羊品种肉用性能的初步评价[J]. 中国草食动物科学,(S1):357-362. [Chen Q X,Zhang J H,Song Y J,Dong J F. 2012. Preliminary evaluation of meat performance of main mutton sheep breeds in China[J]. China Herbivore Science,(S1):357-362.] doi:10.3969/j.issn.2095-3887.2012.z1. 132.
陈亚冰,兰道亮,林宝山,黄偲,黄勇,李键. 2014. 牦牛不同组织TLR3、TLR5 mRNA转录水平相对定量研究[J]. 生物技术通报,(8):89-93. [Chen Y B,Lan D L,Lin B S,Huang C,Huang Y,Li J. 2014. Relative quantification of mRNA transcription of TLR3 and TLR5 in different tissues of yak[J]. Biotechnology Bulletin,(8):89-93.] doi:10.13560/j.cnki.biotech.bull.1985.2014.08.009.
程晓薇,张丹阳,张杰,邵红霞,秦爱建,钱琨. 2017. 家禽beta-连环蛋白基因绝对定量PCR方法的建立及应用[J]. 中国兽医学报,37(10):1904-1909. [Cheng X W,Zhang D Y,Zhang J,Shao H X,Qin A J,Qian K. 2017. Establishment and application of an absolute quantification real-time PCR assay for detecting avain beta-catenin gene[J]. Chinese Journal of Veterinary Science,37(10):1904-1909.] doi:10.16303/j.cnki.1005-4545.2017.10.17.
樊庆德,徐春光,高明华. 2011. 绵羊三种支原体病免疫预防研究进展[J]. 动物医学进展,32(6):156-159. [Fan Q D,Xu C G,Gao M H. 2011. Progress on immunoprevention in three sheep mycoplasmosis[J]. Progress in Veterinary Medicine,32(6):156-159.] doi:10.3969/j.issn.1007-5038. 2011.06.037.
冯杰,崔燕,余四九,杜春林,夏先林,主性,王健. 2016. 贵州高海拔山区羊疫病血清学调查[J]. 贵州农业科学,44(6):103-107. [Feng J,Cui Y,Yu S J,Du C L,Xia X L,Zhu X,Wang J. 2016. Serological test of main goat epidemic diseases in high-elevation mountainous area in Guizhou[J]. Guizhou Agricultural Sciences,44(6):103-107.] doi:10.3969/j.issn.1001-3601.2016.06.028.
李鹏,王雅春. 2019. 猪Toll样受体研究进展[J]. 福建畜牧兽医,41(6):31-35. [Li P,Wang Y C. 2019. Research progress in porcine Toll-like receptors[J]. Journal of Animal Husbandry and Veterinary Medicine Fujian,41(6):31-35.] doi:10.3969/j.issn.1003-4331.2019.06.011.
刘彬,蔡惠芬,张依裕,刘若余,罗卫星. 2014. 贵州山羊品种DQA1基因第3外显子遗传变异分析[J]. 生物技术,24(4):13-16. [Liu B,Cai H F,Zhang Y Y,Liu R Y,Luo W X. 2014. Genetic variation in the second exon of DQA1 gene in the breeds of Guizhou local goats[J]. Biotechnology,24(4):13-16.] doi:10.3969/j.issn.1004-311X. 2014.04.0078.
刘洁,刘英,杨维民. 2020. TLR2/4、MYD88和NF-κB P65在支原体肺炎小鼠中的表达及其相关性[J]. 解剖学研究,42(5):442-445. [Liu J,Liu Y,Yang W M. 2020. Expression and correlation of TLR2/4,MYD88 and NF-kappa B P65 in mice with mycoplasma pneumonia[J]. Anatomy Research,42(5):442-445.] doi:10.3969/j.issn.1671-0770.2020.05.011.
陆珂静,侯林静,朱彬,施维,梁艺颖,黄维义,张为宇. 2019. 大片形吸虫感染及其分泌排泄产物对小鼠Toll样受体mRNA表达量的影响[J]. 中国寄生虫学与寄生蟲病杂志,37(3):272-278. [Lu K J,Hou L J,Zhu B,Shi W,Liang Y Y,Huang W Y,Zhang W Y. 2019. Effects of Fasciola gigantica infection and released excretorysecretory products on the mRNA expression of Toll-like receptors in mice[J]. Chinese Journal of Parasitology and Parasitic Diseases,37(3):272-278.] doi:10.12140/j.issn. 1000-7423.2019.03.006.
石安惠,牟杰. 2020. 重症肺炎患者外周血TLR2、TLR4表达情况及与炎症因子的关系[J]. 热带医学杂志,20(7):933-936. [Shi A H,Mou J. 2020. Analysis of expressions of TLR2 and TLR4 in peripheral blood of patients with severe pneumonia and their relationship with inflammatory factors[J]. Journal of Tropical Medicine,20(7):933-936.] doi:10.3969/j.issn.1672-3619.2020.07.017.
唐娜,孙政,高清龙,李卫真,杨忠. 2020. 牛Toll样受体的研究进展[J]. 上海畜牧兽医通讯,(6):14-16. [Tang N,Sun Z,Gao Q L,Li W Z,Yang Z. 2020. Progress of bovine Toll-like receptor[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine,(6):14-16.] doi:10.14170/ j.cnki.cn31-1278/s.2020.06.005.
陶岳,李新萍,剡根强,张孝恩,林为民. 2006. 新疆石河子地区湖羊传染性胸膜肺炎流行病学调查研究及预防控制效果的初步研究[J]. 中国畜牧兽医,33(2):62-65. [Tao Y,Li X P,Kui G Q,Zhang X E,Lin W M. 2006. Preli-minary study on epidemiological investigation and prevention and control effect of infectious pleuropneumonia in Hu sheep in Shihezi Area of Xinjiang[J]. China Animal Husbandry and Veterinary Medicine,33(2):62-65.] doi:10.3969/j.issn.1671-7236.2006.02.025.
王琨,季星妤,杨洁,姜森,朱建中. 2020. 家禽TLR5的研究进展[J]. 中国家禽,42(7):76-81. [Wang K,Ji X Y,Yang J,Jiang S,Zhu J Z. 2020. Research progress on poultry TLR5[J]. Chinese Poultry,42(7):76-81.] doi:10.16372/j.issn.1004- 6364.2020.07.015.
杨庆利,冷静. 2021. TLR2和TLR4信号在肿瘤发生和发展中的作用及机制的研究进展[J]. 中国免疫学杂志,37(3):382-384. [Yang Q L,Leng J. 2021. Research progress of TLR2 and TLR4 signaling in oncogenesis and development of tumors[J]. Chinese Journal of Immunology,37(3):382-384.] doi:10.3969/j.issn.1000-484X.2021.03. 022.
云云,黄升海. 2007. Toll样受体3介导呼吸道合胞病毒感染人肺上皮细胞的炎性反应及其信号转导通路[J]. 中国组织工程研究与临床康复,11(21):4119-4122. [Yun Y,Huang S H. 2007. Toll-like receptor 3 mediated respiratory syncytial virus inflammatory response on human lung epithelial cells and its signal transduction[J]. Journal of Clinical Rehabilitative Tissue Engineering Research,11(21):4119-4122.] doi:10.3321/j.issn:1673-8225.2007. 21.030.
赵飞,谭爱萍,孔璐璐,刘付翠,邓玉婷,潘厚军,张瑞泉,姜兰. 2019. 多子小瓜虫感染后草鱼TLR信号通路基因的表达动态[J]. 南方农业学报,50(9):1885-1892. [Zhao F,Tan A P,Kong L L,Liu F C,Deng Y T,Pan H J,Zhang R Q,Jiang L. 2019. The dynamics of gene expression profiles in toll-like receptor(TLR) signaling pathway of grass carp (Ctenopharyngodon idella) after infection with Ichthyophthirius multifiliis[J]. Journal of Sou-thern Agriculture,50(9):1885-1892.] doi:10.3969/j.issn. 2095-1191.2019.09.01.
趙明明,师清博,秦峻岭,王春凤,钱爱东. 2016. TLR4及其通路在结核感染免疫中的作用[J]. 中国兽医学报,36(10):1803-1808. [Zhao M M,Shi Q B,Qin J L,Wang C F,Qian A D. 2016. The role of TLR4 signaling pathway in anti-infection immunity to Mycobacterium tuberculosis[J]. Chinese Journal of Veterinary Science,36(10):1803-1808.] doi:10.16303/j.cnki.1005-4545.2016.10.30.
赵萍,贺英,储岳峰,高鹏程,张念章,赵海燕,逯忠新. 2010. 青海省山羊支原体山羊肺炎亚种抗体检测[J]. 安徽农业科学,38(35):20096. [Zhao P,He Y,Chu Y F,Gao P C,Zhang N Z,Zhao H Y,Lu Z X. 2010. Antibody detection on Mycoplasma capricolum subsp. Capripneumoniae in Qinghai Province[J]. Journal of Anhui Agricultural Sciences,38(35):20096.] doi:10.13989/j.cnki.0517-6611. 2010.35.154.
趙一萍,黄金龙,白东义,陈建兴,赵启南,芒来. 2012. 蒙古马不同组织器官TLR1、TLR2、TLR4和TLR6 mRNA转录水平研究[J]. 中国兽医学报,32(10):1542-1546. [Zhao Y P,Huang J L,Bai D Y,Chen J X,Zhao Q N,Mang L. 2012. mRNA expression of Toll-like receptors 1,2,4 and 6 in different tissues of Mongolia horse[J]. Chinese Journal of Veterinary Science,32(10):1542-1546.] doi:10. 16303/j.cnki.1005-4545.2012.10.025.
曾爽,景志忠,杨孝朴. 2015. 家畜Toll样受体的表达及在相关疾病发生中的作用[J]. 动物医学进展,36(4):104-108. [Zeng S,Jing Z Z,Yang X P. 2015. Expression of Toll-like receptors in domestic animals and effects in occurence of associated diseases[J]. Progress in Veterinary Medicine,36(4):104-108.] doi:10.16437/j.cnki.1007-5038.2015.04.024.
朱振洪,李金辉,万海同. 2011. 不同荧光定量PCR分析方法检测大鼠脑缺血再灌注损伤中Caspase-3基因的表达研究[J]. 激光生物学报,20(3):388-393. [Zhu Z H,Li J H,Wan H T. 2011. Studies on expression of Caspase-3 gene in rat cerebral ischemia-reperfusion injury by two different quantitation methods of real-time PCR[J]. Acta Laser Biology Sinica,20(3):388-393.] doi:10.3969/j.issn.1007-7146.2011.03.021.
Albiger B,Dahlberg S,Henriques-Normark B,Normark S. 2010. Role of the innate immune system in host defence against bacterial infections:Focus on the Toll-like receptors[J]. Journal of Internal Medicine,261(6):511-528. doi:10.1111/j.1365-2796.2007.01821.x.
Alvarez B,Revilla C,Chamorro S,López-Fraga M,Alonso F,Domíngguez J,Ezquerra A. 2006. Molecular cloning,characterization and tissue expression of porcine Toll-like receptor 4[J]. Developmental and Comparative Immuno-logy,30(4):345-355. doi:10.1016/j.dci.2005.06.020.
Barton G M,Medzhitov R. 2003. Toll-like receptor signaling pathways[J]. Science,300(5625):1524-1525. doi:10.1126/ science.1085536.
Crespo M I,Zacca E R,Núnez N G,Ranocchia R P,Maccioni M,Maletto B A,Pistoresi-Palencia M C,Morón G. 2013. TLR7 triggering with polyuridylic acid promotes cross-presentation in CD8α+ conventional dendritic cells by enhancing antigen preservation and MHC class I antigen permanence on the dendritic cell surface[J]. Journal of Immunology, 190(3):948-960. doi:10.4049/jimmunol.1102725.
Lanki M A,Seppänen H E,Mustonen H K,Böckelman C,Juuti A T,Hagström J K,Haglund C H. 2018. Toll-like receptor 2 and Toll-like receptor 4 predict favorable prognosis in local pancreatic cancer[J]. Tumor Biology,40(9):1010428318801188. doi:10.1177/1010428318801188.
Menzies M,Ingham A. 2006. Identification and expression of Toll-like receptors 1-10 in selected bovine and ovine tissues[J]. Veterinary Immunology and Immunopathology,109(1-2):23-30. doi:10.1016/j.vetimm.2005.06.014.
O'Neill L A J,Golenbock D,Bowie A G. 2013. The history of Toll-like receptors-redefining innate immunity[J]. Nature Reviews. Immunology,13(6):453-460. doi:10.1038/nri 3446.
Tirumurugaan K G,Dhanasekaran S,Raj G D,Raja A,Kumanan K,Ramaswamy V. 2010. Differential expression of Toll-like receptor mRNA in selected tissues of goat (Capra hircus)[J]. Veterinary Immunology and Immunopathology,133(2-4):296-301. doi:10.1016/j.vetimm.2009. 08.015.
Vidya M K,Kumar V G,Sejian V,Bagath M,Krishnan G,Bhatta R. 2018. Toll-like receptors:Significance,ligands,signaling pathways,and functions in mammals[J]. International Reviews of Immunology,37(1):20-36. doi:10. 1080/08830185. 2017.1380200.
Wassef A,Janardhan K,Pearce J W,Singh B. 2004. Toll-like receptor 4 in normal and inflamed lungs and other organs of pig,dog and cattle[J]. Histology and Histopathology,19(4):1201-1208. doi:10.14670/HH-19.1201.
收稿日期:2021-03-04
基金項目:国家自然科学基金项目(31660723,32060786);贵州省科技计划项目(黔科合基础〔2019〕1181号,黔科合支撑〔2018〕2271号)
通讯作者:张双翔(1987-),https://orcid.org/0000-0002-9117-9960,高级兽医师,主要从事动物疫病防控研究工作,E-mail:51379577@ qq.com;程振涛(1979-),https://orcid.org/0000-0002-6723-5344,博士,教授,主要从事动物病原学研究工作,E-mail:chengzhentao@sohu.com
第一作者:唐沙(1992-),https://orcid.org/0000-0001-7723-0574,研究方向为动物疫病防控,E-mail:670836771@qq.com
1027501186213

