鸡SPOP和MyD88基因分子特征及其组织表达特性分析
王燕碧 赵采芹 唐宏 周磊 韩一帆 张福平 段志强
摘要:【目的】掌握SPOP和MyD88基因分子特征及其在雞不同组织发育过程中的表达特征,为后续研究其调控鸡组织生长发育机理及开展抗病育种提供参考依据。【方法】通过RT-PCR克隆鸡SPOP和MyD88基因编码区(CDS)序列,运用ExPASy、SOPMA、SWISS-MODEL及PSORT II Prediction等在线软件进行生物信息学分析,并以实时荧光定量PCR检测这2个基因在鸡胚14胚龄(E14 d)及出壳后1 d(H1 d)、7 d(H7 d)和14 d(H14 d)各组织中的表达情况。【结果】鸡SPOP、MyD88基因CDS序列长为1125和900 bp,分别编码374和299个氨基酸残基。SPOP蛋白分子式为C1866H2926N496O559S28,相对分子量为42 kD,理论等电点(pI)为5.58,为相对不稳定蛋白;MyD88蛋白分子式为C1502H2394N410O438S18,相对分子量为33 kD,pI为5.93,为相对不稳定蛋白。鸡SPOP和MyD88蛋白二级结构以α-螺旋和无规则卷曲为主,主要定位于细胞质(占60.9%)。与人类和哺乳动物相比,鸡SPOP蛋白的3个功能结构域(MATH、BTB-POZ和BACK)较保守,而MyD88蛋白的2个功能结构域(Death和TIR)存在多处氨基酸位点变异。SPOP和MyD88基因在鸡不同发育阶段各组织中均有表达,但以肺脏中的相对表达量最高,且二者间的表达差异极显著(P<0.01,下同)。从E14 d发育至H14 d,SPOP基因在眼球和肺脏中的表达整体上呈上升趋势,且至H14 d时肺脏中的表达趋于稳定,在脑组织、心脏和肌胃中的表达呈先上升后下降的变化趋势,在肝脏中的表达呈先下降后上升再下降的变化趋势;MyD88基因在眼球、肝脏和肺脏中的表达均呈先上升后下降再上升的变化趋势,在肌胃和胸肌中的表达呈下降趋势,至H14 d时降至最低值。【结论】SPOP和MyD88基因在鸡胚不同发育阶段肺脏、眼球和肌胃中的表达相对较高,SPOP基因的表达水平均极显著高于MyD88基因,且二者的相对表达量呈负相关,即SPOP基因负调控MyD88基因的表达。
关键词: 鸡;SPOP基因;MyD88基因;分子特征;组织表达
中图分类号:S831.2 文献标志码: A 文章编号:2095-1191(2021)11-3111-10
Molecular characteristics and tissue expression analysis of the chicken genes SPOP and MyD88
WANG Yan-bi, ZHAO Cai-qin, TANG Hong, ZHOU Lei, HAN Yi-fan,
ZHANG Fu-ping, DUAN Zhi-qiang*
(College of Animal Sciences,Guizhou University/Key Laboratory of Animal Genetics, Breeding and Reproduction in the Plateau Mountains Region, Ministry of Education/Key Laboratory of Animal Genetics, Breeding and
Reproduction in Guizhou, Guiyang 550025, China)
Abstract:【Objective】To describe the molecular characteristics of SPOP and MyD88 genes and their expression in different tissue during chicken development, and lay the basis for the subsequent study of their regulation of tissue growth and development in chickens and the development of disease-resistance breeding. 【Method】The coding regions (CDS) of chicken SPOP and MyD88 genes were cloned by RT-PCR. ExPASy, SOPMA, SWISS-MODEL and PSORT II Prediction were used for bioinformatics analysis. Real-time quantitative PCR(qRT-PCR) technology was used to detect the expression of SPOP and MyD88 genes in various tissues at 14 embryonic days (E14 d) in chick embryos and at 1-day-old (H1 d), 7-day-old (H7 d), and 14-day-old (H14 d) after shelling. 【Result】The CDS sequences of chicken SPOP and MyD88 genes were 1125 and 900 bp, encoding 374 and 299 amino acid residues, respectively. The molecular formula of the SPOP protein was C1866H2926N496O559S28, and was predicted to have a molecular weight of 42 kD and a isoelectric point (pI) of 5.58. The molecular formula of the MyD88 protein was C1502H2394N410O438S18 and was predicted to have a molecular weight of 33 kD and a pI of 5.93. Both SPOP and MyD88 were relatively unstable proteins. The chicken SPOP and MyD88 proteins, were mainly located in the cytoplasm (60.9%) and their secondary structures mainly consisted of α -helixes and random loops. Compared with humans and mammals, the three functional domains of chicken SPOP (MATH, BTB-POz and BACK) were conserved, while the two functional domains of MyD88 (Death and TIR) had multiple amino acid site variations. SPOP and MyD88 genes were expressed in all tissues of chicken at different developmental stages, but their expression in the lung was relatively the highest. The differences in expression of SPOP and MyD88 was extremely significant(P<0.01, the same below). From E14 d to H14 d, the expression of SPOP gene in the eyeball and lung showed an overall upward trend, but the lung expression of SPOP stabilized before H14 d. The expression of SPOP gene in the brain, heart, stomach muscle and liver showed an upward trend followed by a downward trend. The expression of MyD88 gene in the eyeball, liver and lung was first increased, followed by a decrease and a further increase. The expression of MyD88 gene in stomach and chest muscles decreased and reached the lowest value at H14 d. 【Conclusion】The expression levels of SPOP and MyD88 genes are relatively high in lung, eyeball and stomach muscle of chicken embryo at different developmental stages. The expression levels of SPOP are extremely significantly higher than MyD88 and the relative expression levels of SPOP gene and MyD88 gene are negatively correlated, indicating that SPOP gene regulates the expression of MyD88 gene.
Key words: chicken; SPOP gene; MyD88 gene; molecular characteristics; tissue expression
Foundation item: National Natural Science Foundation of China(31960698,31760732);Science and Technology Foundation of Guizhou (Qiankehejichu〔2020〕1Y134);Joint Project of Local Poultry Industry in Guizhou (Qiancainong〔2020〕175)
0 引言
【研究意义】斑点型锌指结构蛋白(Speckle-type POZ protein,SPOP)最早发现于硬皮病患者血清中,因其在细胞核内呈斑点状分布且含有1个POZ结构域,因此也被称为斑点型POZ蛋白(Boysen et al.,2015)。髓系分化因子88(Myeloid differentiation factor 88,MyD88)是髓样分化蛋白家族中的重要成员之一,其主要生物学功能需通过其介导的信号传导途径来实现(Wheaton et al.,2007;赵飞等,2019;王菲,2020)。目前,关于SPOP和MyD88的非降解途径修饰调节分子机制已有研究报道(王菲,2020),并证实SPOP通过泛素化非降解途径修饰MyD88表达以抑制NF-κB信号通路,进而导致促炎性细胞因子产生。因此,开展SPOP和MyD88基因的分子特征及组织表达特性分析,可为后续研究SPOP和MyD88基因调控机体组织发育的作用机制打下基础。【前人研究进展】SPOP是一种表达于多种组织的E3泛素连接酶衔接蛋白,可影响底物蛋白生物学功能的发挥,直接或间接参与多种生物学过程(Hernández-Mu?oz et al.,2005),包括X染色体失活(Takahashi et al.,2002)、细胞信号转导(Geng et al.,2014)、骨骼和神经系统发育(Cai and Liu,2016;Nabais Sá et al.,2020)、基因转录和表达调控(Zhu et al.,2017)及DNA修复(Hjorth-Jensen et al.,2018)等。可见,SPOP在机体发育、信号转导及维持细胞稳态等过程中发挥重要作用。MyD88不仅在信号通路上起核心作用,还参与多种疾病的发生和发展过程,包括炎症和自身免疫性疾病(Casanova et al.,2011)、神经性疾病(Rocca et al.,2017)及代谢类疾病(Mahmassani et al.,2020)等。MyD88作为通用的信号衔接蛋白,调节大多数Toll样受体(TLR)和白细胞介素1受体(IL-1R)级联的信号转导,在机体先天免疫及获得性免疫的调节中发挥关键作用(Li et al.,2017)。因此,MyD88在先天免疫中介导许多生物学上重要的信号转导途径。已有研究发现,SPOP能泛素化修饰MyD88,促进MyD88进入蛋白酶体途径降解,从而调控紧急造血程序向稳态造血程序的转换,限制全身炎症反应;而SPOP突变后,MyD88无法正常降解,导致IRAK4激酶过多,异常激活MyD88-IRAK4下游的炎症反应因子NF-κB和AP-1,促进肿瘤细胞的侵袭与转移(Guillamot et al.,2019)。SPOP还充当TLR触发炎症的负调节因子,通过泛素化非降解途径修饰MyD88以调节其下游信号通路,触发天然免疫反应并启动下游信号通路,促进促炎细胞因子和I型干扰素的产生(Hu et al.,2020)。此外,SPOP过表达能破坏MyD88自我聚合,减少MyD88聚集及其下游IRAK激酶的募集,抑制NF-κB通路,降低TLR激活时炎症细胞因子的表达;SPOP缺失则促进MyD88聚集及其下游IRAK激酶的募集,增强TLR激活时炎症细胞因子的表达(林婷等,2021)。【本研究切入点】SPOP可负调控MyD88表达,且二者间的相互作用在机体先天性免疫方面发挥重要作用,但至今有关SPOP和MyD88基因在不同组织中的表达特性尚未清楚。【拟解决的关键问题】通过RT-PCR克隆鸡SPOP和MyD88基因,运用在线软件进行生物信息学分析,并以实时荧光定量PCR检测这2个基因在鸡生长发育过程不同组织中的表达情况,掌握其在鸡不同组织发育过程中的表达特征,为后续研究SPOP和MyD88基因调控鸡组织生长发育机理及开展抗病育种提供参考依据。
1 材料与方法
1. 1 试验材料
大肠杆菌(Escherichia coli)DH5α感受态细胞和鸡胚成纤维细胞系(DF-1)由高原山地动物遗传育种与繁殖教育部重点实验室保存提供。在相同孵化和饲养条件下,分别采集贵州黄鸡鸡胚(14胚龄)及出壳后1、7和14 d的眼球、脑组织、心脏、肝脏、肺脏、肌胃、胸肌及腿肌等组织样品,置于装有RNA保存液的EP管中,-80 ℃保存备用。Total RNA Kit II 200试剂盒及胶回收试剂盒购自OMEGA公司,Star-Script Ⅱ逆转录试剂盒购自GenStar公司,QuantiFast SYBR Green PCR Kit购自APE×BIO公司,DL5000 DNA Marker购自Thermo Fisher公司,2×Es Taq MasterMix购自北京康为世纪生物科技有限公司,pMD19-T载体及氨苄青霉素购自TaKaRa公司;其他试剂均为国产分析纯。
1. 2 引物设计与合成
根據GenBank已发布的鸡SPOP基因序列(XM_015299467.2)和MyD88基因序列(NM_001030962.4),利用Primer Premier 5.0分别设计扩增鸡SPOP和MyD88基因编码区(CDS)的引物(表1),并委托擎科生物技术有限公司合成。
1. 3 鸡SPOP和MyD88基因克隆与测序
利用Total RNA Kit II 200试剂盒提取DF-1细胞总RNA,以超微量紫外分光光度计测定其浓度及OD,然后取5 μg总RNA反转录合成cDNA第一链。以cDNA第一链为模板,PCR扩增目的基因(SPOP和MyD88)的CDS序列。扩增程序:94 ℃预变性5 min;94 ℃ 40 s,退火50 s,72 ℃ 1 min,进行25个循环;72 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后采用胶回收试剂盒回收琼脂糖凝胶上的目的条带,与pMD19-T载体连接(金属浴16 ℃,12 h)并转化DH5α感受态细胞,挑取白斑接种至含氨苄青霉素的LB液体培养基中,37 ℃下摇床(200 r/min)培养12~16 h,浑浊后进行菌液PCR鉴定,1.0%琼脂糖凝胶电泳检测正确的阳性菌液送至擎科生物技术有限公司测序。
1. 4 鸡SPOP和MyD88基因分子特征分析
利用NCBI分析鸡SPOP和MyD88基因开放阅读框(ORF),应用ExPASy(https://web.expasy.org/protparam/)预测鸡SPOP和MyD88基因编码蛋白理化性质,运用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/ npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)分别预测蛋白的二、三级结构,利用PSORT II Prediction(https://psort.hgc.jp/form2.html)对SPOP和MyD88蛋白进行亚细胞定位,以CDART预测鸡SPOP和MyD88蛋白功能结构域,同时比对分析不同物种间功能结构域的保守性。
1. 5 实时荧光定量PCR检测
在荧光定量PCR仪上采用SYBR Green荧光染料法进行实时荧光定量PCR检测。反应体系20.0 μL:2×SYBR Green qPCR MasterMix 10.0 μL,上、下游引物各0.5 μL,DNA模板0.5 μL,ddH2O 8.1 μL。扩增程序:95 ℃预变性2 min;95 ℃ 15 s,退火30 s,经39个循环后进行融解曲线分析,以5 s增加0.5 ℃扩增至95 ℃,每个样品检测设3个重复。
1. 6 统计分析
采用Excel 2016对试验数据进行整理,通过2-ΔΔCt法换算目的基因相对表达量,并以SPSS 19.0进行配对样本 t 检验。
2 结果与分析
2. 1 鸡SPOP和MyD88基因扩增结果
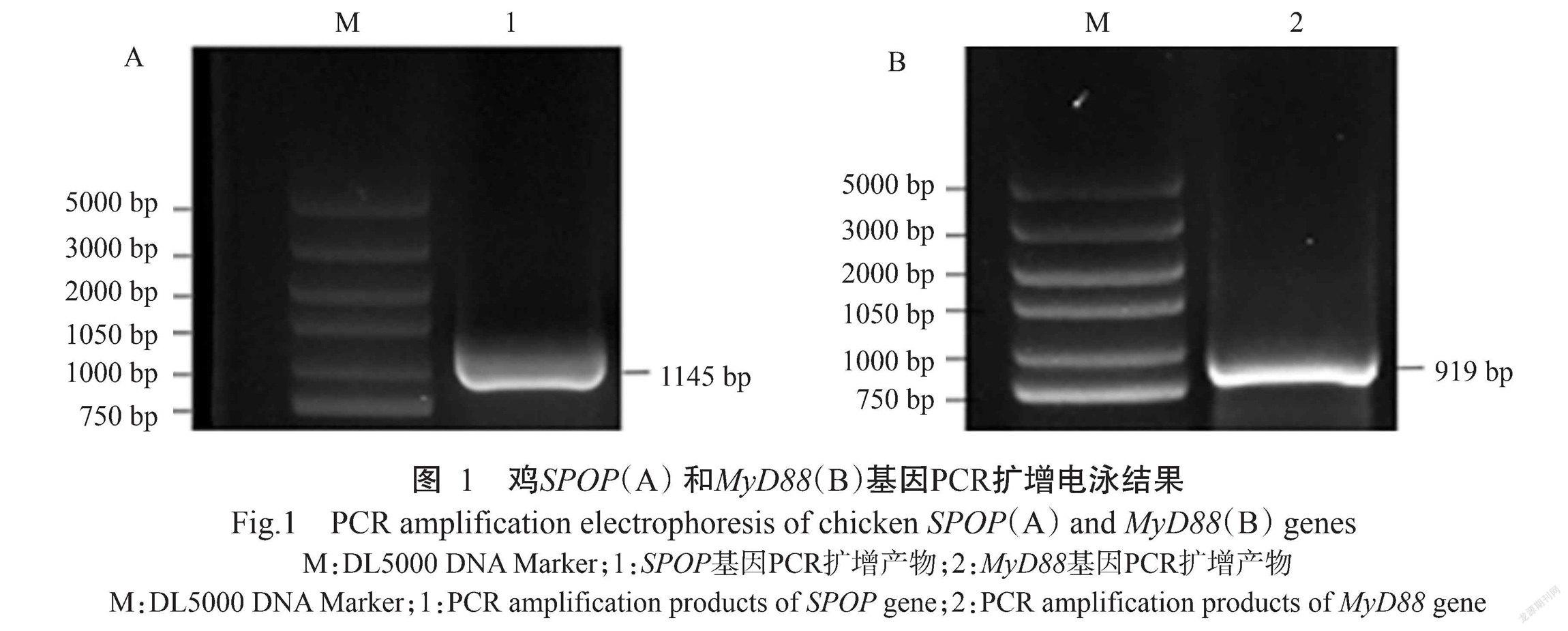
以反转录合成的cDNA第一链为模板,对鸡SPOP和MyD88基因CDS序列进行PCR扩增,经1.0%琼脂糖凝胶电泳检测,扩增获得的目的基因条带清晰单一,其中,SPOP基因条带(图1-A)为1145 bp,MyD88基因条带(图1-B)为919 bp,与预期结果相符。
2. 2 鸡SPOP和MyD88基因测序分析结果
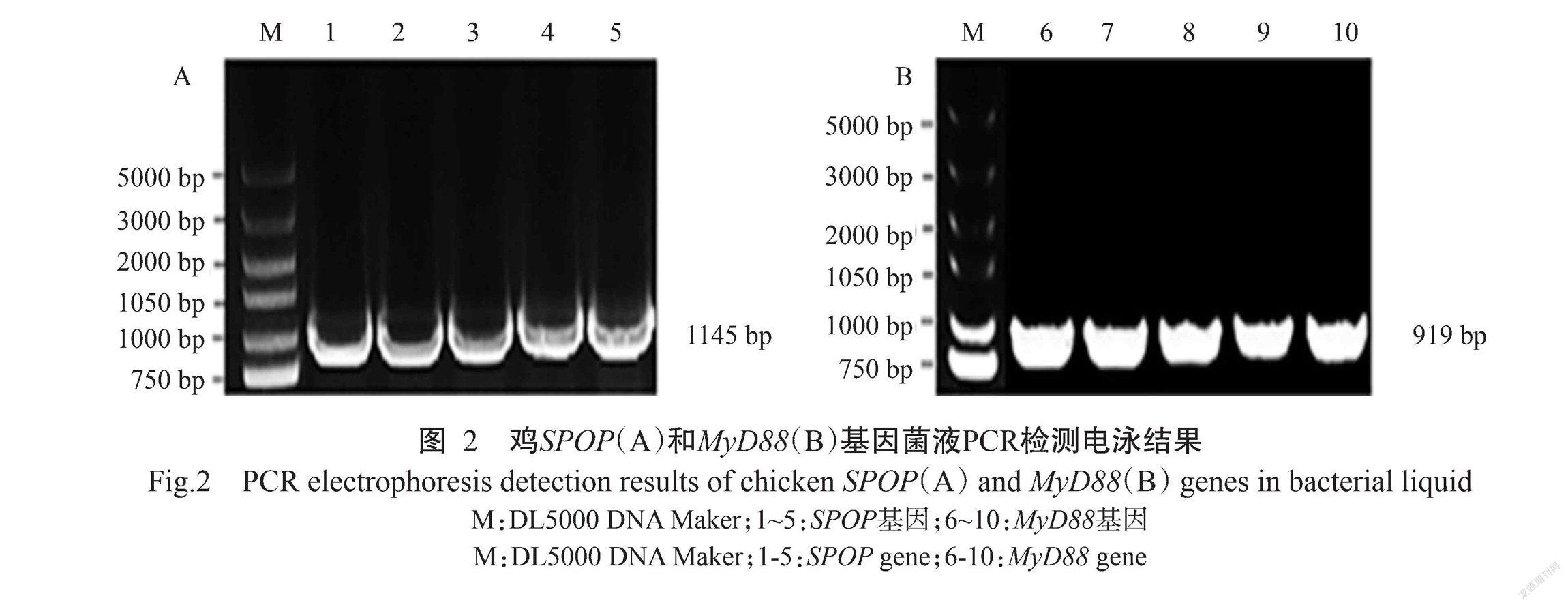
经DNAStar序列拼接分析,结果显示扩增获得的SPOP基因(图2-A)和MyD88基因(图2-B)CDS序列与GenBank已公布的相应基因序列一致,尚未发生核苷酸序列突变,表明鸡SPOP和MyD88基因的重组质粒pMD19-T-SPOP和pMD19-T-MyD88构建成功。
2. 3 鸡SPOP和MyD88基因生物信息学分析结果
2. 3. 1 编码蛋白理化性质 鸡SPOP基因CDS序列长1125 bp,共编码374个氨基酸残基;EsPASy预测结果显示,SPOP蛋白分子式为C1866H2926N496O559S28,相对分子量为42 kD,理论等电点(pI)为5.58;该蛋白中亮氨酸(Leu)含量最高,占9.4%,色氨酸(Trp)和组氨酸(His)含量最低,均占1.6%;SPOP蛋白不稳定性指数为41.66,提示其可能为相对不稳定蛋白。MyD88基因CDS序列长900 bp,共编码299个氨基酸残基,其分子式为C1502H2394N410O438S18,相对分子量为33 kD,pI为5.93;该蛋白中也是以Leu含量最高,占13.0%,而天冬氨酸(Asn)和His含量最低,各占1.3%;MyD88蛋白不稳定性指数为50.55,推测其为相对不稳定蛋白。
2. 3. 2 蛋白二、三级结构预测结果 运用SOMPA和SWISS-MODEL分别对鸡SPOP和MyD88蛋白进行二、三级结构预测,结果显示:SPOP蛋白二级结构中α-螺旋占45.99%、无规卷曲占36.90%、延伸链占13.10%、β-转角占4.01%;MyD88蛋白二级结构中无规卷曲占43.81%、α-螺旋占41.14%、延伸链占12.04%、β-转角占3.01%。可见,鸡SPOP和MyD88蛋白二级结构主要是α-螺旋和无规卷曲,β-转角所占比例最低。鸡SPOP蛋白三级结构(图3-A)和MyD88蛋白三级结构(图3-B)与其二级结构预测结果相符,均以无规卷曲和α-螺旋为主。
2. 3. 3 亚细胞定位分析结果 采用PSORT II Prediction对鸡SPOP和MyD88蛋白进行亚细胞定位分析,结果表明,SPOP蛋白主要定位于细胞质,占60.9%,定位于细胞核、线粒体的分别占13.0%和8.7%;MyD88蛋白也主要定位于细胞质(占60.9%),其次是细胞核(占13.0%),定位于液泡、线粒体和高尔基体的各占4.3%。
2. 3. 4 蛋白功能结构域预测结果 采用CDART对鸡SPOP和MyD88蛋白功能結构域进行预测,结果发现,SPOP蛋白存在MATH、BTB-POZ和BACK结构域,分别位于第28~166位、第182~301位和第297~367位氨基酸处(图4-A);而MyD88蛋白主要存在Death和TIR结构域,分别位于第31~110位和第163~296位氨基酸处(图4-B)。
通过MegAlign比对鸡、人类、小鼠和猪4个物种的SPOP和MyD88氨基酸序列,结果(图5)发现,鸡SPOP蛋白3个功能结构域中仅BACK结构域出现1个氨基酸突变位点(333L→M),说明SPOP蛋白在不同物种中高度保守;而鸡MyD88蛋白的2个功能结构域中存在多处氨基酸突变,其保守性远低于SPOP蛋白。
2. 4 鸡SPOP和MyD88基因的组织表达特征
以实时荧光定量PCR检测SPOP和MyD88基因在鸡不同发育阶段各组织中的表达规律,结果(图6)显示,以腿肌为目标对照,在鸡胚14胚龄(E14 d)及出壳后1 d(H1 d)、7 d(H7 d)和14 d(H14 d)各组织中均能检测到SPOP和MyD88基因表达,且以在肺脏中的相对表达量最高,二者间的表达差异极显著(P<0.01,下同)。在E14 d各组织中,SPOP和MyD88基因在脑组织中的相对表达量最低,二者差异显著(P<0.05,下同);SPOP基因组织相对表达量排序为:肺脏>肌胃>眼球>胸肌>肝脏>腿肌>心脏>脑组织,MyD88基因组织相对表达量排序为:肺脏>心脏>肌胃>腿肌>胸肌>肝脏>眼球>脑组织。在H1 d各组织中,也是以脑组织中的SPOP和MyD88基因相对表达量最低,其次是眼球和肌胃;SPOP基因组织相对表达量排序为:肺脏>肌胃>眼球>心脏>腿肌>胸肌>肝脏>脑组织,MyD88基因组织相对表达量排序为:肺脏>眼球>肌胃>肝脏>腿肌>心脏>胸肌>脑组织。在H7 d各组织中,SPOP和MyD88基因在胸肌中的相对表达量最低,二者差异不显著(P>0.05,下同);SPOP基因组织相对表达量排序为:肺脏>肌胃>眼球>脑组织>肝脏>心脏>腿肌>胸肌,MyD88基因组织相对表达量排序为:肺脏>腿肌>眼球>肌胃>心脏>肝脏>脑组织>胸肌。在H14 d各组织中,SPOP基因组织相对表达量排序为:肺脏>眼球>脑组织>肌胃>胸肌>腿肌>心脏>肝脏,MyD88基因组织相对表达量排序为:肺脏>心脏>眼球>肝脏>腿肌>肌胃>脑组织>胸肌。
对SPOP和MyD88基因在鸡不同发育阶段各组织中的表达规律进行分析,结果(图7)表明,从E14 d发育到H14 d,SPOP基因在眼球和肺脏中的表达整体上呈上升趋势,且至H14 d肺脏中的表达趋于稳定;在脑组织、心脏和肌胃中的表达呈先上升后下降的变化趋势;在肝脏中的表达呈先下降后上升再下降的变化趋势,至H14 d时降至最低值。MyD88基因在眼球、肝脏和肺脏中的表达均呈先上升后下降再上升的变化趋势,整体上呈N形表达模式;在肌胃和胸肌中的表达呈下降趋势,至H14 d时降至最低值。
3 讨论
最先在以鸡为模式动物中发现SPOP与先天免疫通路接头蛋白MyD88存在蛋白互作关系,随后进一步拓展至人类和小鼠等模式动物细胞,发现SPOP和MyD88互作在物种间高度保守,并证实SPOP基因在鸡等多个物种中通过蛋白酶体途径负调控TLRs先天免疫通路活性及白细胞介素-1β等炎性细胞因子产生(Li et al.,2020)。Jin等(2020)通過研究SPOP与MyD88的互作机制,发现在淋巴瘤中SPOP通过非降解型泛素化修饰MyD88。近年来,关于MyD88介导的MyD88/NF-κB信号通路研究报道越来越多,包括TLR4/MyD88/NF-κB、Nrf2/TLR4/MyD88、TLR4/MyD88/MEK/ERK/mTORC1等(Ma et al.,2020;Wu et al.,2020;Yang et al.,2020)。此外,SPOP通过抑制MyD88/NF-κB信号,进而抑制DLBCL细胞体外生长及体内肿瘤异种移植(Jin et al.,2020)。Hu等(2020)研究报道,SPOP参与TLR介导的信号转导,通过泛素化非降解途径修饰MyD88调节其下游信号通路,进而对TLR引发的炎症起负调节作用。值得注意的是,SPOP在这些信号通路的上游发挥作用,通过k48介导的泛素化特异性靶向MyD88关闭炎症反应。
目前,针对SPOP的研究主要集中在与癌症发生间的关系方面,尤其是前列腺癌和肾癌。最近有研究报道,SPOP的MATH结构域介导其与MyD88互作,通过互作关系促进MyD88泛素化和降解,且这种调控机制在鸟类和哺乳动物中高度保守(王菲,2020)。本研究通过对SPOP和MyD88蛋白的功能结构域进行预测,结果发现SPOP蛋白存在MATH、BTB-POZ和BACK等3个功能结构域,MyD88蛋白存在Death和TIR结构域。其中,MATH结构域含有结合12个底物氨基酸的卡槽,可结合不同蛋白的SPOP结合保守结构域(SPOP-binding consensus motif,SBC motif),从而决定其与底物的亲和力及特异性(Zhuang et al.,2009);SPOP通过高度保守的BTB-POZ结构域与Cullin 3-RING连接酶复合物结合,还能促进SPOP二聚体的形成(El-Gebali et al.,2019);TIR结构域则介导MyD88与含该结构域的其他蛋白互作。SPOP和MyD88蛋白氨基酸位点变异分析结果表明,SPOP蛋白在不同物种中高度保守;而MyD88蛋白存在一定程度的变异,其保守性远低于SPOP蛋白,但在这些序列中存在符合SBC的特点序列,且位于MyD88蛋白的INT结构域。Li等(2020)研究发现,鸡MyD88通过其INT结构域与SPOP互作,故推测是这些变异位点介导了二者的互作关系,与Reiling等(2008)的研究结论相吻合。
基因组织表达谱分析对开展基因表达、蛋白分泌、基因作用靶组织、受体表达及功能部位研究具有重要意义。已有研究表明,SPOP基因在人体肾癌、子宫及子宫内膜癌及睾丸癌组织中具有较高的阳性表达率(陈硕,2018);MyD88基因的表达分布非常广泛,在肝脏、肺脏和脾脏中的表达量较高,在脑、骨骼肌、肾脏、心脏、肠道、皮肤和睾丸等组织均有表达,但表达量相对较低(匡文华,2012;王荣华等,2016)。本研究结果表明,SPOP和MyD88基因在鸡不同发育阶段各组织中均有不同程度的表达,但其相对表达量存在明显差异,与Hardiman等(1997)、李强等(2009)、匡文华(2012)的研究结果相同,在不同发育阶段组织中均以肺脏中的相对表达量最高,且2个基因的表达差异极显著,提示SPOP和MyD88基因可能主要由鸡肺脏合成,与罗洁(2018)、赵陆璐等(2020)的研究结果一致。此外,有新的研究表明SPOP基因在不同肺癌细胞系中广泛表达。在肺癌细胞中,由shRNA敲除SPOP基因能导致DNA损伤修复缺陷,增加细胞凋亡和在DNA损伤条件下对辐射的敏感性(Song et al.,2020)。在本研究中,从E14 d发育至H14 d,鸡SPOP和MyD88基因在眼球、肺脏及肌胃中的相对表达量差异均达极显著水平,SPOP基因在各组织中高表达,而MyD88基因呈低表达,二者的相对表达量呈负相关,即SPOP基因负调控MyD88基因的表达。王菲(2020)研究表明,SPOP通过与MyD88互作可促进后者的降解,从而负调控MyD88基因表达,当SPOP基因高表达时,免疫因子的表达和载菌量较低,说明SPOP对机体免疫保护起负调控作用。白细胞介素-1β和白细胞介素-8是MyD88下游的2种促炎细胞因子,与SPOP基因表达呈负相关(Lee et al.,2011),故推测SPOP参与免疫反应调节。SPOP基因在不同组织中广泛表达,且在不同组织中的表达水平存在一定差异(Zhang et al.,2019)。在外源病原微生物的刺激下,MyD88基因表达上调,且在先天免疫中发挥重要作用(Yao et al.,2009)。说明SPOP通过阻断MyD88组装及抑制NF-κB信号通路而干扰免疫反应(Li et al.,2020)。因此,本研究结论为揭示SPOP和MyD88基因参与鸡肺脏发育机制及其抵抗呼吸道微生物感染作用打下了理论基础。
4 结论
SPOP和MyD88基因在雞胚不同发育阶段肺脏、眼球和肌胃中的表达相对较高,SPOP基因的表达水平均极显著高于MyD88基因,且二者的相对表达量呈负相关,即SPOP基因负调控MyD88基因的表达。
参考文献:
陈硕. 2018. 结直肠癌中SPOP的表达及临床意义[D]. 南昌:南昌大学. [Chen S. 2018. Expression and clinical signifi-cance of SPOP in colorectal cancer[D]. Nanchang:Nanchang University.]
匡文华. 2012. pEGFP-Cl-MyD88真核表达载体的构建及其在HEK293细胞中的表达[D]. 武汉:华中师范大学. [Kuang W H. 2012. Construction of eukaryotic expression vector pEGFP-Cl-MyD88 and its expression in HEK293 cells[D]. Wuhan:Central China Normal University.] doi:10. 7666/d.y2079617.
李强,李学伟,朱砺,陈磊,李明洲. 2009. 猪MyD88基因的克隆及组织表达谱分析[J]. 畜牧兽医学报,40(10):1429-1434. [Li Q,Li X W,Zhu L,Chen L,Li M Z. 2009. Molecular cloning and tissue specific expression profile of porcine MyD88 gene[J]. Acta Veterinaria et Zootechnica Sinica,40(10):1429-1434.] doi:10.3321/j.issn:0366-6964. 2009.10.001.
林婷,曹心怡,金晓锋. 2021. E3泛素连接酶接头蛋白SPOP介导的底物非降解型泛素化修饰[J]. 中国生物化学与分子生物学报,37(7):874-882. [Lin T,Cao X Y,Jin X F. 2021. SPOP-mediated non-degradative ubiquitination[J]. Chinese Journal of Biochemistry and Molecular Biology,37(7):874-882.] doi:10.13865/j.cnki.cjbmb.2020.11. 1488.
罗洁. 2018. SPOP介导SIRT2与FADD降解对非小细胞肺癌的作用及其机制研究[D]. 苏州:苏州大学. [Luo J. 2018. The role of SPOP induce SIRT2 and FADD degradation non-small lung cancer and the mechanism involved in[D]. Suzhou:Soochow University.] doi:10.27351/d.cnki.gszhu.2018.000073.
王菲. 2020. SPOP通过降解MyD88负反馈调节先天免疫的分子机制[D]. 北京:中国农业科学院. [Wang F. 2020. SPOP promotes degradation of MyD88 to suppress the innate immune response[D]. Beijing:Chinese Academy of Agricultural Sciences.] doi:10.27630/d.cnki.gznky.2020. 000009.
王荣华,李伟,肖调义,刘巧林,金生振,周智愚. 2016. 赤眼鳟MyD88基因cDNA克隆与表达特性研究[J]. 水生生物学报,40(3):459-466. [Wang R H,Li W,Xiao T Y,Liu Q L,Jin S Z,Zhou Z Y. 2016. Molecular cloning,characte-rization and expression of MyD88 in squaliobarbus curri-culus[J]. Acta Hydrobiologica Sinica,40(3):459-466.] doi:10.7541/2016.61.
赵飞,谭爱萍,孔璐璐,刘付翠,邓玉婷,潘厚军,张瑞泉,姜兰. 2019. 多子小瓜虫感染后草鱼TLR信号通路基因的表达动态[J]. 南方农业学报,50(9):1885-1892. [Zhao F,Tan A P,Kong L L,Liu F C,Deng Y T,Pan H J,Zhang R Q,Jiang L. 2019. The dynamics of gene expression profiles in toll-like receptor(TLR) signaling pathway of grass carp (Ctenopharyngodon idella) after infection with Ichthyophthirius multifiliis[J]. Journal of Sou-thern Agriculture,50(9):1885-1892.] doi:10.3969/j.issn. 2095-1191.2019.09.01.
趙陆璐,曲芳萱,陈克研,吴腾飞. 2020. 表没食子儿茶素没食子酸酯通过TLR4/Myd88信号通路改善失血性休克大鼠肺脏损伤[J]. 解剖科学进展,26(3):343-346. [Zhao L L,Qu F X,Chen K Y,Wu T F. 2020. Epigallocatechin gallat improves lung injury in hemorrhagic shock rats via TLR4/Myd88 signaling pathway[J]. Progress of Anatomi-cal Sciences, 26(3):343-346.] doi:10.16695/j.cnki.1006-2947.2020.03.027.
Boysen G,Barbieri C E,Prandi D,Blattner M,Chae S S,Dahija A,Nataraj S,Huang D,Marotz C,Xu L M,Huang J L,Lecca P,Chhangawala S,Liu D L,Zhou P B,Sboner A,de Bono J S,Demichelis F,Houvras Y,Rubin M A. 2015. SPOP mutation leads to genomic instability in prostate cancer[J]. eLife,4:e09207. doi:10.7554/eLife.09207.
Cai H C,Liu A M. 2016. Spop promotes skeletal development and homeostasis by positively regulating Ihh signa-ling[J]. Proceedings of the National Academy of Sciences of the United States of America,113(51):14751-14756. doi:10.1073/pnas.1612520114.
Casanova J L,Abel L,Quintana-Murci L. 2011. Human TLRs and IL-1Rs in host defense:Natural insights from evolutionary,epidemiological,and clinical genetics[J]. Annual Review of Immunology,29:447-491. doi:10.1146/annurev-immunol-030409-101335.
El-Gebali S,Mistry J,Bateman A,Eddy S R,Luciani A,Potter S C,Qureshi M,Richardson L J,Salazar G A,Smart A,Sonnhammer E L L,Hirsh L,Paladin L,Piovesan D,Tosatto S C E,Finn R D. 2019. The Pfam protein families database in 2019[J]. Nucleic Acids Research,47(D1):D427-D432. doi:10.1093/nar/gky995.
Geng C D,Rajapakshe K,Shah S S,Shou J,Eedunuri V K,Foley C,Fiskus W,Rajendran M,Chew S A,Zimmermann M,Bond R,He B,Coarfa C,Mitsiades N. 2014. Androgen receptor is the key transcriptional mediator of the tumor suppressor SPOP in prostate cancer[J]. Cancer Research,74(19):5631-5643. doi:10.1158/0008-5472.CAN-14-0476.
Guillamot M,Ouazia D,Dolgalev I,Yeung S T,Kourtis N,Dai Y L,Corrigan K,Zea-Redondo L,Saraf A,Florens L,Washburn M P,Tikhonova A N,Malumbres M,Gong Y X,Tsirigos A,Park C,Barbieri C,Khanna K M,Busino L,Aifantis I. 2019. The E3 ubiquitin ligase SPOP controls resolution of systemic inflammation by triggering MYD88 degradation[J]. Nature Immunology,20(9):1196-1207. doi:10.1038/s41590-019-0454-6.
Hardiman G,Jenkins N A,Copeland N G,Gilbert D J,Garcia D K,Naylor S L,Kastelein R A,Bazan J F. 1997. Gene-tic structure and chromosomal mapping of MyD88[J]. Genomics,45(2):332-339. doi:10.1006/geno.1997.4940.
Hernández-Mu?oz I,Lund A H,van der Stoop P,Boutsma E,Muijrers I,Verhoeven E,Nusinow D A,Panning B,Marahrens Y,van Lohuizen M. 2005. Stable X chromosome inactivation involves the PRC1 Polycomb complex and requires histone MACROH2A1 and the CULLIN3/SPOP ubiquitin E3 ligase[J]. Proceedings of the Natio-nal Academy of Sciences of the United States of America,102(21):7635-7640. doi:10.1073/pnas.0408918102.
Hjorth-Jensen K,Maya-Mendoza A,Dalgaard N,Sigur?sson J O,Bartek J,Iglesias-Gato D,Olsen J V,Flores-Morales A. 2018. SPOP promotes transcriptional expression of DNA repair and replication factors to prevent replication stress and genomic instability[J]. Nucleic Acids Research,46(18):9484-9495. doi:10.1093/nar/gky719.
Hu Y H,Wang Y,Wang F,Dong Y M,Jiang W L,Wang Y P,Zhong X,Ma L X. 2020. SPOP negatively regulates toll-like receptor-induced inflammation by disrupting MyD88 self-association[J]. Cellular & Molecular Immunology,18(7):1708-1717. doi:10.1038/s41423-020-0411-1.
Jin X F,Shi Q,Li Q,Zhou L Y,Wang J,Jiang L,Zhao X Y,Feng K,Lin T,Lin Z H,Zhuang H,Yang J Y,Hu C K,Zhang L Y,Shen L L,Lu Y,Zhu J,Wang H B,Qi H G,Meng X D,Xi Y,Pan J C,Fang S,Tian H H,Zhou C W,Zhang P Z,Gao K,Zhao S M,Li Y,Gong Z H,Wang C J. 2020. CRL3-SPOP ubiquitin ligase complex suppres-ses the growth of diffuse large B-cell lymphoma by negatively regulating the MyD88/NF-κB signaling[J]. Leukemia,34(5):1305-1314. doi:10.1038/s41375-019-0661-z.
Lee Y S,Park J S,Kim J H,Jung S M,Lee J Y,Kim S J,Park S H 2011. Smad6-specific recruitment of Smurf E3 ligases mediates TGF-β1-induced degradation of MyD88 in TLR4 signalling[J]. Nature Communications,2:460. doi:10.1038/ncomms1469.
Li Q H,Wang F,Wang Q,Zhang N,Zheng J M,Zheng M Q,Liu R R,Cui H X,Wen J,Zhao G P. 2020. SPOP promotes ubiquitination and degradation of MyD88 to suppress the innate immune response[J]. PLoS Pathogens,16(5):e1008188. doi:10.1371/journal.ppat.1008188.
Li X C,Zhang P,Jiang X S,Du H R,Yang C W,Zhang Z R,Men S,Zhang Z K,Jiang W,Wang H N. 2017. Differen-ces in expression of genes in the MyD88 and TRIF signalling pathways and methylation of TLR4 and TRIF in Tibetan chickens and DaHeng S03 chickens infected with Salmonella enterica serovar enteritidis[J]. Veterinary Immunology and Immunopathology,189:28-35. doi:10.1016/ j.vetimm.2017.05.003.
Ma J Q,Zhang Y J,Tian Z K,Liu C M. 2020. Bixin attenuates carbon tetrachloride induced oxidative stress,inflammation and fibrosis in kidney by regulating the Nrf2/TLR4/MyD88 and PPAR-γ/TGF-β1/Smad3 pathway[J]. International Immunopharmacology,90:107117. doi:10. 1016/j.intimp.2020.107117.
Mahmassani Z S,Reidy P T,McKenzie A I,Petrocelli J J,Matthews O,de Hart N M,Ferrara P J,O'Connell R M,Funai K,Drummond M J. 2020. Absence of MyD88 from skeletal muscle protects female mice from inactivity-induced adiposity and insulin resistance[J]. Obesity (Silver Spring),28(4):772-782. doi:10.1002/oby.22759.
Nabais Sá M J,El Tekle G,de Brouwer A P M,Sawyer S L,Del Gaudio D,Parker M J,Kanani F,van den Boogaard M J H,van Gassen K,van Allen M I,Wierenga K,Purcarin G,Elias E R,Begtrup A,Keller-Ramey J,Bernasocchi T,van de Wiel L,Gilissen C,Venselaar H,Pfundt R,Vis-sers L E L M,Theurillat J P P,de Vries B B A. 2020. De novo variants in SPOP cause two clinically distinct neurodevelopmental disorders[J]. American Journal of Human Genetics,106(3):405-411. doi:10.1016/j.ajhg.2020. 02.001.
Reiling N,Ehlers S,H?lscher C. 2008. MyDths and un-TOLLed truths:Sensor,instructive and effector immunity to tuberculosis[J]. Immunology Letters,116(1):15-23. doi:10.1016/j.imlet.2007.11.015.
Rocca M A,Battaglini M,Benedict R H B,de Stefano N,Geurts J J G,Henry R G,Horsfield M A,Jenkinson M,Pagani E,Filippi M. 2017. Brain MRI atrophy quantification in MS:From methods to clinical application[J]. Neurology,88(4):403-413. doi:10.1212/WNL.000000000000 3542.
Song Y Z,Xu Y C,Pan C Y,Yan L Z,Wang Z W,Zhu X Q. 2020. The emerging role of SPOP protein in tumorigenesis and cancer therapy[J]. Molecular Cancer,19(1):2. doi:10.1186/s12943-019-1124-x.
Takahashi I,Kameoka Y,Hashimoto K. 2002. MacroH2A1.2 binds the nuclear protein Spop[J]. Biochimica et Biophysica Acta,1591(1-3):63-68. doi:10.1016/s0167-4889(02)00249-5.
Wheaton S,Lambourne M D,Sarson A J,Brisbin J T,Mayameei A,Sharif S. 2007. Molecular cloning and expression analysis of chicken MyD88 and TRIF genes[J]. DNA Sequence,18(6):480-486. doi:10.1080/10425170701295856.
Wu L C,Du L L,Ju Q Q,Chen Z H,Ma Y,Bai T,Ji G Q,Wu Y,Liu Z G,Shao Y X,Peng X Q. 2020. Silencing TLR4/MyD88/NF-κB signaling pathway alleviated inflammation of corneal epithelial cells infected by ISE[J]. Inflammation,44(2):633-644. doi:10.1007/s10753-020-01363-1.
Yang J H,Liu H,Han S,Fu Z R,Wang J Y,Chen Y,Wang L M. 2020. Melatonin pretreatment alleviates renal ische-mia-reperfusion injury by promoting autophagic flux via TLR4/MyD88/MEK/ERK/mTORC1 signaling[J]. FASEB Journal,34(9):12324-12337. doi:10.1096/fj.202001252R.
Yao C L,Kong P,Wang Z Y,Ji P F,Liu X D,Cai M Y,Han X Z. 2009. Molecular cloning and expression of MyD88 in large yellow croaker,Pseudosciaena crocea[J]. Fish & Shellfish Immunology,26(2) :249-255. doi:10.1016/j.fsi.2008.10.014.
Zhang J F,Chen M,Zhu Y S,Dai X P,Dang F B,Ren J M,Ren S C,Shulga Y V,Beca F,Gan W J,Wu F,Lin Y M,Zhou X B,DeCaprio J A,Beck A H,Lu K P,Huang J T,Zhao C,Sun Y H,Gao X,Pandolfi P P,Wei W Y. 2019. SPOP promotes nanog destruction to suppress stem cell traits and prostate cancer progression[J]. Developmental Cell,48(3):329-344. doi:10.1016/j.devcel.2018.11.035.
Zhu K,Lei P J,Ju L G,Wang X,Huang K,Yang B,Shao C W,Zhu Y,Wei G,Fu X D,Li L Y,Wu M. 2017. SPOP-containing complex regulates SETD2 stability and H3K36-me3-coupled alternative splicing[J]. Nucleic Acids Resea-rch,45(1):92-105. doi:10.1093/nar/gkw814.
Zhuang M,Calabrese M F,Liu J,Waddell M B,Nourse A,Hammel M,Miller D J,Walden H,Duda D M,Seyedin S N,Hoggard T,Harper J W,White K P,Schulman B A. 2009. Structures of SPOP-substrate complexes:Insights into molecular architectures of BTB-Cul3 ubiquitin ligases[J]. Molecular Cell,36(1):39-50. doi:10.1016/j.molcel. 2009.09.022.
收稿日期:2020-12-29
基金項目:国家自然科学基金项目(31960698,31760732);贵州省科学技术基金项目(黔科合基础〔2020〕1Y134号);贵州省地方家禽产业联合攻关项目(黔财农〔2020〕175号)
通讯作者:段志强(1985-),https://orcid.org/0000-0002-0033-3919,博士,副教授,主要从事家禽抗病育种与疫病防控研究工作,E-mail:zqduan@gzu.edu.cn
第一作者:王燕碧(1994-),https://orcid.org/0000-0002-1172-2311,研究方向为动物遗传育种与繁殖,E-mail:1194591651@qq.com

