IL-10 rs1800896位点基因多态性与吸烟的交互作用对肺结核发病的影响
罗 芳,赖石凤,陈 悦,罗 丹,彭文慧,汪保国,刘 维
0 引 言
结核病是由结核分枝杆菌(mycobacterium tuberculosis,MTB)感染引起的通过呼吸道传播的慢性传染病[1]。2016年全球估算有1040万例新发结核病患者,约有170万人死于结核病[2]。而我国每年发病患者约为90万例,位居全球第三位,且随着异烟肼耐药结核菌的增加,肺结核患者治疗难度加大,中国仍然是全球30个结核病高负担国家之一[3-4]。感染结核杆菌者仅有5%~15%发展成为结核病患者[5],提示肺结核的发病不仅与环境因素相关,还与机体免疫能力相关。T细胞介导的细胞免疫应答,是机体抗结核分枝杆菌最重要的免疫因素之一,Th1和Th2型效应细胞可分泌多种细胞因子,白细胞介素-10(Interleukin-10,IL-10)则为其中一种[6]。IL-10的高度表达可抑制细胞介导的抗结核分枝杆菌感染免疫反应,增加机体对结核分支杆菌的易感性。血浆中IL-10的含量与该基因rs1800896位点单核苷酸多态性有关[7]。目前的研究主要关注传统环境因素、宿主遗传易感因素在结核病发生和转归中的单独作用,而有关两者交互作用是否会对肺结核发病造成一定影响的研究报道较少,因此本研究将进一步分析IL-10 rs1800896位点基因多态性和吸烟在肺结核发病过程中的交互作用,为有效控制肺结核的发生和流行提供科学依据。
1 资料与方法
1.1 研究对象选取2018至2019年广东省多个结核病防治单位107例肺结核确诊患者,作为肺结核组。纳入标准:参考《中国结核病防治规划实施工作指南》,结合病史、临床症状、CT/X线检查以及痰涂片、结核分枝杆菌培养阳性确诊。排除标准:肺炎、肺癌和尘肺等具有结核相似病症者,糖尿病、艾滋病以及肿瘤癌症,长期使用激素等免疫能力低下者。另从同期体检的健康人群或当地的健康居民中选取健康对照118例,作为对照组。本研究获得广东药科大学第一附属医院伦理委员会审核批准(批准号:20180222),研究对象均签署知情同意书。
1.2调查方法
1.2.1 问卷设计与调查通过查阅国内外相关文献资料并结合现场的实际情况自行编制问卷,再根据专家意见对问卷进行修改调整,预调查后投入使用。问卷信度测量采用重测信度法,信度系数为0.72。专业调查员与研究对象进行面对面流行病学问卷调查,调查问卷内容包括一般人口学特征、生活环境、个人行为因素等。吸烟:每天1 支及以上,连续吸烟3个月及以上。饮酒:每天饮酒50 g及以上,连续饮酒6个月及以上。
1.2.2方法利用一次性真空抗凝管采集研究对象静脉血5 mL,于-80 ℃冰箱保存,整个过程无菌操作,避免血样污染。广东省分子探针与生物医学影像工程技术中心完成以下步骤:①DNA的提取:取2 mL外周静脉血于EDTA抗凝管中,采用北京天根生化科技有限公司提供的TIANamp Blood DNA Kit 血液基因组DNA提取试剂盒进行DNA提取;②聚合酶链式反应(PCR):NCBI中找到相应的参考序列,使用软件Primer Premier 3.0进行设计引物,IL-10基因rs1800896位点的上游引物序列为5′-GTGAAGGCTCAATCAAAGG-3′,下游引物序列为5′-TGGTTTCCTCACCCTACTG-3′,扩增产物大小为429bp。以提取的基因组DNA为模板,将目的基因上游和下游引物加水溶解、稀释,进行DNA扩增,再按照Millipore公司96纯化板操作流程操作进行PCR产物的纯化,最后利用Sanger法对PCR产物进行直接测序。
1.3质量控制采用面对面的方式进行问卷调查,让患者自行回答,不能回答者则由其家属代答。调查结束后对重要的信息进行再次核实,确保信息真实可靠。采用Epidata3.1 软件双人平行录入数据,并对数据进行一致性检验,建立数据库用以保存录入的数据。
1.4统计学分析采用SPSS 22.0软件进行统计分析,计数资料采用频数表示,组间比较采用2检验,利用2拟合优度检验Hardy-Weinberg进行遗传平衡(HWE)定律验证[8],以判断样本人群是否来自于同一群体。使用单因素Logistic回归模型分析环境因素、基因多态性与肺结核易感的关联,多因素非条件Logistic回归模型纳入乘积项法计算两者相乘交互作用,用叉生分析法计算相加交互作用。以P≤0.05为差异有统计学差异。
2 结 果
2.1 一般人口学特征肺结核组平均年龄为(42.10±16.87)岁,男72例,女35例;对照组平均年龄为(43.18±14.96)岁,男67例,女51例。均为汉族人。肺结核组和对照组的年龄、性别、婚姻状况和文化程度差异无统计学意义(P>0.05)。
2.2肺结核发病危险因素的单因素分析吸烟在肺结核组和对照组的分布差异有统计学意义(P<0.001),肺结核组的吸烟暴露率是对照组的2.74倍(OR=2.74 ,95%CI=1.57~4.78),室内采光、室内通风、工作环境粉尘以及饮酒在肺结核组和对照组的分布差异无统计学意义(P>0.05)。见表1。
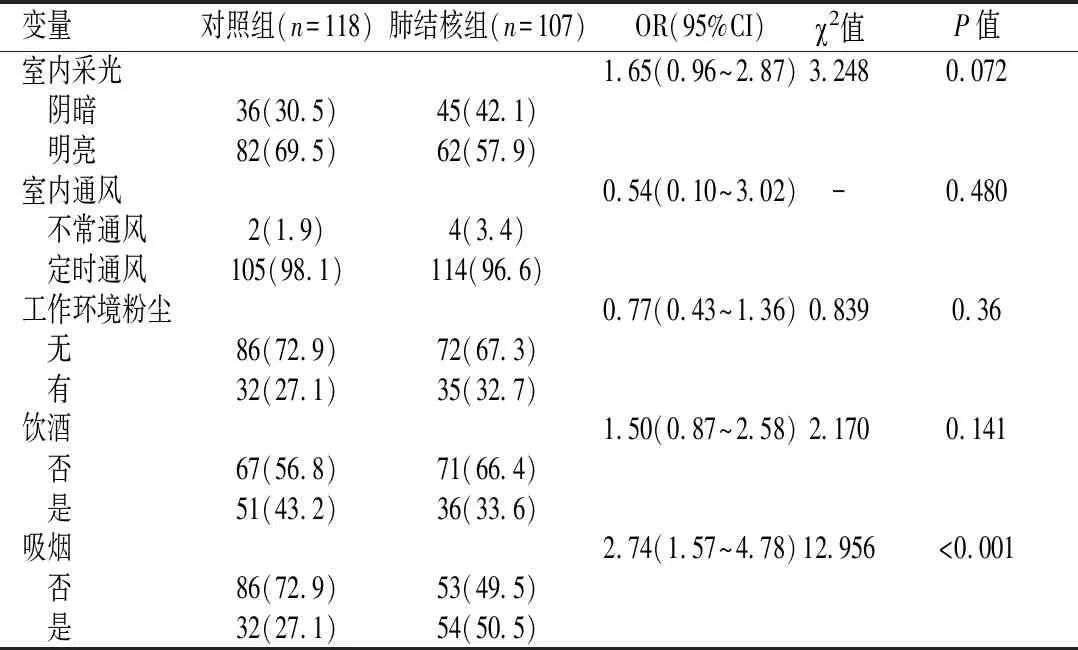
表1 肺结核患者发病危险因素的单因素分析[n(%)]Table 1 Single factor analysis of tuberculosis risk factors n (%)
2.3肺结核发病危险因素的多因素分析采用多因素Logistic回归模型进行分析,在调整了年龄、性别、婚姻状况、文化程度 4个因素后结果显示,肺结核组的吸烟暴露率是对照组的3.03倍(OR=3.03,95%CI:1.45~6.33),吸烟是肺结核的患病风险因素。见表2。

表2 肺结核发病危险因素的多因素Logistic回归分析结果Table 2 Results of multivariate Logistic regression analysis of tuberculosis risk factors
2.4IL-10基因的遗传多态性与肺结核易感性的关系
2.4.1 Hardy-Weinberg遗传平衡定律检验采用2拟合优度检验对IL-10基因 rs1800896位点的AA、AG、GG基因型频率进行Hardy-Weinberg遗传平衡定律验证,肺结核组和对照组的基因型分布达到遗传平衡(P>0.05),具有良好的群体代表性。见表3。
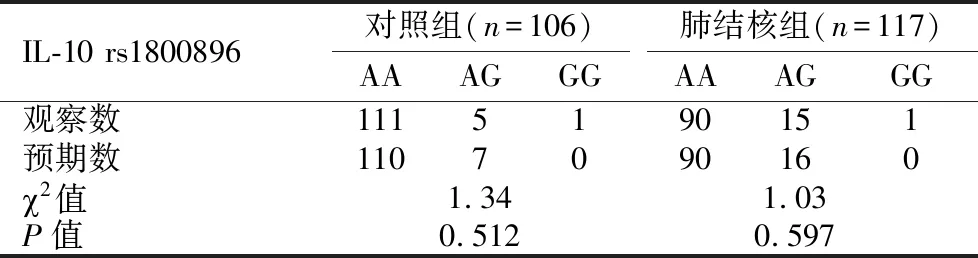
表3 IL-10基因 rs1800896位点基因型的Hardy-Weinberg检验Table 3 Hardy-Weinberg test of rs1800896 genotype of IL-10
2.4.2IL-10 rs1800896位点基因型与等位基因在不同组中的分布IL-10基因rs1800896位点的AA、AG、GG基因型在肺结核组、对照组的分布差异有统计学意义(P=0.017);A、G等位基因在肺结核组和对照组的分布差异有统计学意义(P=0.019)。见表4。
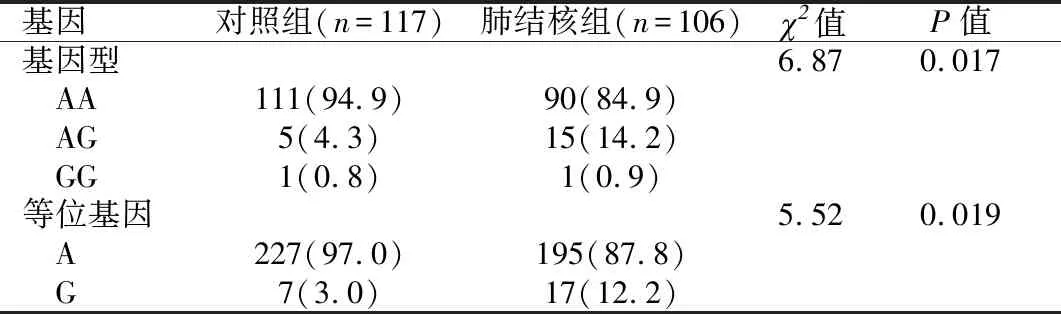
表4 IL-10基因 rs1800896位点基因型与等位基因在肺结核组和对照组的分布[n(%)]Table 4 Distribution of the rs1800896 polymorphism of IL-10 in patients and controls n(%)
2.4.3IL-10 rs1800896位点不同遗传模型与肺结核易感性的关系超显性模型(AA+GGvsAG )中,肺结核组的AG基因型存在率为对照组的3.69倍,携带AG基因型者肺结核患病风险增加;显性模型(AG+GGvsAA)中,肺结核组的AG+GG基因型存在率为对照组的3.45倍,携带AG+GG基因型者肺结核患病风险增加;等位基因模型(AvsG)中,肺结核组的G等位基因存在率为对照组的2.83倍,携带G等位基因型者肺结核患病风险增加;而共显性模型(AAvsAGvsGG)及隐性模型(GGvsAA+AG),2组间基因型分布差异无统计学意义(P>0.05)。见表5。
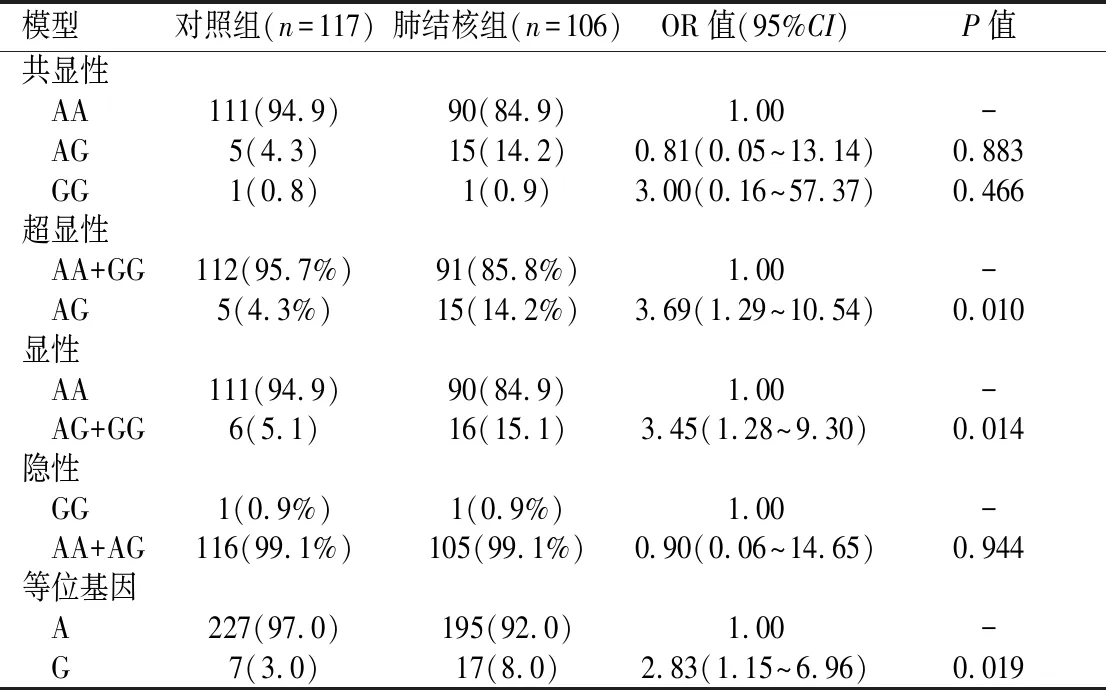
表5 IL-10基因 rs1800896位点不同遗传模型与肺结核易感性的关系分析[n(%)]Table 5 Correlation between different genetic models of the rs1800896 polymorphism of IL-10 and the susceptibility of TB n (%)
2.5IL-10基因与吸烟的交互作用对肺结核发病的影响
2.5.1 IL-10基因与吸烟的相乘交互作用对肺结核发病的影响单因素分析发现,吸烟、超显性模型(AA+GGvsAG )中的AG基因型、显性模型(AG + GGvsAA)中的AG + GG基因型在肺结核组中的暴露率高于对照组。IL-10基因 rs1800896位点超显性模型中的AG基因型与吸烟、显性模型中的AG+GG基因型与吸烟的相乘交互作用项均无统计学意义(P>0.05),表明IL-10基因与吸烟在肺结核的发病过程中无相乘交互作用。见表6。
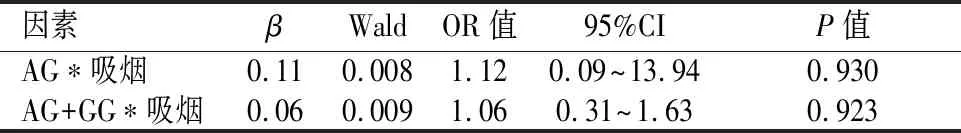
表6 IL-10基因 rs1800896位点与吸烟的相乘交互作用分析结果Table 6 Analysis of the multiplied interaction between rs1800896 polymorphism of IL-10 and smoking
2.5.2IL-10基因与吸烟的相加交互作用对肺结核发病的影响IL-10基因 rs1800896位点与吸烟的叉生分析结果显示:在超显性模型中,携带AG基因型且吸烟者的肺结核患病风险是未携带AG基因型且不吸烟的11.05倍,AG基因型和吸烟同时存在的OR值明显大于AG基因型和吸烟单独存在时的OR值之和;在显性模型中,携带AG+GG基因型且吸烟者的肺结核患病风险是未携带AG+GG基因型且不吸烟的11.16倍。表明超显性模型中的AG基因型与吸烟、显性模型中的AG+GG基因型与吸烟在肺结核的发病过程中存在一定的相加交互作用。见表7。
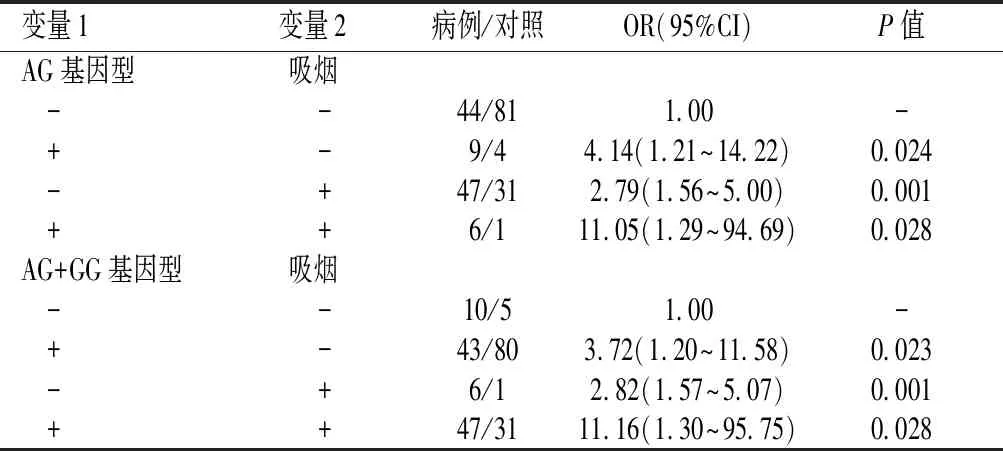
表7 IL-10基因 rs1800896位点与吸烟的叉生分析结果Table 7 Cross analysis of rs1800896 polymorphism of IL-10 and smoking
3 讨 论
肺结核的发病受环境因素和宿主因素的共同影响,遗传背景在肺结核的发生发展过程起着重要作用[9]。近年来,个体遗传与肺结核易感性之间的关系已成为国内外研究热点[10],但有关两者在肺结核发病过程中是否产生交互作用的研究目前尚较少报道。
本研究结果显示吸烟可使肺结核的患病风险增加2.03倍,有研究表明在控制了一系列的潜在混杂因素之后,吸烟仍然是导致肺结核的独立危险因素[11-12],这与本研究所得结果一致。
IL-10可通过抑制和终止炎症反应来调节T细胞免疫应答以增加宿主对结核分支杆菌的易感性[13-14]。IL-10基因rs1800896位点存在着G→A、C→T/C→A的碱基变换,碱基的变换影响机体合成IL-10的能力,其中G等位基因与IL-10高产量相关,而A等位基因则与IL-10低产量相关[9]。本研究结果显示,在超显性遗传模型(AA+GGvsAG )中,AG基因型肺结核患病风险是AA+GG基因型的3.60倍,携带AG基因型者对肺结核更易感;在显性遗传模型(AG+GGvsAA)中,AA基因型肺结核的患病风险仅为AG+GG基因型的0.3倍,与陈悦等[15]的家系病例对照研究结果一致,提示携带AA基因型是肺结核易感的保护因素之一。肺结核组中的G等位基因频率要高于对照组,G等位基因携带者肺结核患病风险相比于A等位基因携带者增加了1.83倍,这与Ates等[16]和Oral等[17]的研究发现A到G的突变使个体肺结核发病风险上调是一致的,表明IL-10基因 rs1800896位点的多态性与肺结核易感性有一定的关联。该基因位点的多态性对于预测某些人群的结核病易感倾向以及提供药物新靶点具有着重要意义[18]。
结核病的发生发展过程中存在复杂的基因-环境交互作用。本研究对IL-10基因rs1800896位点的超显性遗传模型、显性遗传模型与吸烟的相乘及相加交互作用进行分析,结果显示IL-10基因与吸烟在肺结核的发病过程中未显示出相乘交互作用,叉生分析结果显示在超显性模型中,携带AG基因型又吸烟者的肺结核患病风险是未携带AG基因型且不吸烟的13.47(1.45~12.09)倍。在显性模型中,携带AG+GG基因型且吸烟者的患病风险是未携带AG+GG基因型且不吸烟的11.16倍(OR=11.16 95%CI=1.30~95.75)。表明IL-10基因 rs1800896位点AG及GG基因型与吸烟在肺结核发病过程中存在一定的相加交互作用,两者同时存在会使肺结核患病风险显著增加,基因的分型联合吸烟情况可用于早期发现肺结核高风险人群,为肺结核的防治工作提供重要依据。
因此,吸烟可增加肺结核的发病风险,IL-10 rs1800896位点基因多态性可能与汉族人群肺结核易感性相关。IL-10 rs1800896位点基因多态性与吸烟在肺结核发病过程中未显示出相乘交互作用,但存在一定的相加交互作用。本课题研究仍在继续,未来研究将在样本量进一步扩大的基础上继续深入探讨相乘交互作用对肺结核发病的影响。

