环状RNA hsa_circ_0008234 对肺腺癌细胞增殖和迁移的作用
谷文露,袁海涛,张烜烽,刘德慧,王灵霞,蔡烨伟,严玉兰
0 引 言
目前肺癌已成为全球发病率和死亡率最高的恶性肿瘤,其中肺腺癌为最常见的类型,对人类的健康构成了巨大的威胁[1-2]。尽管目前有多种诊断和治疗肺癌的方法,但是肺癌的5年总生存率仍不足20%[3]。因此,急需寻找一种新的分子靶向治疗方法来改善肺癌的治疗效果。
环状RNA(circRNA)的结构呈闭合环状,是一类具有稳定性和保守性的新型非编码RNA[4]。大量研究表明,许多疾病的发生发展都与circRNA相关,特别是肿瘤[5-9]。然而,circRNA在肺腺癌发展中的作用机制尚不明确。本研究通过高通量测序技术,筛选出在肺腺癌组织与癌旁组织中差异低表达最明显的hsa_circ_0008234,探讨其在肺腺癌组织、细胞中的表达水平,以及对肺腺癌细胞增殖与迁移的影响,拟为肺腺癌的诊断、治疗提供新的理论依据。
1 资料与方法
1.1 研究对象选取2018年11月至2019年12月江苏大学附属人民医院胸外科就诊的75例肺腺癌患者的肺腺癌组织及癌旁组织标本。所有肺腺癌患者病理类型均由术中及术后组织病理确诊,术前均未接受任何放、化疗,且不伴有高血压、糖尿病等其他任何基础性疾病。术中收集肺腺癌及距离肿瘤边缘≥3cm的癌旁组织标本,离体后立刻置于含有RNA固定剂的无酶EP管中,然后迅速放于-80 ℃冰箱中保存以备用。其中5例组织标本用于高通量测序,另外70例组织标本用于进一步明确circ_0008234在肺腺癌组织中的表达情况。另收集60例肺腺癌患者未接受治疗前,及60例门诊正常体检者的外周血5 mL于抗凝管内,1200 r/min离心20 min后吸取上层血浆置于-80 ℃保存备用。本研究获得江苏大学附属人民医院伦理委员会批准(批准号:K-20180043-Y),患者均签署知情同意书。
1.2细胞株和主要试剂人肺腺癌细胞株A549、PC9、H1975和H1299以及人永生化正常支气管黏膜上皮细胞株BEAS-2B 购买于中国科学院上海生科院细胞中心,胎牛血清、RPMI 1640培养液及胰蛋白酶购自美国Gibco公司,小干扰RNA(siRNA)由广州锐博生物技术有限公司设计合成,过表达质粒由上海吉凯基因科技有限公司设计合成,PCR引物由上海生工生物工程股份有限公司合成,LipofectamineTM2000转染试剂、Trizol及Trizol LS 试剂购自美国Thermo Fisher Scientific公司,RNase R购自美国Epicenter Technologies公司,逆转录试剂盒及实时荧光定量 PCR 试剂盒购于日本TaKaRa公司,CCK-8试剂购自南京厚载生物科技公司,Transwell小室购自美国康宁公司,兔抗BTG3抗体、兔抗β-Actin抗体及羊抗兔二抗均购自武汉三鹰生物技术有限公司。
1.3方法
1.3.1 高通量测序采用Trizol法提取5对肺腺癌组织及癌旁组织的总RNA,并用RNase R处理总RNA以去除线性RNA。使用Agilent 2100系统 (美国Agilent Technologies公司) 对构建好的RNA文库进行质检,使用Illumina HiSeq 2000测序仪进行测序,并用limma软件 (R version 3.3.1) 对数据进行处理。测序程序和分析由上海欧易生物医学技术有限公司进行。
1.3.2细胞培养及转染将细胞培养在含有10%胎牛血清的RPMI 1640培养液中,置于37 ℃、5%CO2的细胞培养箱中。间隔1至2 d换液,当细胞贴壁生长到80%~90%时进行细胞传代。将PC9及A549细胞分别接种于2个6孔板中,PC9板设置过表达组(转染过表达circ_0008234的质粒)及对照组(转染阴性对照的质粒),A549板设置小干扰组(转染敲减circ_0008234的小干扰RNA)及阴性对照组(转染阴性对照的小干扰RNA)。当细胞覆盖率达60%~70%时,用LipofectamineTM2000转染试剂按照说明书进行转染。
1.3.3实时荧光定量PCR(qRT-PCR)采用Trizol法提取组织及细胞中的总RNA,用Trizol LS法提取血浆中的总RNA。然后利用逆转录试剂盒将所提取的总RNA进行逆转录为cNDA。用实时荧光定量PCR仪(美国Bio-Rad公司的CFX96)来扩增cNDA以检测hsa_circ_0008234在组织、血浆及细胞中的相对表达量。该扩增以GAPDH作为内参,扩增体系为:95 ℃预变性3 min,95 ℃变性5 s,56℃退火30 s,72 ℃延伸30 s,一共40个循环。用2-△△CT法计算hsa_circ_0008234的相对表达量。每个实验独立重复进行3次,每个样品均设置3个复孔。GAPDH上游引物5′-CAGGAGGCATTGCTGATGAT-3′,下游引物序列为5′-GAAGGCTGGGGCTCATTT-3′;hsa_circ_0008234的上游引物序列是5′- TCATCATAGCCACTGACACG-3′,下游引物序列为5′-AGAAACCACAGGCAACA ATC-3′。
1.3.4CCK-8实验将转染24 h后的肺腺癌PC9和A549细胞按2000个/孔的密度接种于96孔板中培养,每组设置3个复孔。对培养24、48、72、96 h的时间点的细胞进行换液,并每孔加入10 μL的CCK-8试剂,置于培养箱中培养2~4 h后,用酶标仪测量450 nm处的吸光度值。
1.3.5平板克隆形成实验将转染后的肺腺癌PC9和A549细胞接种于6孔板中(500个/孔),置于37 ℃、5%CO2细胞培养箱中。每隔3天换液一次,10~14 d肉眼可见克隆团时终止培养。弃去培养液,PBS轻轻冲洗3遍,每孔加入1 mL 4%的多聚甲醛并置于4 ℃冰箱固定30 min,再用PBS清洗3遍,每孔加入1 mL 0.1%的结晶紫染液4 ℃冰箱染色0.5 h,最后用双蒸水清洗至背景干净,计数克隆形成数,每组实验均重复进行3次。克隆形成率计算公式如下:
克隆形成率(%)=(克隆数/接种细胞总数)×100%
1.3.6细胞划痕实验将肺腺癌PC9和A549细胞分别接种于6孔板中,PC9板3个孔设置为过表达组,另外3个孔设置为对照组;A549板3个孔设置为小干扰组,剩下3个孔设置为阴性对照组。当细胞在6孔板中单层生长至70%~80%时,用10 μL的无菌移液枪头垂直于6孔板底部划线,用PBS冲洗3遍,并更换为无血清的培养基,同时进行转染,拍照并记录为0 h,然后置于培养箱中继续培养,并在48h时再次拍照记录宽度。
1.3.7Transwell 迁移实验将干预后的肺腺癌PC9和A549细胞消化后,用无血清培养基重悬细胞,以每室100 μL分别接种于Transwell小室上层中,在下层小室每孔加600 μL含有10%FBS的培养基,置于细胞培养箱中。孵育24 h后取出,弃去小室中的培养液,用棉签轻轻擦拭小室上层内侧未迁移的细胞,用PBS清洗3次,再用4%的多聚甲醛固定30 min,PBS再次清洗3次,0.1%的结晶紫染液染色30 min,PBS漂洗干净后倒扣晾干,显微镜下拍照,实验重复3次。
1.3.8蛋白质印迹法将干预48 h后的肺腺癌PC9和A549细胞用RIPA裂解液冰上裂解提取蛋白。再进行10%的SDS-PAGE凝胶电泳,恒流350 mA、120 min进行转膜,然后用5%的脱脂奶粉室温封闭2 h,4 ℃冰箱一抗(兔抗β-Actin 1∶500,兔抗BTG3 1∶500)孵育过夜,TBST清洗3次,每次10 min,予以羊抗兔二抗(1∶5000)室温孵育2 h,再次TBST清洗3次,每次10 min,最后予以化学发光显影。使用Image J软件对条带进行半定量分析。
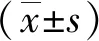
2 结 果
2.1 Hsa_circ_0008234的筛选高通量测序结果显示,共有162个差异表达的环状RNA (均数变化>2.0,P<0.05) ,其中最具有差异性的是环状RNA circ_0008234。
2.2Hsa_circ_0008234 在肺腺癌患者组织和血浆中的表达Hsa_circ_0008234在肺腺癌组织中的表达量明显低于癌旁组织[(0.31±0.40)vs(1.20±0.68),P<0.01];肺腺癌患者血浆的Hsa_circ_0008234表达水平明显低于正常健康体检者[(0.56±0.44)vs(1.18±0.67),P<0.01]。
2.3Hsa_circ_0008234在肺腺癌细胞中的表达Hsa_circ_0008234在4株肺腺癌细胞PC9、A549、H1299、H1975的表达水平均明显低于正常支气管粘膜上皮细胞BEAS-2B(P<0.01)。PC9中的circ_0008234表达水平最低,故选择PC9进行circ_0008234的过表达;在A549中的表达水平相对较高,故选择A549进行circ_0008234的敲减,以进一步探讨circ_0008234对肺腺癌细胞的作用。见图1。
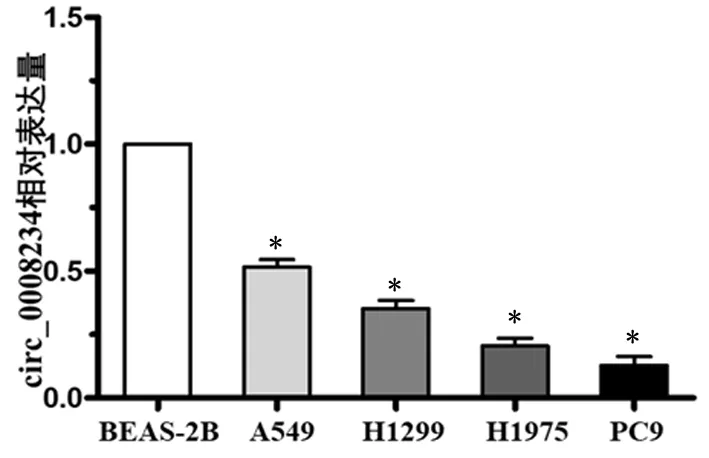
与BEAS-2B比较,*P<0.01图1 正常支气管上皮细胞及肺腺癌细胞株中hsa_circ_0008234的表达水平Figure 1 The expression levels of hsa_circ_0008234 in normal bronchial epithelial cells and lungadenocarcinoma cell lines
2.4Hsa_circ_0008234在肺腺癌细胞中的表达水平肺腺癌细胞PC9转染circ_0008234过表达质粒48 h后,PC9细胞的过表达组circ_0008234的表达水平(119.67±2.03)明显高于对照组(1±0.03)。肺腺癌细胞A549转染小干扰RNA 48h后,A549细胞的小干扰组circ_0008234的表达水平(0.38±0.18)明显低于阴性对照组(1±0.02)。由此表明,细胞中的circ_0008234表达水平可被成功干预。
2.5Hsa_circ_0008234的表达水平对肺腺癌细胞的增殖有影响CCK-8结果显示,当人肺腺癌细胞PC9转染circ_0008234过表达质粒后,过表达组生长速度明显较对照组慢;小干扰组生长速度明显较阴性对照组快。见图2。由此可见,上调circ_0008234可以抑制肺腺癌细胞的增殖;下调circ_0008234可以促进肺腺癌细胞的增殖。

与过表达组比较,*P<0.01;与阴性对照组比较,#P<0.05图2 过表达hsa_circ_0008234抑制肺腺癌细胞的活力及敲减hsa_circ_0008234提高肺腺癌细胞的活力Figure 2 Over expression of hsa_circ_0008234 inhibits the vitality of lung adenocarcinoma cells,knockdown of hsa_circ_0008234 improves the vitality of lung adenocarcinoma cells
2.6Hsa_circ_0008234的表达水平对肺腺癌细胞的迁移有影响细胞划痕实验表明:肺腺癌细胞PC9中过表达组的迁移率[(20.90±3.42)%]明显低于对照组[(41.98±2.21)%];A549中小干扰组的迁移率[(41.92±3.27)%]明显高于阴性对照组[(31.98±4.06)%],差异具有统计学意义(P<0.05)。见图3。Transwell 实验表明:肺腺癌细胞PC9中过表达组的迁移细胞数(31.33±2.61)明显低于对照组(90.67±2.06);A549中小干扰组的迁移细胞数(121.50±2.97)明显高于阴性对照组(78.00±3.08),差异具有统计学意义(P<0.01)。见图4。

图3 过表达及敲减hsa_circ_0008234对肺腺癌细胞迁移的影响Figure 3 Over expression of hsa_circ_0008234 inhibits lung adenocarcinoma cell migration,knockdown of hsa_circ_0008234 promotes lung adenocarcinoma cell migration
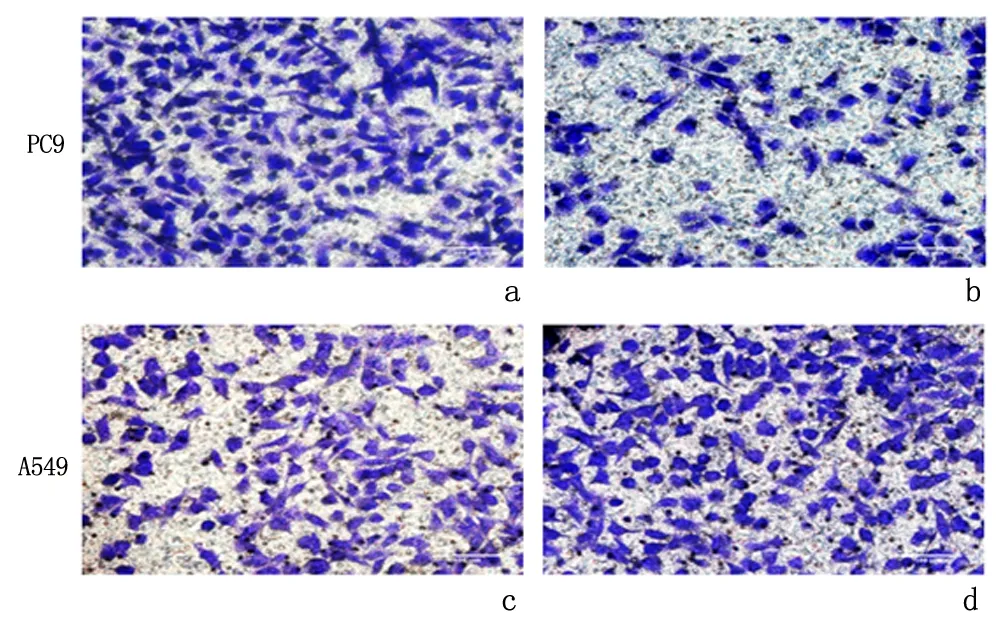
a:对照组;b:过表达组;c:阴性对照组;d:小干扰组图4 过表达或敲减hsa_circ_0008234后肺腺癌细胞的迁移能力Figure 4 Lung adenocarcinoma cell migration ability after overexpression or knockdown of hsa_circ_0008234
2.7Hsa_circ_0008234的表达水平对BTG3蛋白的影响通过starbase (http://starbase.sysu.edu.cn/) 预测了BTG3可能是circ_0008234的潜在作用靶点。蛋白质印迹实验显示,肺腺癌细胞PC9中过表达组的BTG3蛋白表达明显高于对照组(P<0.05);A549中小干扰组的BTG3蛋白表达明显低于阴性对照组(P<0.05)。见图5。

图5 Hsa_circ_0008234的表达水平影响BTG3蛋白的表达Figure 5 The expression level of Hsa_circ_0008234 affects the expression of BTG3 protein
3 讨 论
肺腺癌是肺癌中最常见的类型,早期症状不明显,不易诊断,且缺乏有效的治疗手段,死亡率较高。因此急需进一步探讨肺腺癌的发生、发展机制,为肺腺癌的诊断及治疗提供敏感特异有效的指标。
circRNA没有3′端加尾和5′端加帽结构,可抵抗外切核酸酶的降解作用,具有高度的保守性和稳定性[10]。因此,circRNA可被用来作为多种疾病的分子诊断标志物和治疗靶点。大量的研究显示,circRNA的失调与各种肿瘤有关。Wang等[11]研究表明,circ-UBE2D2在乳腺癌组织和细胞中高表达,沉默circ-UBE2D2显著抑制乳腺癌细胞的增殖、迁移和侵袭,起着重要的致癌作用。Gao等[12]研究显示,circ-PKD2在口腔鳞状细胞癌组织和细胞中高表达,过表达circ-PKD2抑制了口腔鳞状细胞癌细胞的增殖、迁移和侵袭,诱导细胞凋亡和细胞周期阻滞,发挥显著的抑癌作用,然而敲减circ-PKD2基因后,则出现相反的结果。本实验通过高通量测序帅选出在肺癌组织中表达具有明显差异的环状RNA hsa_circ_0008234。本研究中,circ_0008234在肺腺癌患者组织和血浆中低表达,提示其可能在肺腺癌中发挥抑癌基因作用。随后,检测了hsa_circ_0008234在四株肺腺癌细胞中的表达情况,选择表达量最低的PC9细胞进行过表达,表达量相对较高的A549细胞进行敲减。实验发现,过表达circ_0008234后可明显抑制肺腺癌细胞的增殖和迁移;敲减circ_0008234后则显著促进肺腺癌细胞的增殖和迁移。由此推测,circ_0008234可抑制抑制肺腺癌的发生和发展。
B细胞异位基因3(BTG3)是抗增殖BTG基因家族的成员,是抑癌基因P53下游的一个靶点,在人类癌症中下调[13]。大量研究报道,BTG3可抑制肿瘤的进展[14-17]。Peng等[18]研究发现BTG3对非小腺癌细胞的增殖与迁移有抑制作用。我们通过starbase (http://starbase.sysu.edu.cn/) 预测了BTG3可能是circ_0008234的潜在作用靶点,且通过蛋白质印迹法,检测了BTG3的蛋白表达水平,过表达circ_0008234后BTG3蛋白表达明显增多;而敲减circ_0008234后BTG3蛋白表达减少。由此推测circ_0008234可能通过调节BTG3在肺腺癌细胞中发挥抑癌作用。
综上所述,circ_0008234在肺腺癌组织、血浆和细胞中低表达,可能通过调控BTG3基因而抑制肺腺癌的增殖和迁移,从而发挥抑癌作用,为肺腺癌的预后和治疗提供新的理论基础。然而circ_0008234调控BTG3的具体机制仍不清楚,需要进一步的探究。

