CG6015基因在果蝇睾丸生殖干细胞生命维持中的功能研究
郑倩雯,陈 霞,王 敏,陈万银,栾晓瑾,颜一丹,方 杰,胡 兴,于 骏
0 引 言
生殖干细胞(drosophilatestis,GSCs)因其具有自我更新与分化的能力在性腺发育、配子形成及胚胎发育等生命活动中具有重要作用[1-2]。因此,GSCs生命调控的机制研究将为人类不孕不育、生殖器肿瘤等疾病提供更多的诊治依据。果蝇睾丸是GSCs生命调控研究的经典模型[3-4]。研究表明,生殖干细胞微环境位于果蝇睾丸顶端,由一组致密的中心细胞和围绕在其周围的GSCs、体细胞干细胞(Somatic Stem cells,SSCs)构成,其中每个GSC又被2个SSCs所包裹。生殖干细胞微环境在GSCs的自我更新和分化过程中发挥了重要作用[5]。在生殖干细胞微环境的严格调控下,GSCs经过不对称分裂,生成2个子代细胞,其中一个子代细胞继续与中心细胞保持接触而维持干细胞的自我更新能力,另一个子代细胞因脱离了生殖干细胞微环境的信号调控而进入分化程序,形成性原细胞(Gonialblast,GB)并经过4次有丝分裂后进入减数分裂过程,最终通过长形精子个体化过程形成了成熟精子[6-8]。随着生殖细胞逐步分化,生殖融合体也逐渐由最初的点状转变为分叉状[9]。
大量研究证实,GSCs的自我更新与分化过程受到多种信号因子调控,杰纳斯激酶-信号转导与转录激活子(Janus Kinase-Signal Transducer and Activator of Transcription ,JAK-STAT)信号通路作为GSCs维持的内源性信号,在调控GSCs自我更新的过程中具有重大意义[10-16]。过度活化JAK-STAT 信号通路会导致GSCs过度增殖,而JAK-STAT 信号受阻则会引起GSCs的丢失[10]。骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路则被发现能够抑制GSCs中分化因子Bam的表达,进而发挥抑制GSCs分化的作用[11-13]。此外,Hedgehog(Hh)信号通路能够通过SSCs间接调控GSCs的生命活动[14-16]。即便如此,GSCs命运调控的过程中所涉及的大量调控因子及其机制仍有待进一步明确。
为了探究影响GSCs生命的潜在调控因子,本研究前期在果蝇睾丸中开展了大规模的RNA干扰(RNA interference,RNAi)筛选,并且鉴定CG6015基因为调控果蝇睾丸GSCs的自我更新与分化过程的重要因子[17]。果蝇CG6015基因作为一个蛋白质编码基因,目前尚缺乏针对性研究,仅被预测具有RNA结合活性,并能够通过剪接体参与mRNA剪接过程。而CG6015基因在人类中的同源基因为cell division cycle 40(CDC40),该基因作为一个能够调节细胞周期的剪接因子,所编码的蛋白质对于mRNA前剪接过程中的催化步骤II是必不可少的[18]。CG6015基因在酵母中的同源基因Prp17同样被认为是重要的RNA剪接因子,能够协同U2,U5及U6小核糖蛋白参与前信使RNA的剪接过程[19]。RNA剪接体的亚基在果蝇睾丸中已被证实参与了GSCs生命维持和生精过程[20-21]。因此,CG6015基因在果蝇睾丸GSCs生命调控中的功能以及其中涉及的调控机制亟需进一步探讨。本研究旨在探究CG6015基因对果蝇睾丸GSCs生命维持的影响,探讨CG6015基因在调控GSCs生命中的潜在机制,为男性不育症的致病机制提供新思路。
1 材料与方法
1.1 材料
1.1.1 果蝇品系UAS-CG6015 RNAi 转基因果蝇购于清华果蝇中心(Tsinghua Fly Center,THFC),该品系来源于TRiPRNAi转基因果蝇库(Transgenic RNAi Project)。Nos-Gal4转基因果蝇品系信息为:#4937,BDSC。W1118品系果蝇(野生型果蝇)来源于THFC果蝇库。本研究中所有果蝇均在温度25°C、相对湿度60%的条件下培育。
1.1.2试剂与仪器免疫荧光大鼠Vasa一抗(1∶20,DSHB公司,美国),免疫荧光小鼠1B1一抗(1∶50,DSHB公司,美国),免疫荧光大鼠锌指结构域蛋白(Zfh1)一抗(1∶1000,浙江大学佟超实验组赠予),免疫荧光小鼠眼缺陷蛋白(Eya)一抗(1∶20,DSHB公司,美国),免疫荧光小鼠Arm蛋白一抗(1∶20,DSHB公司,美国),免疫荧光大鼠DE-cad蛋白一抗(1∶15,DSHB公司,美国)。免疫荧光cy3-小鼠二抗,488-小鼠二抗,647-大鼠二抗(1∶400,Molecular Probes and Jackson Immunologicals公司,美国),核染料Hoechst33342(1∶100,Invitrogen公司,美国),BSA(生工公司,中国),PBS(生工公司,中国),抗荧光淬灭封片液(碧云天公司,上海),果蝇S2胚胎细胞系,果蝇培养基(DMEM)及Opti-MemR培养液(Gibco公司,美国),胎牛血清(Bioind公司,以色列),LipofectamineR 2000转染试剂(Invitrogen公司,美国),CG6015siRNA质粒及NC siRNA质粒(吉玛基因公司,中国),总RNA提取试剂、反转录试剂盒及SYBRGreen染料(Takara公司,日本),qRT-PCR引物(生工生物公司,中国),Real-timePCR仪:QuantStudio©5(Thermo公司,美国),激光共聚焦显微镜:LSM800(蔡司公司,德国)。
1.2方法
1.2.1 果蝇杂交策略挑选Nos-Gal4雄性果蝇与UAS-CG6015RNAi处女蝇进行杂交。在F1代中挑选出基因型为Nos>CG6015RNAi的雄蝇,作为实验组,W1118雄蝇为对照组。即在早期生殖细胞中敲减CG6015基因的果蝇,然后进行下一步功能性分析[24-25]。
1.2.2果蝇解剖及形态分析挑选F1代出生2~3 d,基因型为Nos>CG6015 RNAi的雄蝇,将果蝇浸于1XPBS溶液中,在显微镜下解剖、分离性腺组织,观察睾丸形态[25]。
1.2.3免疫荧光染色将解剖分离出的果蝇睾丸用含4%多聚甲醛的PBS固定30 min。固定完成后,用含0.3%TritonX-100的PBS(0.3%PBST)通透3次,每次10 min。通透完成后,用含5%牛血清白蛋白(BSA)的0.3%PBST封闭30 min,以降低抗体与抗原的非特异性结合。封闭结束后,用封闭液配制出合适浓度的一抗工作液并于4°C孵育睾丸组织过夜。第2天,用0.3%PBST将一抗孵育后的睾丸组织清洗3次,每次10 min,以去除多余的一抗。接着使用封闭液将二抗稀释至合适的工作浓度后,在室温下避光孵育1 h。二抗孵育完成后,用0.3%PBST清洗3次,每次5 min,最后加入终浓度为1.0 mg/mL的Hoechst33342染料染核5 min,完成染色。最后将睾丸组织放置在载玻片上,加入10 μL防粹灭甘油并用盖玻片封片。制备好的睾丸样本将在激光共聚焦显微镜下采集荧光图片,最后利用Adobe Photoshop CC 2018软件处理图片。
1.2.4细胞培养果蝇S2细胞在含10%胎牛血清的果蝇培养基(DMEM),温度为28 ℃且不含CO2的恒温培养箱内进行培养。根据细胞具体生长速度及生长状态,适时进行细胞换液,按照1∶2~1∶3比例进行细胞传代并及时进行细胞保种。
1.2.5CG6015基因沉默处理将细胞按1.5×105细胞/mL接种于6孔板,取2个孔分别作为NC组(添加阴性对照的S2细胞)与CG6015 siRNA组(添加CG6015 siRNA的S2细胞),待细胞生长密度达70%~90%后进行转染。转染步骤按LipofectamineR 2000转染试剂说明书进行。使用Opti-MEM培养液分别稀释siRNA片段和转染试剂,充分混匀以使siRNA的终浓度至150 nmol/L,最后将转染混合液加入细胞中。转染6 h后更换培养液并继续培养,转染48 h后收集细胞提取总RNA、逆转录合成cDNA后,行qRT-PCR检测干涉效率。siRNA信息如下:NC组,上游:5′- UUCUCCGAACGUGUCACGUTT-3′,下游:5′-ACGUGACACGUUCGGAGAATT-3′;CG6015 siRNA组上游:5′-GGGCCGCUCUUAUUUGCAUTT-3′,下游:5′-AUGCAAAUAAGAGCGGCCCTT-3′。
1.2.6qRT-PCR检测CG6015及RNA剪接体亚基的mRNA表达水平收集转染48h后的果蝇S2细胞,利用RNAiso Plus提取总RNA,并使用紫外分光光度计检测RNA浓度。提取出的总RNA经逆转录试剂盒合成cDNA。将SYBR Green荧光染料、cDNA、引物及DEPC水充分混匀后配制成qRT-PCR反应体系。反应条件为95 ℃预变性2 min,95 ℃变性20 s,60 ℃退火15 s,72 ℃延伸1 min,共40个循环。Ct值以2-ΔΔCt表示,通过标准化处理内参(GAPDH)的mRNA表达量来获取每个基因的mRNA相对表达量。每个样本设置3个副孔,并重复3次实验。引物序列如下:GAPDH,上游:5′-GTGGTGAACGGCCAGAAGAT-3′,下游:5′-GCCTTGTCAATGGTGGTGAA-3′;CG6015,上游:5′-GCCTGCCAGTCGTTAGACAA-3′,下游:5′-GCGTAGCCAGAGACCATGTG-3′;Prp8,上游:5′-GCAGGAGAGGCAGCACAACTAC-3′,下游:5′-AGCGACGTGATTCCAGCCAATG-3′;SmG,上游:5′-AGCGACGTGATTCCAGCCAATG-3′,下游:5′-CGTAGCATGGCATCGAGTCCTTG-3′;U2A,上游:5′-TCCATCATTCTCACCGGCAACAAC-3′,下游:5′-CTGCTTGATCTTCCTGAAGTCGAGTAG-3′。
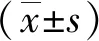
2 结 果
2.1CG6015基因能够维持果蝇睾丸正常形态对照组睾丸形态卷曲饱满,而实验组睾丸体积明显缩小,形态异常,呈现小睾丸表型。与对照组睾丸中出现小睾丸表型的比例(0)比较,实验组中(100%)明显升高(P<0.001),见图1。
2.2CG6015基因在果蝇睾丸早期生殖细胞中参与维持GSCs的生命免疫荧光结果显示:在对照组睾丸中,Vasa阳性信号均匀分布于生殖细胞胞质中,1B1信号由点状逐渐转化为分叉状。而在早期生殖细胞中敲减CG6015基因后,实验组Vasa阳性细胞和1B1信号均完全缺失。与对照组睾丸中的生殖融合体数量比较,实验组明显减少[(19.67±0.88)个vs(0.00±0.00)个,P<0.001]。见图2。

图2 在早期生殖细胞中敲减CG6015基因后GSC细胞维持障碍Figure 2 Knockdown of CG6015 in early germ cells results in defects of germline maintenance (Scale bar:20 μm)
2.3CG6015基因在早期生殖细胞中介导包囊细胞正常分化免疫荧光结果显示:对照组睾丸中,Zfh1阳性细胞在睾丸顶端围绕中心细胞分布,而Eya阳性细胞散在地分布于睾丸体部。实验组睾丸中,Zfh1阳性细胞呈现散在分布的状态,而Eya阳性细胞出现明显的积累,呈现过度分化状态。见图3。与对照组比较,实验组睾丸中Zfh1阳性细胞数量无明显改变[(9.67±0.33)个vs(9.67±0.88)个,P>0.05],Eya阳性细胞数量明显增加[(9.67 ± 0.67)个vs(25.67±5.21)个,P<0.05]。

图3 在早期生殖细胞中敲减CG6015基因后导致包囊细胞积累Figure 3 Knockdown of CG6015 in early germ cellsleads to accumulation of somatic cyst cells (Scale bar:20 μm)
2.4CG6015基因在早期生殖细胞中的细胞黏附效应免疫荧光结果显示,对照组和实验组睾丸中,Arm信号与DE-cad信号均呈现共定位现象。但是,实验组睾丸中Arm信号和DE-cad信号较对照组出现明显堆积。见图4。实验组睾丸中Arm蛋白与DE-cad蛋白表达水平[(9.87±0.94)、(10.88±0.94)]与对照组[(10.45±0.17)、(10.06±0.91)]比较未发生明显改变(P>0.05)。

图4 在早期生殖细胞中敲减CG6015基因后细胞钙黏蛋白表达情况Figure 4 Expression of Arm or DE-cad protein when knockdown of CG6015 in early germ cells (Scale bar:20 μm)
2.5CG6015基因在果蝇S2细胞中调节RNA剪接体亚基的mRNA转录水平与NC组Prp8、SmG、U2A基因的mRNA相对表达水平(1.00±0.00)比较,CG6015 siRNA组Prp8基因(0.39±0.03)明显下调,SmG基因(1.60±0.07)明显上调(P<0.05),而U2A基因改变差异无统计学意义(P>0.05)。
3 讨 论
GSCs的生命维持是调控干细胞在自我更新和分化过程间稳态平衡的必要条件,而维持GSCs生命的调控因子仍然有待发掘。本研究报道了CG6015基因在果蝇睾丸中调控GSCs生命的作用及可能的调控机制。为系统探究CG6015基因在果蝇睾丸GSCs命运调控中的功能,本研究利用GAL4/UAS二元表达系统(Nos-Gal4)来驱动CG6015 RNAi的表达,发现CG6015基因具有调控GSCs命运的功能,而这一功能可能是通过介导剪接体影响前mRNA剪接而实现的。
本研究利用Nos-Gal4在果蝇睾丸中敲减CG6015基因以实现下调该基因在生殖细胞中的表达水平,并且发现生殖细胞明显消失,睾丸结构完全坍塌,生殖细胞生命维持受到严重威胁,因而无法对这些睾丸进行干涉效率验证。而本研究所用的UAS-CG6015 RNAi 转基因果蝇品系来源于TRiPRNAi转基因果蝇库,目前很多重要的果蝇研究中大规模的RNAi筛选实验都是通过该果蝇库开展的[17,26],也有研究者利用该果蝇库进行果蝇睾丸生殖细胞生命维持的研究,发现了小核糖蛋白SmD3对GSCs生命维持的重要性[27]。因此,通过该果蝇库开展的RNAi实验的结果是十分可信的。
根据flybase数据库(http://flybase.org)搜寻结果显示,CG6015基因在果蝇睾丸中优势表达,并且经过大规模筛选研究后被鉴定为GSCs自我更新与分化的调控因子之一[17]。而作为CG6015基因的同源基因,CDC40/Prp17经研究证实为重要的RNA剪接因子,在生命维持调控中发挥关键性作用[18-21]。目前,关于CG6015基因的研究报道仍然较少,其在果蝇体内的生物学作用和调控机制尚不明确。本研究利用模式动物果蝇及果蝇S2细胞开展实验,探究目的基因CG6015在果蝇睾丸GSCs命运调控中的具体功能和调控机制,具有创新性研究意义。
本研究结果提示,CG6015基因在果蝇睾丸GSCs的细胞维持中具有决定性作用,但是其中涉及的调节机制有待进一步探讨。研究显示,细胞黏附在果蝇卵巢GSCs生命维持中具有重要作用,钙黏蛋白(E-cadherin)介导的黏附效应有助于GSCs在干细胞微环境中的细胞维持[28]。通过在果蝇睾丸内的研究,我们发现CG6015基因并未依赖细胞黏附调控GSCs命运。有趣的是,我们发现CG6015基因在果蝇S2细胞中影响RNA剪接体亚基Prp8和SmG的mRNA转录水平,这提示我们CG6015基因很有可能通过介导剪接体而调控S2细胞生命活动。剪接体结构复杂,包含了U1、U2、U4、U5和U6五种snRNP和150余种蛋白质[29]。真核生物基因中mRNA的形成有赖于剪接体的加工处理。Prp8作为剪接体核心成分,是RAS、Notch等驱动的肿瘤的重要调节因子,其功能的丧失不仅会导致细胞凋亡增多,而且影响细胞分化与极性[30]。Smith蛋白G(SmG)也称为小核核糖核蛋白多肽G,是剪接体U1、U2、U4和U5 snRNP生物发生中不可或缺的组分,是主要剪接体的前体[31]。因此CG6015基因对Prp8和SmG的mRNA表达水平的影响揭示了其在剪接体功能调控中的重要作用。但值得思考的是,CG6015对SmG的负调控作用是否提示两者之间可能存在竞争关系,这需要我们开展深入的研究。
综上,本研究揭示了CG6015基因在果蝇睾丸GSCs生命维持中的关键作用以及可能的调控机制,阐明了GSCs的稳定对于果蝇睾丸正常精子发生的重要性,为男性不育的诊断与治疗提供更多可能性。

