磁共振扩散加权成像对宫颈癌放化疗效果预测价值
刘祯,张杰,李颖端,杨佳2,徐文坚,陈静静
(1 青岛大学附属医院放射科,山东 青岛 266003; 2 荆州市中心医院放射科)
目前在世界范围内女性生殖系肿瘤死亡原因中,宫颈癌占居首位。中晚期宫颈癌治疗通常会选择同步放化疗[1-4]。早期预测及监测宫颈癌的疗效成为妇科肿瘤临床研究的新热点。目前影像学主要通过测量肿瘤径线评估疗效,然而肿瘤的形态学变化滞后于肿瘤分子水平的变化,常规MRI难以早期评价放化疗效果。扩散加权成像(DWI)可以活体识别水分子在组织内的扩散方式,通过表观扩散系数(ADC)值对病变区水分子扩散运动进行定量分析已成为临床研究的新思路[5-9]。本研究通过对宫颈癌病人治疗不同时间肿瘤最大径、ADC值、指数表观扩散系数(eADC)值等的动态变化进行分析,探讨DWI对宫颈癌放化疗效果的预测和监测价值。
1 资料与方法
1.1 一般资料
收集2012年1月—2014年11月我院收治的52例宫颈癌(鳞癌48例,腺癌4例)病人,年龄37~75岁,平均(53.3±2.4)岁;治疗前肿瘤最大径23~89 mm,平均(47.2±3.8)mm。所有病例均经病理检查证实且均未进行过相关治疗。
1.2 检查方法
本文52例病人分别于治疗前及治疗15 d、1个月、2个月时进行MR检查,采用GE Signa 3.0 T MR扫描仪、TORSO线圈,平扫行横轴位T1WI和T2WI、冠状位T2WI、矢状位T2WI及DWI序列检查,层厚6 mm,层间距2 mm,矩阵230×256,FOV 40×40,NEX 4次,b值取0、800 s/mm2。检查前禁食8~12 h,检查时嘱病人平静呼吸。扫描范围为髂骨上缘至耻骨联合下缘。
1.3 图像后处理和测量分组
将得到的原始图像传到ADW 4.3工作站上,通过Functool分析软件后处理自动形成ADC以及eADC伪彩图。参考DWI图像,使用ADC手动测量工具在ADC图上选取信号相对均匀的区域即感兴趣区(ROI)计算ADC值,ROI应最大程度包含病灶,并避开出血以及坏死区。eADC的计算公式为:eADC =exp[-(b×ADC)],其中b为扩散加权因子。ADC值和eADC值均重复测量3次,取平均值。治疗前后参数值变化率=(治疗后肿瘤平均参数值-治疗前肿瘤平均参数值)/治疗前肿瘤平均参数值×100%。根据第1版实体瘤的疗效评价标准(RECIST)[3],将病人分为部分缓解(PR)组、完全缓解(CR)组和稳定(SD)组。
1.4 统计学分析

2 结 果
2.1 ADC值、eADC值预测及监测宫颈癌放化疗效果的价值
治疗2个月MR示42例为PR(PR组,肿瘤最大径至少减少30%),9例为CR(CR组),1例为SD(SD组,肿瘤缩小未达到30%)。由于SD组病例数较少,在分析时暂不考虑。PR组与CR组治疗前及治疗15 d、1个月、2个月的ADC值及eADC值见表1、2。由表1、2可知,两组治疗后ADC值较治疗前升高,eADC值较治疗前降低,差异均有统计学意义(F=346.636~2 754.985,P<0.01);治疗不同时间两组ADC值及eADC值比较差异均有统计学意义(F=3.014~13.264,P<0.01)。不同疗效组ADC值、eADC值的估算边际平均值见图1。在治疗前,PR组宫颈癌病人ADC值的极小值与eADC值的极大值分别为0.754×10-3mm2/s、0.547;CR组病人ADC值的极大值与eADC值的极小值分别为0.895×10-3mm2/s、0.489。用治疗前各ADC值做ROC曲线分析预测肿瘤能否CR,取约登指数的最大点(0.794)作为诊断点,其ADC值为0.891×10-3mm2/s,其曲线下面积(AUC)为0.902,特异度为95%,灵敏度为84.4%,标准误为0.046,P值<0.01。由此结果可预测,治疗前ADC值≤0.891×10-3mm2/s,治疗2个月后肿瘤能够CR;反之,则肿瘤难以CR。

图1 不同疗效组ADC和eADC值的估算边际平均值
表1 两组不同治疗时间ADC值比较

表2 两组不同治疗时间的eADC值比较
2.2 肿瘤最大径变化率与ADC值的相关性
不同时间的ADC值、eADC值和肿瘤最大径见表3。ADC值、eADC值及肿瘤最大径的估算边际平均值见图2。治疗15 d时的肿瘤最大径与治疗前比较,差异无显著性(P>0.05);治疗1、2个月时的肿瘤最大径与治疗前比较,差异有统计学意义(F=3 453.711,P<0.01)。而ADC值、eADC值在治疗15 d时已有较显著的变化(F=1 170.947、831.832,P<0.01),可见肿瘤治疗后ADC值及eADC值的变化早于形态学变化。见图3。52例宫颈癌病人治疗后2个月肿瘤最大径变化率为(85.69±2.38)%,治疗前ADC值和治疗2个月肿瘤最大径变化率呈负相关(r=-0.658,P<0.05)。治疗15 d 和治疗1个月的ADC值与治疗2个月的肿瘤最大径变化率均呈正相关(r=0.783、0.676,P<0.05),ADC值增加率分别为(40.24±3.24)%、(44.03±2.51)%。

表3 不同治疗时间的ADC值、eADC值和肿瘤最大径的比较
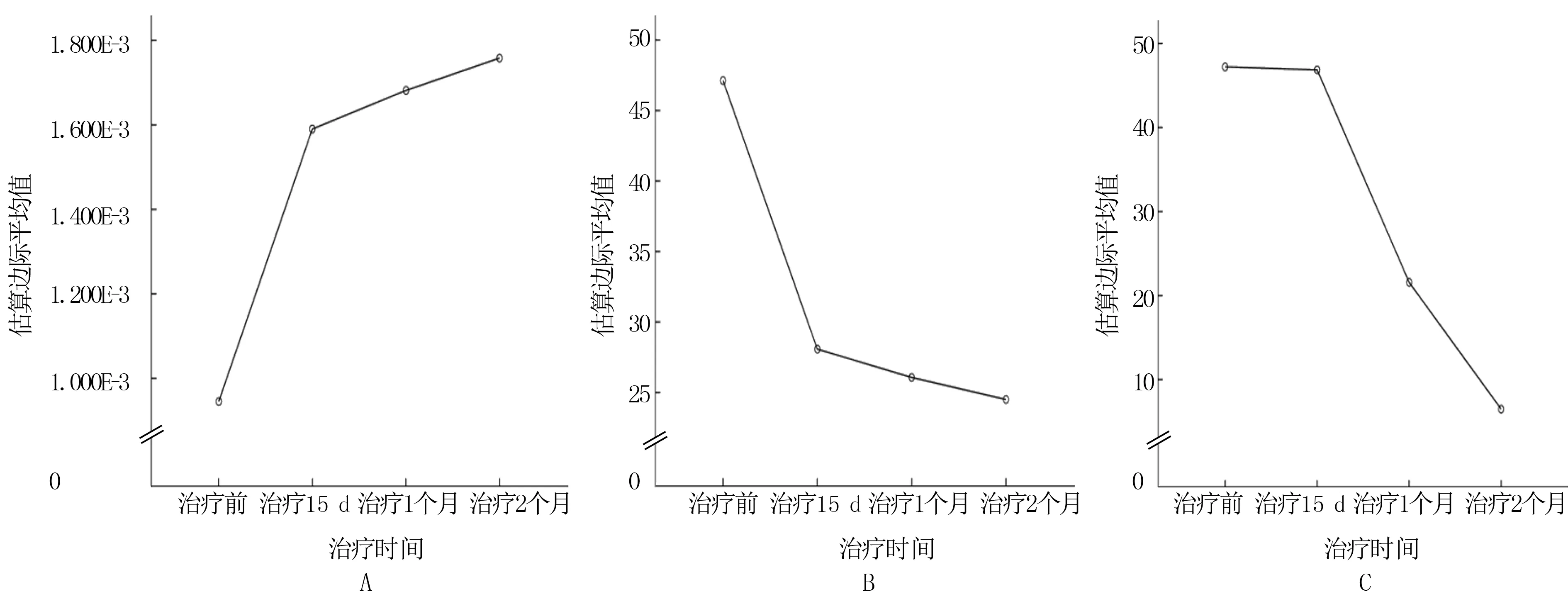
A为ADC值的估算边际平均值;B为eADC值的估算边际平均值;C为肿瘤最大径的估算边际平均值。

A~C为宫颈鳞癌病人矢状位T2WI图像,该病人属于PR组。A、B、C分别为治疗前、治疗15 d、治疗2个月时的肿瘤图像(箭头所示),治疗15 d的肿瘤与治疗前相比形态学未见明显变化,治疗2个月的肿瘤形态学发生明显改变。D~L为宫颈鳞癌病人的DWI图、eADC图及ADC图,该病人属于CR组。D~F、G~I、J~L分别为宫颈癌治疗前、治疗15 d、治疗1个月的DWI图、eADC图及ADC图(紫色圆圈为ROI)。eADC值分别为0.563、0.259、0.250;ADC值分别为0.718、1.691、1.732×10-3mm2/s。DWI图示肿瘤逐渐减小、信号逐渐减低,eADC值逐渐降低,ADC值逐渐升高;ADC图示肿瘤部分的绿色区域越来越小,反映水分子弥散运动逐渐受限。
3 讨 论
最大可能地杀死肿瘤细胞,还不对正常组织造成损伤,是肿瘤治疗的目标,这就需要有效的监测手段。如今影像学形态的测量只能在晚期评估肿瘤的治疗效果,已不能满足临床的需要[10]。DWI作为较为重要的功能成像方法之一,在预测、监测肿瘤疗效方面有一定潜能[11-14]。
肿瘤组织与正常组织间水分子扩散程度不同,是DWI分辨肿瘤与正常组织的理论基础[15]。组织细胞的密度与DWI上信号强度及ADC值的大小密切相关[16-18],NAGANAWA等[17]的研究结果表明,宫颈癌的ADC均值低于正常宫颈。恶性肿瘤细胞增殖旺盛,限制水分子在肿瘤内部的运动,导致细胞弥散受限、ADC值降低[19-20],这是造成其与正常组织间差异的主要原因。肿瘤经过有效治疗可以使癌细胞坏死、凋亡,细胞的密度相对减小,在DWI图像上显示信号降低,其ADC值升高,向正常组织靠近[21-22]。研究表明,治疗后组织的功能变化比形态变化要早[23-24],因此,在肿瘤大小有所改变之前通过DWI来评价疗效是可行的。ADC可量化组织信号的衰减程度,间接反映组织的微观结构,且ADC值与组织扩散能力呈正相关[25-26]。DWI偶可受T2透射效应的影响而呈高信号,此时ADC值并不会降低,易造成假阳性。eADC为反映组织弥散的新指标[27-28],由DWI信号除以SE EPI T2WI所得。T2透射效应一般不影响eADC值[25,29-30]。
本研究结果显示,宫颈癌病人在治疗15 d时ADC值明显升高,eADC值明显降低,而肿瘤最大径在此时缩小不明显,说明ADC值及eADC值的变化早于肿瘤体积的变化。随着治疗进行ADC值继续上升,CR组和PR组病人治疗15 d、1个月、2个月时的ADC值与治疗前相比,差异均有显著性。用治疗前ADC值做ROC曲线分析预测肿瘤能否CR,根据结果可以预测,治疗前ADC值≤0.891×10-3mm2/s,治疗2个月后肿瘤能够CR;反之,则肿瘤难以CR。此外,肿瘤最大径的变化率与治疗前ADC值呈负相关,并且治疗前CR组病人ADC值低于PR组。
综上所述,ADC值及eADC值不仅可以预测宫颈癌放化疗的早期疗效,还可以动态监测放化疗的治疗效果,故DWI检查对评估宫颈癌放化疗效果具有一定的临床实用价值。但本研究也存在一定的局限性,如样本量较小,人工对肿瘤最大径进行测量存在主观性,会直接导致分组误差,今后的研究将在加大样本量的基础上改进肿瘤测量标准,以获得更准确的结果。

