富血小板纤维蛋白在牙周炎治疗中的应用研究
李峥 李荣华
天津市第一中心医院口腔科 300192
0 引 言
慢性牙周炎是由口腔菌斑生物膜中细菌微生物及其代谢产物所引起的牙周软组织、牙周膜及牙槽骨组织的慢性进行性感染性疾病[1],也是我国成人最易患的口腔疾病。牙周炎可使患者生理上出现不同程度的牙周袋、牙周附着水平(attachment level,AL)进行性丧失,继而导致牙槽骨吸收。其临床症状表现为牙龈不同程度出血、牙周袋内溢脓、口腔内伴有异味等,最终可出现牙齿松动、移位,甚至脱落。因此,慢性牙周炎是导致我国中老年人群牙齿缺失的重要原因之一,不但严重威胁着人们的口腔健康及全身健康,而且降低了人们的生活质量。
传统牙周炎基础治疗虽可控制炎症,减慢疾病发展进程,但使牙周组织获得有效再生却比较困难。若想获得满意的牙周组织再生,需使用引导组织再生术(guided tissue regeneration,GTR)、植骨术和联合运用生长因子等牙周手术相结合的办法,以期促进牙周组织获得性附着再生。富血小板纤维蛋白(platelet-rich fibrin,PRF)中含有大量的血小板、白细胞及细胞因子,具有纤维蛋白空间支架结构,可重建缺损的牙周组织,使其结构和功能得以恢复,进而达到促进牙周组织再生的治疗效果[2]。
本研究运用PRF 膜联合植骨进行牙周手术,通过比较手术前后反映口腔牙周健康指标的变化,为PRF膜在牙周炎治疗中的应用提供理论依据和支持。
1 资料与方法
1.1 临床资料
选取2018 年12 月至2019 年8 月于天津市第一中心医院口腔科就诊并诊断为慢性牙周炎的患者20 例,年龄范围18~55 岁,均经全口洁治术、刮治术和根面平整术等牙周基础治疗,且术后8 周复查发现虽牙周感染得到控制,但仍伴有垂直型骨缺损,需进行牙周手术治疗。按照随机数字表法将患者分为试验组和对照组,每组10 例。本研究已通过天津市第一中心医院伦理委员会的审查(批号为2018NO90KY),所有入组患者均签署知情同意书。
入组标准:①患有牙周炎的单根牙,已完成牙周基础治疗,牙周组织恢复8 周以上,复诊时无菌斑生物膜;探诊深度(probing depth,PD)>5 mm,且具有>3 mm 的三壁骨缺损的骨内袋;患牙取牙周袋最深位点。②无全身性系统性疾病。③拟手术前3 个月内,患者未曾服用任何影响凝血功能的药物。④患者均签署知情同意书,并能配合后期临床随访。
排除标准:①存在根分叉病变的多根牙。②患有系统性疾病,包括血液病、糖尿病等。③围孕产期的育龄女性和吸烟患者。
1.2 主要材料与仪器
专用无菌一次性使用人体静脉血样采集容器(不含任何抗凝药物)(浏阳市三力医用科技发展有限公司),15 mm 牙周探针(上海康桥齿科医械厂),骨填充材料Geistlich Bio-Oss(松质骨小颗粒,直径0.25~1.00 mm)(瑞士盖士制药有限公司)。
Spinplus-6 纤维蛋白离心制造机(天津卓晶科技发展有限公司),Planmeca ProX 口腔内成像X 射线机(芬兰Planmeca 公司),Sirona XIOS-Plus 读片系统(德国Sirona 公司)。
1.3 方法
1.3.1 PRF 膜的制备
PRF 膜的制备步骤见图1。手术开始时,先对患者进行静脉采血20 ml,置于专用无抗凝剂的离心管中,此过程各环节均需严格遵守无菌原则。迅速将离心管放入纤维蛋白离心制造机中,5 000 r/min离心12 min,使血液分为3 层:下方为红细胞基底层,中间为PRF 凝块层,顶部为无细胞血浆层。因为不含抗凝剂,中间层内含富血小板三维纤维蛋白基质。将顶层液体过滤后,取出PRF 凝块置于无菌带孔置物板上,并用无菌金属板轻压,使之成为薄膜状,静置备用。
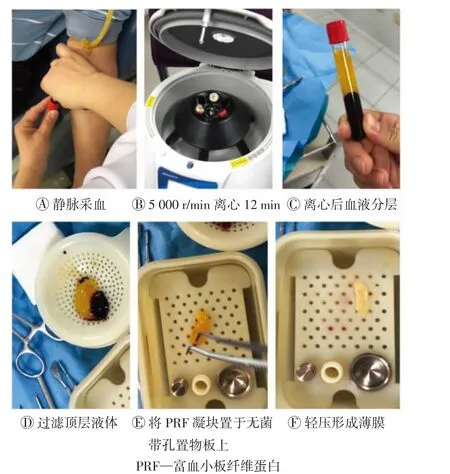
图1 PRF 膜的制备步骤
1.3.2 手术方法
术前嘱患者含漱质量浓度为1 g/L 的西吡氯胺溶液1 min。常规术区消毒,包头铺巾,局部麻醉。在术区患牙龈缘做内斜及沟内切口,范围可扩展至两侧邻牙,然后向根方做垂直附加切口,切开黏骨膜瓣。翻瓣要求是将全厚黏骨膜瓣翻至骨缺损边缘,可显露2 mm 健康骨皮质处,以便放置PRF 膜,且使术后能有充足的牙龈组织瓣严密覆盖创面,避免PRF 膜暴露。然后,彻底清创牙槽骨骨缺损区,包括去除部分游离死骨片,搔刮炎性肉芽组织,行根面牙骨质平整,消除不利于创面愈合的锐利的牙槽骨骨尖及骨突,并冲洗干净创面。
试验组在充分清创后的根周骨缺损区填充Bio-Oss 骨粉,表面覆盖自制的PRF 膜;对照组则仅在充分清创后的根周骨缺损区填充Bio-Oss 骨粉。然后将手术翻开的牙龈全厚黏骨膜瓣复位,间断缝合固定。术后1 周拆线,对患者进行菌斑控制方法宣教,随后定期复诊。
1.3.3 临床观察指标
分别于术前、术后6 个月测量手术牙齿同一骨缺损位点处的下列指标,用牙周探针(20~25 g 力)进行牙周探诊。
(1)PD:指牙周袋底至牙龈缘之间的距离。
(2)AL:指牙周袋底至釉牙骨质界之间的距离。
(3)出血指数(bleeding index,BI):牙龈完全健康,无炎症、出血计0 分;牙龈颜色发红,但探诊不出血计1 分;牙龈颜色发红,探诊可见点状出血计2 分;牙龈颜色发红,探诊出血可沿牙龈缘扩散计3 分;牙龈颜色发红,探诊出血且流满并溢出龈沟计4 分;牙龈颜色发红,自动出血计5 分。
(4)骨缺损(imaging bone defect,IBD):采用平行投影法拍摄牙根尖片,测量骨缺损处牙槽嵴顶至牙槽骨缺损底部的距离。
1.4 统计学方法
采用SPSS 26.0 统计学软件处理数据。PD、AL和IBD 虽为连续计量资料,但总体为小样本,不服从正态分布,以M(P25,P75)表示;BI 为等级资料,以例(%)表示。同组手术前、后差异比较采用两个相关样本Wilcoxon 检验;相同时期的试验组与对照组差异比较采用Mann-WhitneyU检验。以P<0.05 为差异具有统计学意义。
2 结 果
所有入组患者均配合完成试验,无中途退出,且治疗后均获得理想治疗效果。
2.1 软组织结构评价
由表1~3 可知,术前对照组与试验组患者之间软组织临床观察指标PD、AL 和BI 比较,差异均无统计学意义(均P>0.05),表明术前两组患者的牙周基础水平相似;术后6 个月两组患者的PD、AL 均较术前明显降低,差异均具有统计学意义(均P<0.05);术后6 个月试验组的PD 和AL 均优于对照组,差异均具有统计学意义(均P<0.05),而两组间BI 比较,差异无统计学意义(P>0.05)。

表1 术前与术后6 个月两组慢性牙周炎患者的PD 比较[mm,M(P25,P75)]
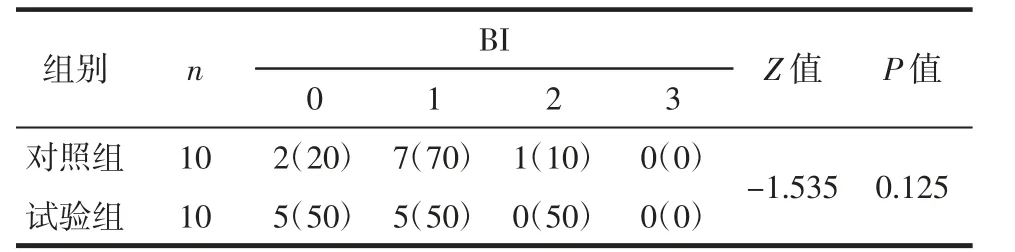
表3 术后6 个月两组慢性牙周炎患者的BI 比较[例(%)]
2.2 骨组织评价
由表4 可知,术前对照组与试验组患者的IBD比较,差异无统计学意义(P>0.05),表明术前两组患者的牙周基础水平相似;与术前相比,术后6 个月两组均有不同程度的骨再生(均P<0.05),但两组间差异无统计学意义(P>0.05)。

表4 术前与术后6 个月两组慢性牙周炎患者的IBD 比较[mm,M(P25,P75)]
3 讨 论
3.1 PRF 用于牙周炎治疗的组织学特点
慢性牙周炎患牙所发生的牙齿周围软、硬组织的缺损,往往是因口腔细菌病原体入侵所致[1]。PRF内含有丰富的白细胞和巨噬细胞等,可长时间有效发挥抗炎作用,从而使牙周组织得以新生[3]。有研究结果表明,PRF 膜能提供纤维蛋白网,纤维蛋白网是含有生物活性细胞、生长因子的三维支架结构,故可快速、有力地重新修复组织[4]。与第一代血小板浓缩物——富血小板血浆相比,第二代血小板浓缩物——PRF 无抗凝剂,可持续、稳定、高质量地释放细胞因子,从而调节细胞迁移、分化,并可促进血管形成和组织再生[5]。采用低速离心机制备的PRF 在信号传递、生物分子支架及血液供给方面接近牙周组织再生微环境体系的理想状态,可促进再血管化和牙周组织愈合,还可与药物或其他细胞因子联合使用,有效促进牙周组织的再生[6]。

表2 术前与术后6 个月两组慢性牙周炎患者的AL 比较[mm,M(P25,P75)]
牙周炎可造成骨组织破坏,包括牙骨质和牙槽骨两方面。PRF 可促进成骨细胞分化及实验组的骨组织修复。李玮等[7]在体外实验中发现,PRF 可加速自体人牙周膜成纤维细胞的迁移并促进成骨分化,在牙周组织再生中具有广阔的临床使用前景。董凯等[8]发现,PRF 可加速小鼠成骨细胞MC3T3-E1 的增殖、分化,使细胞骨架的排列和伸展更快。张悦等[9]的研究结果显示,在新西兰大白兔骨缺损模型治疗中,Bio-Oss 骨粉合并PRF 组在术后4、8 和12 周时骨形成蛋白2、骨保护素和核因子κB 受体活化因子配体的表达量均逐渐降低,差异均具有统计学意义(均P<0.05);在术后8 周时可出现部分成熟骨,在术后12 周时可出现较高成熟度的骨板。该结果表明Bio-Oss 骨粉合并PRF 可加快骨改建,促进牙周成骨。由此可见,PRF 是符合牙周组织工程学研究的理想材料,其既含有种子细胞,又是生物支架,还可分化替代病损组织。
3.2 PRF 用于牙周炎治疗的临床应用研究
在本研究中,将PRF 膜和Bio-Oss 骨粉联合应用治疗患有牙周病损的三壁骨袋,术后定期做牙周维护,并以仅使用Bio-Oss 骨粉的病例作为对照,观察半年评估疗效。结果显示,PRF 可促进牙周组织再生,对软组织的再生促进效果显著,这与以下国内外其他学者的研究结果相似[10-16],但PRF 对骨组织的作用有待进一步的探讨。
雷朝锋等[10]的研究结果显示,在治疗慢性牙周炎伴有弧形骨缺损的病例时,试验组(使用PRF 膜联合Bio-Oss 骨粉)的PD 平均降低3.2 mm,AL 增加3.4 mm,术后牙周组织的恢复情况明显优于对照组(仅充填Bio-Oss 骨粉)。PRF 膜能加速牙周支持组织的愈合,但其对牙周骨组织形成作用有限。吕欣欣等[11]的研究结果显示,GTR 手术使用PRF 膜并植骨的试验组与GTR 手术仅植骨的对照组相比,术后半年PD、AL 和BI 均有明显改善,尤其是AL 这方面,试验组较对照组疗效明显。上述结果表明PRF 可促进牙周炎患者牙周组织的再生,尤其是软组织的再生。
国外学者在PRF 对牙周缺损修复再生治疗方面的研究结果显示,手术植骨联合使用PRF 的治疗效果明显优于单独使用的效果,临床参数PD 减少,AL 增加。Chandradas 等[12]根据临床和影像学参数评价PRF 联合或不联合骨移植(脱矿骨基质移植)治疗骨内缺损的疗效。与单纯开放皮瓣清创术(open flap debridement,OFD)相比,PRF 能改善骨内缺损的临床和放射学参数。脱矿骨基质和PRF 的加入使得AL 和影像学上骨缺损填充水平均有所增加。魏雪等[13]通过Meta 分析系统评价了脱钙冻干同种异体骨(decalcified freeze-dried bone allograft,DFDBA)联合富血小板衍生物治疗牙周骨内缺损的效果。9 篇临床随机对照试验文献被纳入分析,结果发现DFDBA 联合富血小板衍生物治疗牙周炎引起的骨缺损,可减少短期组(术后6 个月)和长期组(术后12~18 个月)的PD,增加短期组和长期组的AL 和骨充填高度,并减少长期组的牙龈退缩,差异均具有统计学意义(均P<0.05),表明DFDBA 联合富血小板衍生物能提高牙周再生治疗的效果。Paolantonio等[14]发现术后1 年,与对照组(釉质基质衍生物与自体骨移植,22 例患者)相比,试验组(PRF 联合自体骨移植,22 例患者)的AL、放射学骨缺损水平增加,PD 减少。Stavropoulos 等[15]纳入了30 项随机对照试验,系统评价了在移植、GTR、釉质基质衍生物作为单一疗法、联合疗法和/或辅助使用血源性生长因子构建物或仅使用OFD 治疗3~20 年后的数据资料。结果发现与OFD 相比,骨内缺损的牙周再生/重建治疗通常会导致残余PD 较浅,AL 增益较大,中期(3~5 年)和长期(5~20 年)的牙齿存活率较高。总的来说,就残余PD 较浅和AL 增益较大而言,联合疗法比单一疗法更有效。一项关于PRF 用于治疗牙周病骨内缺损的系统评价和荟萃分析结果显示,与单独使用OFD 相比,PRF 与OFD 联合使用可明显改善骨内缺损的临床统计结果(PD、AL 和放射性骨填充),与OFD/植骨结果相当[16]。PRF 与骨移植物或小生物分子的结合可能为牙周组织再生提供了临床应用价值,但还需在组织学水平上进一步研究PRF。
4 结 论
综上所述,牙周新附着和骨组织再生才能使牙周组织真正获得新生。本研究通过在牙周手术时使用植骨联合PRF 膜的方法,阻止牙龈结缔组织与根面接触,引导牙周膜细胞在根面上形成新的牙骨质,并埋入牙周膜纤维,可获得更多的临床新附着,有效降低患者的PD。但对于骨组织再生方面的评价,可通过扩大样本量、增加骨密度测量等方法进行进一步研究。
利益冲突所有作者均声明不存在利益冲突

