对甲基苯甲醚合成体系的热力学分析
舒军政,王兴富,张智芳*,吕 波,高雯雯,庞美娟
(1.榆林学院化学与化工学院,陕西 榆林 719000;2.榆林市绿色化学与化工过程绿色化重点实验室,陕西 榆林 719000;3.神木富油能源科技有限公司,陕西 榆林 719000)
对甲基苯甲醚具有紫罗兰的花香和依兰的芬香,天然存在于卡南加依兰油中,在医药、香料及有机中间体合成等领域中应用广泛[1]。
目前,合成对甲基苯甲醚的方法主要为对甲苯酚和甲基化试剂进行反应,如碘甲烷、硫酸二甲酯(DMS)、碳酸二甲酯(DMC)和甲醇等。其中碘甲烷由于其价格昂贵、操作要求严格等限制而不能广泛使用。DMS是目前工业上普遍使用的甲基化试剂,然而由于DMS本身剧毒且副产物硫酸具有强的腐蚀性,逐渐被其他甲基化试剂取代[2]。DMC被称为21世纪的绿色溶剂,其分子结构中含有甲基、甲氧基和羰基活性基团可作为DMS、卤代甲烷等甲基化试剂的替代品,在有机合成中得到了广泛应用[3-4],薛冰等[4]用DMC试剂合成了对甲基苯甲醚;由于甲醇分子中含有甲基、甲氧基、羟基等活性基团,且来源广泛和价格低廉,所以成为工业化合成对甲基苯甲醚的发展方向[5]。由于DMC和甲醇都含有甲基,都有与对甲基苯酚反应生成对甲基苯基醚的可能,但相关热力学分析并未见相关文献报道。本研究从热力学的角度,采用Benson基团贡献法,综合计算了DMC和甲醇作为甲基化试剂时分别与对甲基苯酚反应合成对甲基苯甲醚的热力学数据,计算了反应过程中焓变、吉布斯自由能和平衡常数3个变量与温度和压力的关系,以期为对甲基苯甲醚合成路线和工艺的选择提供理论指导。
1 反应原理与热力学计算
1.1 反应原理
以DMC和甲醇分别作为甲基化试剂合成对甲基苯甲醚的反应原理如反应式(Ⅰ)和(Ⅱ)所示。
反应式(Ⅰ):
反应式(Ⅱ):
1.2 对甲基苯酚和对甲基苯甲醚的标准生成焓和绝对熵的计算
1.2.1 计算方法
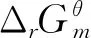
(1)
(2)
Cp,m=∑niCpi,m
(3)
式中,ni为集团个数;δ为分子对称数;η为分子光学异构体
1.2.2 计算结果
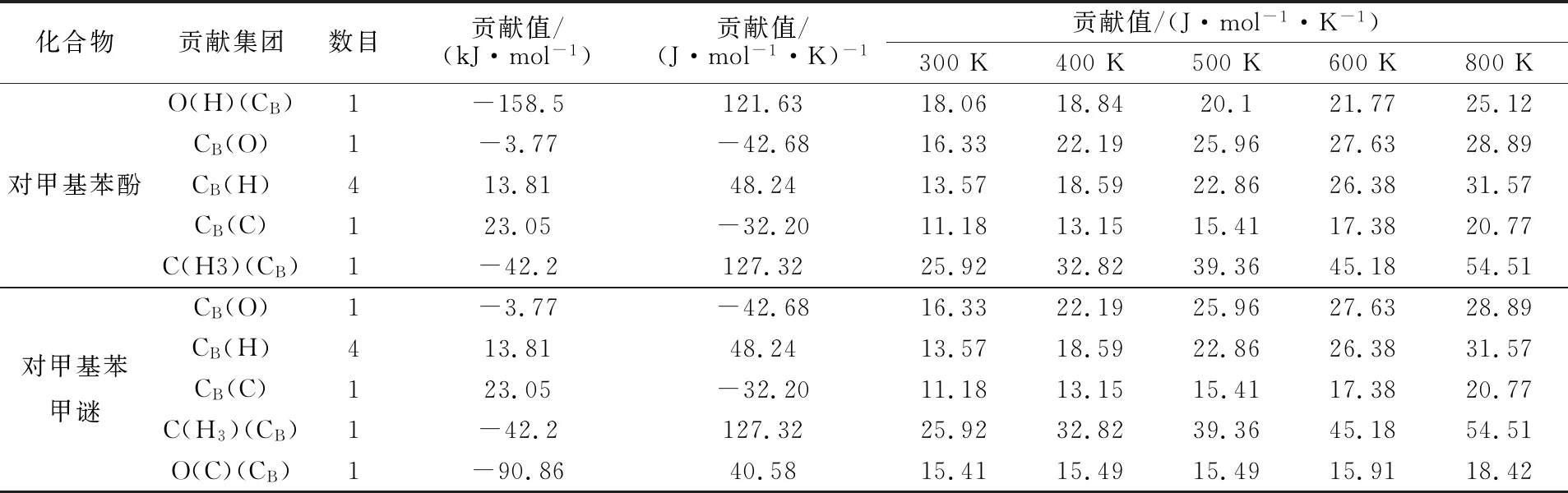
表1 对甲基苯酚、对甲基苯甲醚、碳酸二甲酯标准热力学集团贡献值
根据文献或者手册[11-15]查的碳酸二甲酯、甲醇、二氧化碳、水的热力学数据、和见表2。
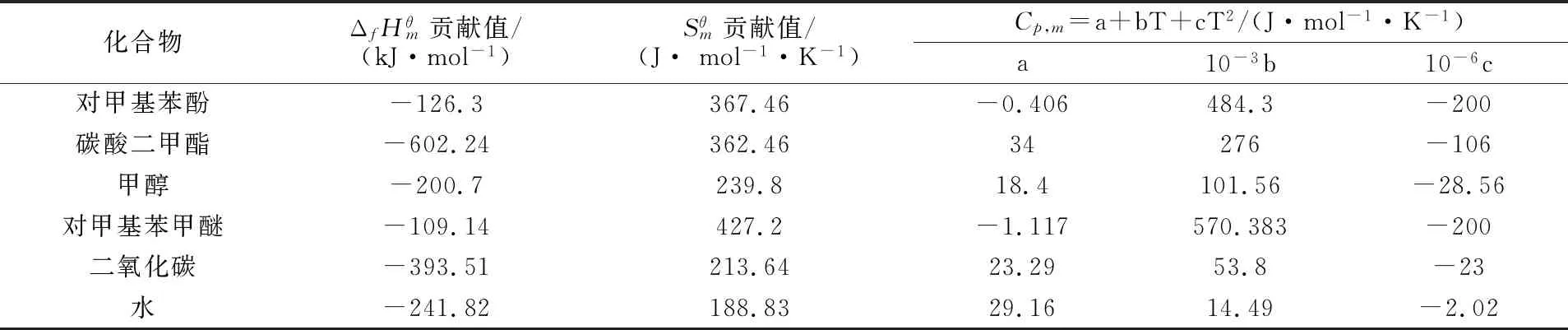
表2 对甲基苯酚、对甲基苯甲醚、碳酸二甲酯、甲醇、二氧化碳、水
1.3 恒压条件下反应(Ⅰ)和(Ⅱ)的ΔrHm、ΔrGm和lnK的计算
由ΔrGp,m=Δa+ΔbT+ΔcT2得,反应(Ⅰ)和(Ⅱ)的ΔrGp,m和T的关系式:
ΔrCp,m=6.979-34.557×10-3T+54.44×10-6T2(J·mol-1·K-1)
(4)
ΔrCp,m=10.049-0.987×10-3T+26.54×10-6T2(J·mol-1·K-1)
(5)
根据基尔霍夫(Krihhoff)定律:(dΔrHm/dT)p=ΔrCp,m)积分后得反应(Ⅰ)和(Ⅱ)ΔrHm和T的关系式:
(6)
(7)
由表2各物质的标准摩尔生成焓,可计算反应在298.15 K时的焓变值,即:
当T=298.15 K时,反应(1) ΔrHm=25.19(kJ/mol);反应(2)ΔrHm=-23.96(kJ/mol)代入(8)和(9)得到ΔrHm和T的关系式:
(8)
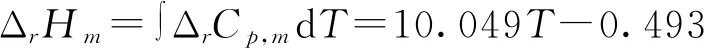
(9)
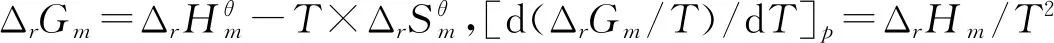
ΔrGm=24 163.06-6.98TlnT+17.27×10-3T2-9.075×10-6T3-98.645T
(10)
ΔrGm=-27 146.797-10.049TlnT+0.493 5×10-3T2-4.425×10-6T3+59.2T
(11)
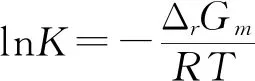
(12)
1.4 变温和变压条件下反应(Ⅰ)和(Ⅱ)的ΔrGm和lnK的计算
由下式可计算各反应的吉布斯自由能和平衡常数随压力与温度的变化。
(13)
其中,ng为气态物质的物质的量(mol)
对于恒定的温度:
ΔrGm(P)=ΔrGm(Pθ)+RTln(P/Pθ)
(14)
变温变压条件下的平衡常数lnK可由公式(12)求得。
2 结果与讨论
2.1 恒压条件下反应的热力学分析
2.1.1 反应温度对焓变的影响
在标准大气压下,反应(Ⅰ)和反应(Ⅱ)的焓变与温度的关系如图1所示。
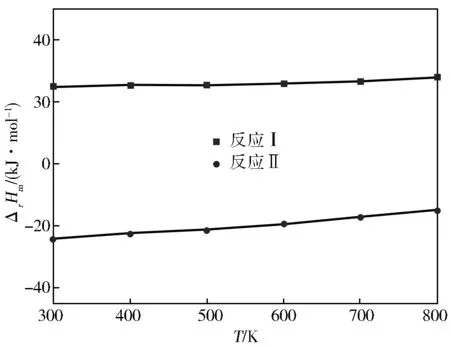
图1 随T的变化曲线
由图1可知,在300~800 K内,反应(Ⅰ)焓变值均大于零且随着温度的升高而逐渐增大,说明该反应为吸热反应,所吸收的热量随着温度的升高而增多;反应(Ⅱ)焓变值均小于零且随着反应温度的升高而增大,说明该反应为放热反应,所放出的热量随着温度的升高而减小,温度对两个反应的热效应都有影响。
2.1.2 反应温度对自由能变的影响
在标准大气压下,反应(Ⅰ)和反应(Ⅱ)的吉布斯自由能变与温度的关系如图2所示。
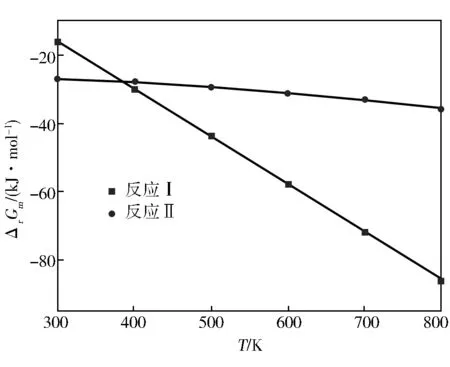
图2 随反应温度T的变化曲线
由图2可知,在300~800 K反应(Ⅰ)和(Ⅱ)的吉布斯自由能变均为负值,说明反应在热力学上是允许进行的。随着温度的升高而减小,且(Ⅰ)下降速度较快,说明反应(Ⅰ)受温度的影响较大,在合成对甲基苯甲醚过程中反应(Ⅰ)对温度这一条件要求严格。
2.1.3 反应温度对平衡常数的影响
由图3可知,在300~800 K反应(Ⅰ)的平衡常数随着温度的升高而增加,升高温度有利于反应正向进行;反应(Ⅱ)的平衡常数随着温度的升高而减小,升高温度有不利于反应正向进行。从合成对甲基苯甲醚的经济型考虑,对甲基苯酚与甲醇反应比与DMC反应成本更低,经济效益更好。
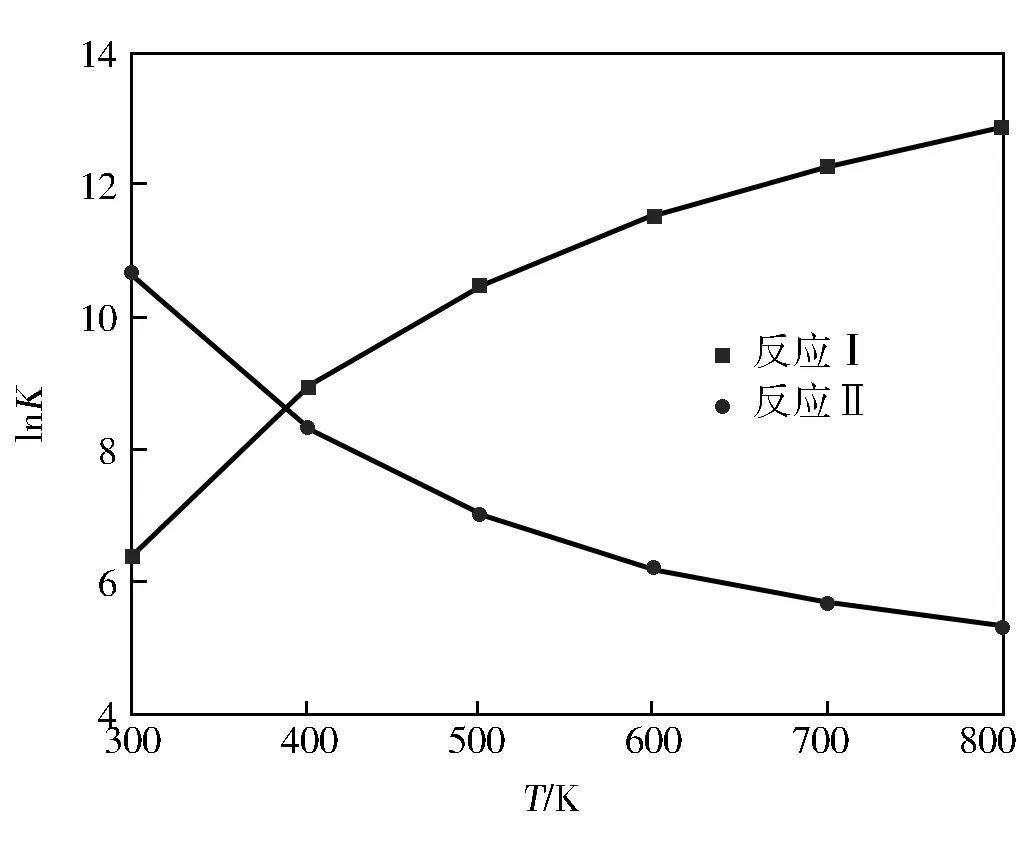
图3 lnK随T的变化曲线
2.2 变压条件下反应的热力学分析
2.2.1 反应压力对吉布斯自由能的影响
由反应式(Ⅰ)和(Ⅱ)可知,对甲基苯酚与DMC和甲醇反应后气体分子数目增多,故加压不利于反应的进行。在300~800 K和5~30 MPa范围内反应(Ⅰ)和反应(Ⅱ)的变化曲线分别如图4和图5。
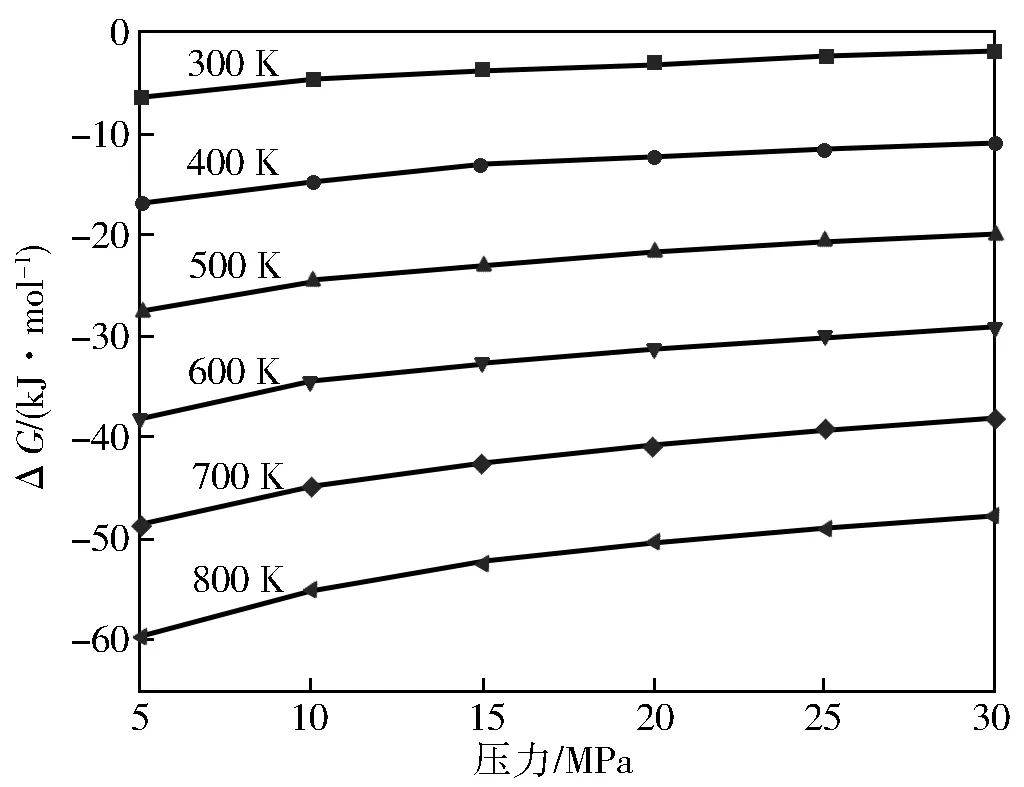
图4 反应(Ⅰ)的随压力的变化曲线
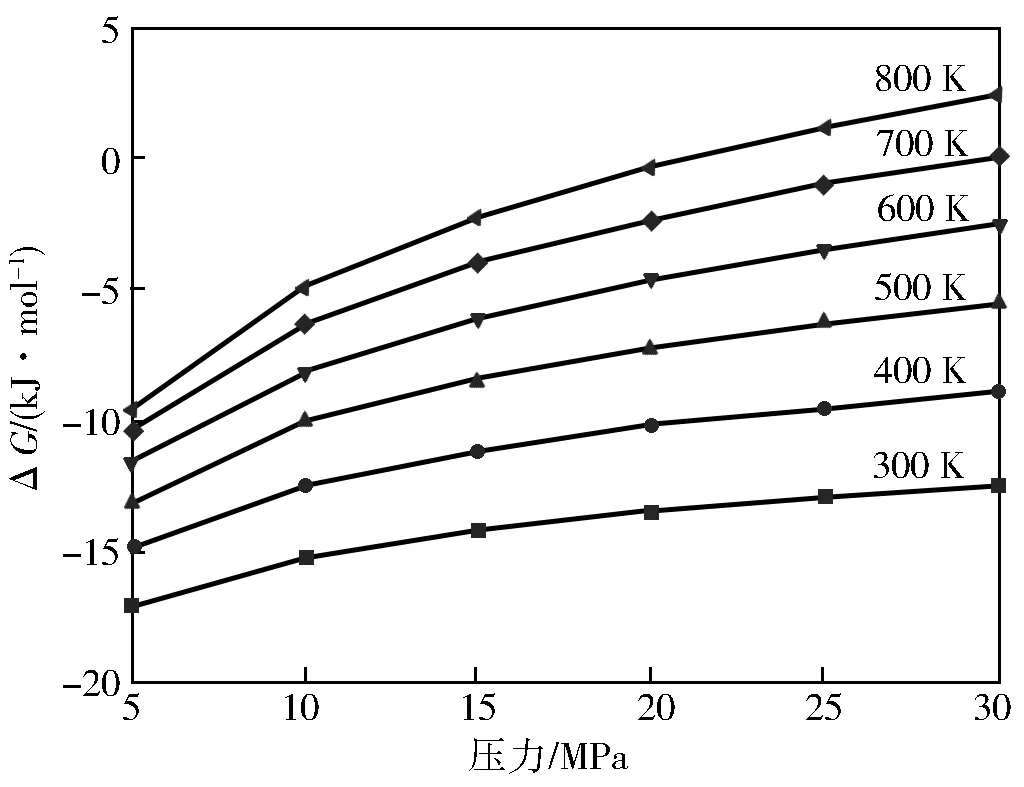
图1 反应(Ⅱ)的随压力的变化曲线
由图4、图5可知,在同一温度下,随着压力的增大反应(Ⅰ)和(Ⅱ)都有增大,这就表明高压对于这两个反应是不利的,在同一压力下,随着温度的升高反应(Ⅰ)的不断减小,反应(Ⅱ)的不断增大。因此,在压力和温度一定的情况下,反应(Ⅰ)比反应(Ⅱ)生成对甲基苯甲醚稍有优势。
2.2.2 反应压力对平衡常数的影响
在300~800 K和5~30 MPa范围内反应(Ⅰ)和反应(Ⅱ)的lnK变化曲线分别如图6和图7。
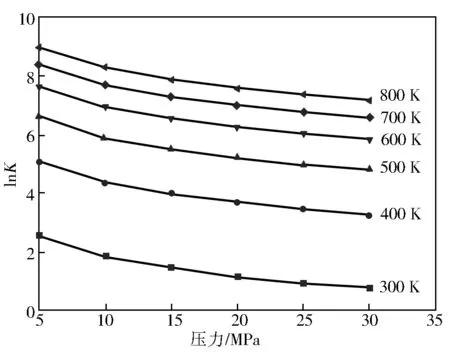
图6 反应(Ⅰ)的lnK随压力的变化曲线
由图6、图7可知,随着压力的增加,各反应的平衡常数不断减小,由此可知增大压力对合成对甲基苯甲醚是不利的。在同一压力下反应(Ⅰ)的平衡常数不断增大,反应(Ⅱ)的平衡常数不断减小,说明在无择型催化剂的条件下,高温低压有利用反应(Ⅰ)合成对甲基苯甲醚,低温低压有利用反应(Ⅱ)合成对甲基苯甲醚。
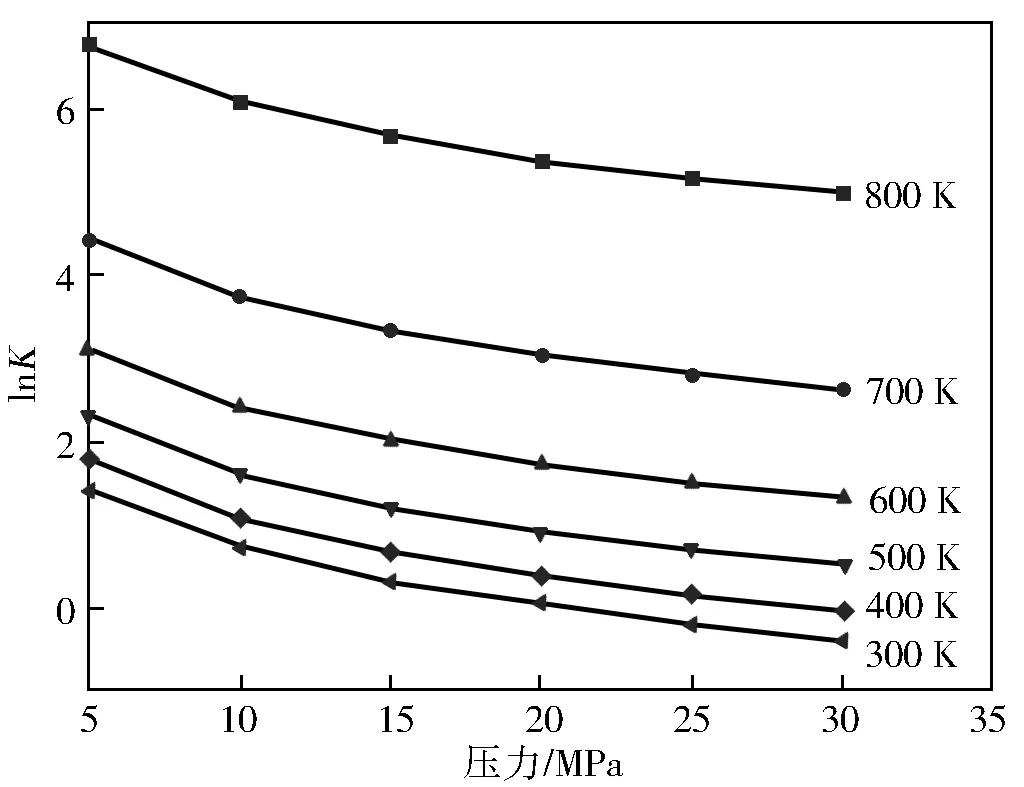
图7 反应(Ⅱ)的lnK随压力的变化曲线
3 结 论
a.采用Benson基团贡献法对DMC和甲醇分别与对甲基苯酚反应合成对甲基苯甲醚进行了热力学计算和分析,结果表明:在标准状态下,对甲基苯酚与DMC为吸热反应、与甲醇为放热反应,都可以自发进行。随着温度升高,反应(Ⅰ)的平衡常数增加,反应(Ⅱ)的平衡常数减小,即升高温度只有利于反应(Ⅰ)进行。
b.在压力和温度同时改变时, 通过热力学计算,比较全面地分析了DMC和甲醇分别与对甲基苯酚反应合成对甲基苯甲醚的反应体系。结果表明:在300~800 K和5~30 MPa条件下,增大反应压力,该反应的吉布斯自由能均略有增加,说明高压不利于各个反应的进行;在同一压力下,当温度升高时反应(Ⅰ)平衡常数增大,反应(Ⅱ)平衡常数减小,说明高温低压有利用反应(Ⅰ)、低温低压有利用反应(Ⅱ)合成对甲基苯甲醚。
c.从热力学角度分析,甲醇与对甲基苯酚为放热反应,反应过程要求较低,成本较低;从原料获得角度分析,甲醇合成路线多,应用广泛,所以甲醇可作为一种优于DMC的甲基化试剂。
符号说明
ΔrHm—反应的焓变(生成物与反应物的焓值差);
ΔrGm—反应的吉布斯自由能(表明状态函数G是体系所具有的在等温等压下做非体积功的能力,是反应进行方向和方式判据);
lnK—平衡常数(反应达到平衡状态后,反应物与生成物浓度系数次方的比)。

