车用甲醇裂解催化剂的研究进展*
王北辰,蒋炎坤
(华中科技大学能源与动力工程学院,湖北武汉 430074)
随着我国经济社会的快速发展,国内对汽车的需求量呈现爆发式增长,我国汽车保有量也逐年增加。同时,机动车所依赖的石油作为非可再生资源,其储量却十分有限。而当前车用燃料的主导能源是石油,占交通能源需求的94%[1],汽油作为发动机燃料燃烧时,会产生CO、非甲烷烃、NOx和细颗粒物等对人体有害的物质[2]。因此,各国学者在进行更高效的尾气净化研究的同时,也在寻求一种新型替代能源,实现发动机高效清洁燃烧成为一个重要的研究方向。
发动机代用燃料有氢气、一氧化碳、乙醇和甲醇等,其中甲醇是一种理想的发动机代用燃料[3],其燃料来源广、无污染且价格便宜,在我国可通过丰富的煤炭资源制取,自然降解速度快,即使发生燃料泄漏,也不会影响周围环境,但甲醇直接作为车用燃料,主要存在冷启动困难且燃料本身存在溶蚀和胀大效应,因此,在甲醇利用中,解决发动机冷启动、污染及腐蚀问题是当前研究的重点和难点。通过利用发动机尾气余热加热液态甲醇,使其通过催化剂裂解产生H2和CO等裂解气进入发动机燃烧,有效替代液态甲醇直接作为燃料燃烧,正成为一种新型解决方案,甲醇裂解气主要为H2和CO,其作为发动机代用燃料主要优势为:①理论循环接近奥托循环,是一种理想循环;②燃烧产物清洁,若完全燃烧,主要为H2O和CO2,对环境无污染;③充分利用发动机尾气余热,有效提高发动机整体热效率。
甲醇裂解过程中会产生部分副反应,副反应的发生会影响发动机的燃烧,降低发动机热效率,因此针对提高甲醇裂解的裂解率及选择性,重点分析了甲醇裂解机理及现有国内外常用的甲醇裂解的裂解率及选择性。
1 催化机理
甲醇裂解除了产生H2和CO外,还会在催化剂表面发生一系列副反应,产生副产物甲酸、甲酸甲酯、二甲醚(DME)、CO2、CH4和甲醛(HCHO)等,副产物的产生可能会造成发动机动力性和经济性下降,CO、HC化合物和碳烟颗粒排放量增加。以最常见的Cu基催化剂为例,从反应机理上研究至少包含十几或几十个平行或串联的反应步骤,随着现代谱学和表面科学的深入发展,研究者对甲醇裂解催化剂的认识更加深刻,主要形成了三大体系,即Cu基催化剂、Ni基催化剂和贵金属催化剂。
1.1 活性中心
针 对Cu基 催 化 剂,Yong等[4]制 备Cu0.5Zn0.5Mn2O4催化剂,主要活性位点位于Mn上,Cu和Mn共同提升了催化剂的活性,因为Cu强大的吸氢能力,可以为Mn提供氢源,使Mn作为活性位点不断裂解甲醇。其中,氧基和甲酸盐在纯金属和金属氧化物上的反应顺序由大到小为:Cu,MnO,ZnO。Li等[5]制备CuAl2O4催化剂,Cu是主要的活性位点,其中Cu释放和Cu烧结同时发生,但是发生速率不同,达到50 h时存在拐点,50 h后Cu烧结速率大于Cu释放速率,催化剂活性下降。与通常认知的因温度升高发生烧结不同,此处强调的是随时间延长,Cu烧结速率大于Cu释放速率,最终导致稳定性下降。Choi等[6]研究采用Cu/ZnO/Al2O3催化剂时甲醇裂解的反应机理,认为Cu2+、Cu+和Cu0同时存在,尤其是Cu2+的价态发生改变是甲醇裂解的主要原因,氧化铜中氧的损失是催化剂失活的主要原因,试验过程中没有产生甲醛;当甲醇中加入水分时,重新生产氧化态的铜,进而抑制催化剂失活。
对于Ni基催化剂,Jang等[7]制备了Ni3Al催化剂,Ni和Al均作为活性组分参与反应,在反应温度为527 ℃时,主要通过H2-H2O系统反应生成H2和氢氧化镍。Al与之类似,生成H2和氢氧化铝。
对于贵金属催化剂,Borchert等[8]针对Pd、Co和Pd-Co双金属催化剂开展了研究,针对甲醇裂解反应,催化活性由大到小的顺序为:Pd,Pd-Co,Co,其中Pd为其主要的活性中心。Grant等[9]研究了甲醇在Pt/ZnO(0001)-Zn催化剂上的裂解机理,研究结果表明:Zn和Pt均可作为活性位点,其中,Pt通过修饰Zn表面的缺陷,可以抑制Zn表面的甲醇变为甲氧基,在Pt表面还会部分催化生成H2和CO;程序升温脱附(TPD)表征结果表明CO的解析是Pt位点上的甲氧基脱氢和Zn位点上的甲酸裂解产生的;H2是由2个活性位点上的甲氧基脱氢产生。
1.2 反应路径
针对Cu基催化剂,Ren等[10]针对H2O/Cu(110)进 行 研 究,CH3OH在Cu(110)、H2O/Cu(110)和羟基(—OH)预吸附后的H2O/Cu(110)表面上的反应分解网络见图1。
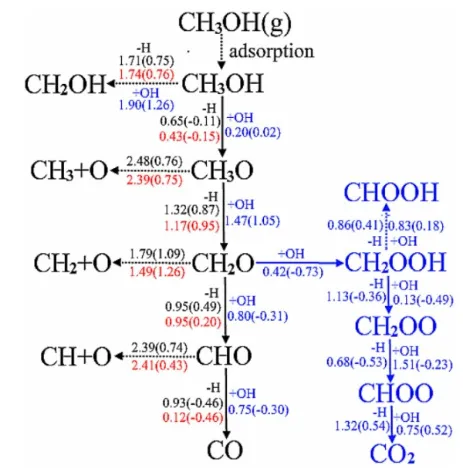
图1 甲醇裂解反应路径
图1 中黑色、红色和蓝色部分分别代表CH3OH在Cu(110)、H2O/Cu(110)和羟基(—OH)预吸附后的H2O/Cu(110)表面上分解的活化能和反应能,以CH3OH→CH3O+H为例,黑色数字0.65(0.11)表示CH3OH在Cu(110)表面脱氢的活化能和反应能分别为0.65 eV和0.11 eV。黑色箭头表示CH3OH在Cu(110)和H2O/Cu(110)表面上的最有可能的分解路径;蓝色和黑色箭头表示CH3OH在OH预吸附的H2O/Cu(110)表面上的2种最可能的分解路径,从热力学和动力学角度分析,在OH预吸附的H2O/Cu(110)表面最有可能发生的反应路径为:CH3OH→CH3O→CH2O→CH2OOH→CH2OO→CHOO→CO2。
Yong等[4]在Cu0.5Zn0.5Mn2O4催化剂上的反应路径如图2所示,该路径详细描述了甲醇发生裂解的全过程,其中,Mn和Cu逐步对C—O键、C—H键和O—H键位发生吸附与解吸附,CO主要是由CHOO-Mn中C—H键发生断裂后生成的,主要反应路径为:CH3OH→CH3O-Mn→CH2O-Mn→CHOO-Mn→CH2OO→OH-Mn+CO,此外CO另一条反应路径为:CH3COOH-Mn→H-Cu+CO。H2主要由H—Cu键发生解吸附后生成,而H—Cu键的形成主要为铜汇集了Mn元素产生的H原子,铜表面的解吸附效应去除了H原子,又进一步促进了甲醇在Mn上的分解。最终影响该催化剂上甲醇裂解的主要因素为:C—H键的强度、甲醛(HCHO)部分氧化时O的有效性和在活性位点上H的解吸附能力等。
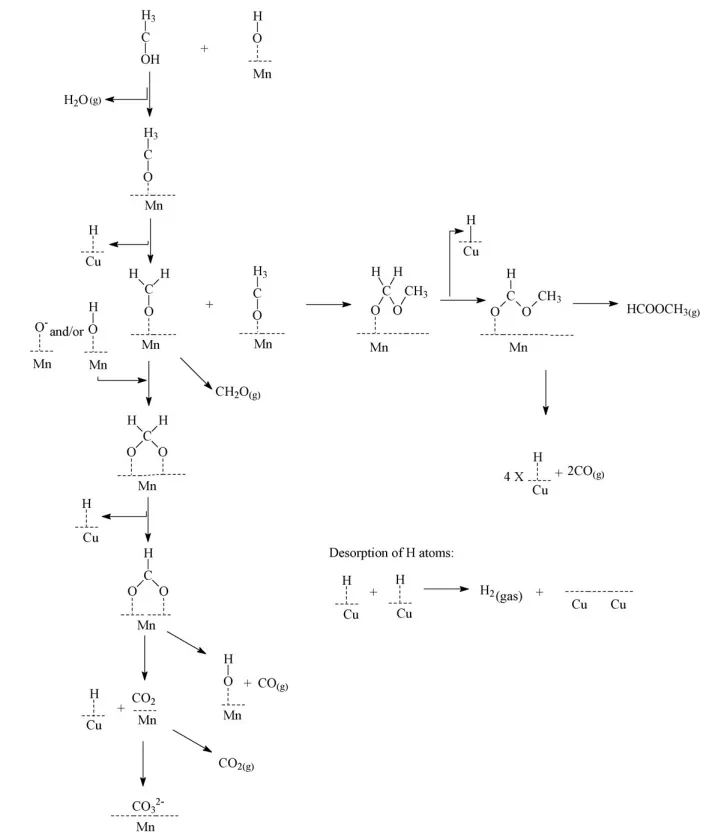
图2 甲醇裂解详细反应路径
对于Ni基催化剂,Wang等[11]针对Ni(111)催化剂进行了研究,表1为Ni(111)催化剂表面甲醇裂解采用广义梯度近似(GGA)的密度泛函理论(DFT)(DFT-GGA)计算后的可能路径,对于类似于甲醇裂解反应的AB→A+B反应中,ΔH1为气相反应的反应热;ΔH2的计算公式为:ΔH2=EA/M+EB/M-EAB/MEM(EAB为AB/M吸附系统的总能,EM为催化剂M能量);ΔH3为表面反应的计算热,计算公式为:ΔH3=E(A+B)/M-EAB/M(E(A+B)/M为A/B/M共吸附系统的总能)。计算结果表明:在Ni基催化剂表面主要是O—H键断裂,这点不同于Cu基催化剂,CH3O之后逐步抽取氢,进一步分解为CO和H,此外,还证实形成表面甲基和羟基以及氢原子的C—O和C—H断键路径具有较高的能垒,因此,最终产物为被吸附的CO和H原子。
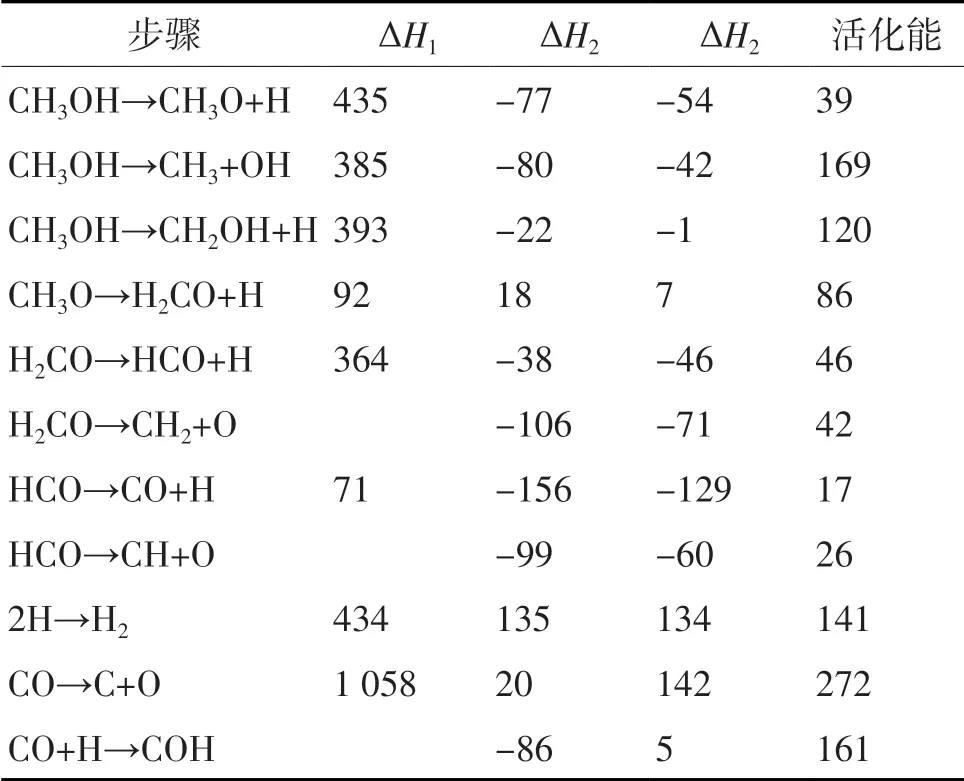
表1 Ni(111)催化剂表面甲醇裂解DFT-GGA计算后的可能路径 单位:kJ/mol
对于贵金属催化剂,Du等[12]研究了Pt3Ni催化剂上甲醇裂解机理,如图3所示。
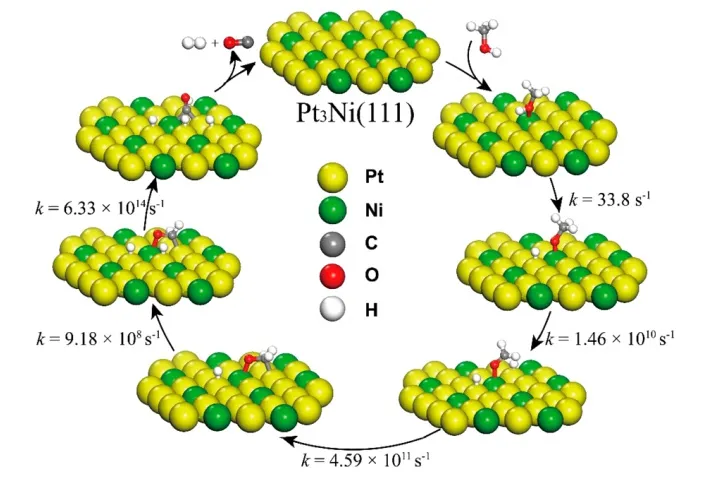
图3 Pt3Ni催化剂上甲醇裂解机理
图3 中间为5种元素Pt、Ni、C、H和O对应的相应颜色的球,随着反应的进行,各个元素发生断裂并重新组合,由图可知,初期CH3OH发生O—H键断裂,而不是C—H键和C—O键断裂,其最有可能的反应路径为:CH3OH→CH3O→CH2O→CHO→CO。
而Cao等[13]在研究Pt(111)和Pt(110)催化剂上甲醇裂解机理时,发现甲醇裂解路径不只有一条,第一个键位的断裂除了O—H键,C—H键也会同时发生断裂,之后逐步脱氢生成CO,反应如图4所示。
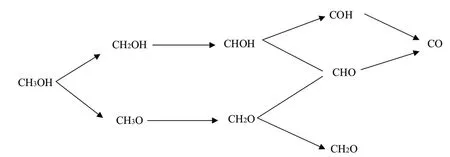
图4 Pt(111)和Pt(110)催化剂上甲醇裂解路径
该甲醇裂解反应路径为:CH3OH→CH2OH→CHOH→CHO→CO或CH3OH→CH2OH→CHOH→COH→CO,差异在于CHOH键位中O—H和C—H键断裂先后顺序。
2 甲醇裂解催化剂研究现状
甲醇非催化裂解在温度必须达到800 ℃以上才能发生,而内燃机的余热多数时候无法达到;在催化剂催化条件下,才可以利用尾气余热在温度较低、常压或低压条件下,进行催化裂解产生H2和CO,催化剂主要分为:铜基催化剂、镍基催化剂和贵金属催化剂(如Pd和Pt)等。
2.1 Cu基催化剂
铜基催化剂是目前研究最早且应用最广的甲醇裂解催化剂,最初源自于英国帝国化学工业公司研制的合成甲醇铜基催化剂,依据微观可逆性原理,其对甲醇裂解反应也有较好的活性。铜基催化剂的主要活性成分是铜,载体主要为SiO2、Al2O3和活性炭等,常用助剂为La,Al,Ti,Cr,Mn,Ce,Zn,Fe,Si,Ni等,一般反应温度为200~300 ℃,其在高温下易烧结,容易生成甲醛、甲烷、甲酸甲酯和二甲醚等副产物[14],为解决这些问题,许多学者在制备工艺及方法和元素配比等方面做了大量的工作。
2.1.1 制备工艺及方法
Li等[5]分别对比了共浸渍法和柠檬酸络合法制备的CuAl2O4尖晶石催化剂的催化特性,研究结果表明:相较于共浸渍法,柠檬酸络合法制备的催化剂具有更高的甲醇裂解特性,运用共浸渍法在CuAl2O4尖晶石催化剂中加入钾元素可以提高H2+CO的选择性,而运用柠檬酸络合法在CuAl2O4尖晶石催化剂中加入钾元素则会影响尖晶石结构的形成,从而降低催化活性。
Velinov等[15]对碳酸氢氧化物前驱体进行热化学和机械化学处理,最终得到2个系列的Cu0.5Co0.5Fe2O4铁氧体,研究结果表明:机械化学处理使铁元素弥散得更细,但是研磨时间从1 h延长到5 h,对铁元素结晶过程影响较小;热化学处理过程中,在773 K后,铁元素完全形成,进一步提高退火温度到973 K,会导致铁元素晶体显著增长。铁元素的分散和结晶度是甲醇裂解的重要影响因素,最好的催化工况为:热化学处理温度为573 K,机械化学处理的研磨时间为1 h。
Tsoncheva等[16]对比了4种不同改良等体积浸渍法制备的铜基活性炭催化剂,研究结果表明:浸渍法和初湿含浸法将铜铵前驱体4倍喷涂于活性炭上更适合制备铜/AC催化剂,表征结果表明:2种制备条件均有利于前驱体在载体微孔和介孔中的分布,并在载体表面形成大量含Cu+离子的AC,且随温度升高催化剂保持着较高的裂解率、稳定性和H2+CO选择性。
2.1.2 元素配比
为探究某一元素在整个催化剂活性中的作用,通常会控制其他元素配比,仅改变一种元素比例。Tsoncheva等[17]通过改变Re/Cu的比例研究铼在铜基催化剂中的作用,研究结果表明:铼改性催化剂相较于单一Cu催化剂会有较低的催化活性和选择性,不过在固定的Re/Cu比例下,金属沉积会显著提高甲醇高温裂解的稳定性,其中,具有复杂组分的积炭的形成被认为是形成该结果的原因。
Cheng等[18]通过改变甲醇与CO2的比例,研究CO2对甲醇裂解效果的影响,研究结果表明:在原料中加入CO2可以大幅降低催化剂的失活率,催化剂稳定性的提高主要由于催化剂烧结和积炭的阻滞作用,并且CO2的存在并没有改变产物分布及催化剂活性。
Tsoncheva等[19]通过改变Cu/Fe比例,研究Cu/Fe改性MCM-41介孔SiO2催化剂的特性,结果表明:相较于Cu和Fe单质催化剂,Cu/Fe改性催化剂可以提高甲醇裂解率和CO选择性,Cu/Fe的比例也会影响催化剂活性,尤其是Fe(Ⅲ)和Cu(Ⅱ)相的比例。
2.2 Ni基催化剂
Ni系催化剂主要用于甲醇水蒸气重整反应,主要特点是稳定性好,适用条件广,不易中毒,主要依靠表面的零价镍起催化作用,表面金属粒子的大小是决定催化剂活性的重要因素。在应用甲醇裂解反应的镍基催化剂中,对Ni/SiO2、Ni-Cu/SiO2、Ni3Al金属化合物以及镍合金等的研究较多。
Matsumura等[20]对不同工艺制备的Ni/SiO2催化剂进行了研究,结果显示,Ni粒子大小和质量分数均会对催化活性产生影响,其中,Ni粒子大的催化剂具有更高的催化活性。在Ni质量分数低于5%时,浸渍型催化剂的活性高于溶胶-凝胶型催化剂,当Ni质量分数在5%~40%时,溶胶-凝胶型制备的催化剂具有更高的活性。
Tada等[21]针对Ni-Cu/SiO2催化剂进行了研究,其活性和选择性比Ni/SiO2高,Ni0.1-Cu0.9/SiO2催化剂在反应温度为280 ℃下,CO的选择性达到100%,甲醇转化率为100%,在反应进行到96 h后,催化剂的催化活性变化不大。Ni/Cu质量比1∶9时催化剂活性最好,其中,Cu+Ni质量分数10%时甲醇转化率为77.6%,当质量分数达到30%时,甲醇转化率可达到100%。
Ni3Al金属化合物因其具有良好的耐高温性而得到广泛研究。Chun等[22]针对单晶冷轧法制备的Ni3Al箔进行了甲醇催化裂解研究,研究结果发现,尽管Ni3Al箔的比表面积极小,但会随着反应进行自发活化,在520 ℃的条件时反应29 h后,甲醇的裂解率可达到98%,且活性无明显下降,因此,Ni3Al箔既可作为甲醇裂解催化剂的前驱体,又可作为制氢微反应器的结构材料。
2.3 贵金属催化剂
贵金属(主要为Pt和Pd等)催化剂最初是用来合成乙醇及其他高级含氧化合物,其本身主要特点为:具有较高的稳定性、反应选择性且对S、P等毒物不敏感。因此,以贵金属为主要活性成分的催化剂正逐步被用于车载催化剂的研究当中。但是纯净的Pt和Pd活性不高,加入一定助剂后,如Ce和La等稀土元素,其催化活性将会显著提高,其主要载体和Cu基、Ni基催化剂类似,主要有Al2O3、TiO2、ZrO2和SiO2等。
针对Pt基催化剂,Imamura等[23]对Pt/CeO2催化剂的甲醇裂解性能进行了研究,当反应温度为230 ℃时,H2和CO的选择性分别为99.6%和94.2%,低温活性及选择性均较好。Kapoor等[24]采用沉积-沉淀法制备了中孔Pt/TiO2-MS催化剂并研究了催化性能,结果表明,制得的中孔Pt/TiO2-MS催化剂比工业催化剂Pt/TiO2在反应温度为180~220 ℃时拥有更高的活性,Pt/TiO2-MS催化剂在180 ℃下甲醇裂解率为12.0%,而工业催化剂只有4.8%。
对于Pd基催化剂,Usami等[25]采用共沉淀法制备多种Pt基催化剂,分别测试了其在200~300 ℃条件下甲醇裂解率及CO+H2选择性,结果表明制备的Pt基催化剂的活性由大到小依次为:Pd/ZrO2,Pd/Pr2O3,Pd/CeO2,Pd/Fe3O4,Pd/TiO2,Pd/SiO2,Pd/ZnO。且在200 ℃及250 ℃时,所有的Pd基催化剂对CO的选择性均高于98%,因此,说明虽然载体不同,钯系催化剂的活性存在差异,但是Pd基整体活性较好。Sun等[26]研究了La对Pd/CeO2催化剂的影响,当反应温度为320 ℃时,Pd/CeO2催化剂上的甲醇裂解率达到100%,而当反应温度为275 ℃时,在La-Pd/Ce(mLa∶mPd=1∶1)催化剂上的甲醇转化率可以达到100%,表明助剂La的加入可以有效促进Pd/CeO2催化剂的催化效果。杨成等[27]对La2O3和CeO2改性的γ-Al2O3负载贵金属Pd氧化物催化剂进行研究,结果表明:La2O3和CeO2的协同作用可以显著提高甲醇催化裂解的催化活性和选择性,其中Pd/CeO2/La2O3/Al2O3催化剂,在反应温度为250 ℃,甲醇空速为1.8 h-1时,甲醇裂解率可以达到91.4%,CO+H2的选择性几乎达到100%。Mul等[27]分别用共沉淀法和共浸渍法制备了Pd/La2O3/SiO2催化剂,发现其催化活性均伴随La2O3与Pd的质量比的增大而增大;当La2O3与Pd的质量比小于0.7时,共沉淀法制备的催化剂活性低于共浸渍法。
2.4 其他催化剂
目前,Cu基催化剂、Ni基催化剂和贵金属催化剂的研究已经趋于成熟,现阶段甲醇裂解催化剂的研究重点趋向于纳米科学,如Tsoncheva等[29]辅以表面活性剂用水热方法制成纳米孔隙材料ZrO2,发现当反应温度在227~447 ℃时,其最大的甲醇裂解率为60%,在反应温度为493 ℃时,CO选择性最大,约为20%,其中裂解过程中主要的副产物是二甲醚。
Carraro等[30]在纳米结构的CeO2上沉积了Pt最终得到Pt/CeO2催化剂,主要利用纳米Pt粒子与CeO2之间强电子相互作用,极大提高了催化性能,研究结果表明:w(Pd)=5%的Pd/CeO2催化剂裂解效果最好,温度为150 ℃时裂解率为50%,温度为200 ℃时裂解率为100%。
Laosiripojana等[31]研究比表面积对纳米CeO2催化剂甲醇裂解性能的影响,研究结果表明:该纳米催化剂有效阻止了炭沉积,在850 ℃下甲醇裂解率依然为100%;在稳态下,高比表面积催化剂甲醇裂解率明显高于低比表面催化剂,主要由于高比表面积催化剂上甲醇储氧能力高于低比表面积催化剂。
3 总结与展望
1)关于甲醇裂解催化剂的催化机理,Cu基、Ni基和贵金属催化剂的活性中心和反应路径可能完全不同,甚至Cu基催化剂本身在整个甲醇裂解反应过程中也存在不同的Cu价态,不过大多数学者认为:Cu0对Cu基催化剂在甲醇裂解反应中发挥着重要作用。
2)针对车用甲醇裂解催化剂,铂和钯等贵金属作为甲醇裂解的催化活性成分,虽然其催化性能优于非贵金属系催化剂,但是由于催化剂中贵金属的成分较高,使其制备成本远高于其他类型的甲醇裂解催化剂,不符合工业大批量生产的现实;镍系催化剂低温活性不高,无法有效利用发动机余热;纳米催化剂现阶段的研究还不纯熟,其反应温度过高,甲醇转化率和CO选择性等均不如传统催化剂,且制备成本过高,无法实现工业生产;与其他种类催化剂相比,铜系催化剂具有较高的低温活性,添加部分助剂如Ni和Zr等可显著提高催化剂的活性,极大的提高其低温选择性,且制备成本相较于贵金属催化剂来说较低。因此,铜系催化剂作为车用甲醇裂解催化剂未来具有较好的发展前景。

