氮沉降及菌根真菌对长白落叶松苗木根系构型及根际酶活性的影响
刘婷岩 郝龙飞* 王续富 闫海霞 白淑兰
(1. 内蒙古农业大学林学院,呼和浩特 010019;2. 呼和浩特市环境监测中心站,呼和浩特 010030)
土壤氮有效性是气候变化反馈机制的重要因子,同时也是影响植物生长和物种多样性的关键因素[1]。由于人类活动产生的活性氮不断增加,并以干、湿沉降的方式进入地球表面,导致了一系列的生态问题,当前中国已成为全球氮沉降最高的国家之一[2]。已有研究认为,氮沉降已成为影响中国陆地生态系统平衡的主要驱动因子,进而影响森林生态系统土壤微生物多样性及生态功能[3~4]。以往研究发现,菌根共生关系受到氮沉降的影响,土壤氮限制地区的外源氮输入会促进菌根的生长,但随着氮输入量的增加,对菌根共生体的影响存在差异,差异程度取决于生态系统中氮沉降量及时间、土壤初始氮水平和菌根类型等因素[5]。
土壤酶作为生态系统的生物催化剂,且对外界环境变化非常敏感,其中β-1,4 葡萄糖苷酶(BG)、β-1,4-N-乙酰-氨基葡糖氨糖苷酶(NAG)、亮氨酸氨基肽酶(LAP)、酸性磷酸酶(ACP)和碱性磷酸酶(ALP)分别在土壤的碳、氮、磷养分循环利用中起着重要作用[6]。氮沉降作为外源氮进入生态系统,显著影响土壤酶在生态系统养分循环过程中的作用[7]。以往关于氮输入对土壤酶的影响有促进[8]、抑制[9]和无影响[10]等不同结论,原因为土壤酶在不同环境中对氮沉降的响应存在差异。土壤酶主要来源于土壤微生物和植物根系,以往关于氮沉降对菌根真菌和土壤酶两者的单一研究已有大量的报道[11];且研究也发现,菌根共生体显著影响土壤酶的活性[12]。然而,菌根共生体形成后,其根际土壤酶活性对氮沉降的响应研究较为缺乏。
本研究以北方地区菌根依赖型树种长白落叶松(Larix olgensis)苗木为材料,通过对比分析氮沉降对菌根苗和非菌根苗根系形态变化,结合氮沉降处理下土壤酶活性的变化规律,探讨氮沉降对生态系统植物根系和菌根真菌共生关系中根系构型和酶活性特征的影响,为全球变化背景下森林生态系统稳定性研究提供理论参考。
1 材料和方法
1.1 试验材料
研究所用外生菌根真菌为:褐环粘盖牛肝菌(Suillus luteus)、厚环粘盖牛肝菌(Suillus grevillei)、黄褐口蘑(Tricholoma fulvum)、浅灰小牛肝菌(Bo⁃letinus grisellus)、乳牛肝菌(Suillus bovinus)、球根白丝膜菌(Leucocortinarius bulbiger)、浅黄根须腹菌(Rhizopogon luteolus)和彩色豆马勃(Pisolithus tinctorius)。
长白落叶松种子用2%的KMnO4溶液消毒30 min,然后用无菌水冲洗4~5 次;在25℃恒温光照培养箱中催芽,待种子萌发后播入装有经高温、高压灭菌基质(蛭石与土体积比为1∶2)的花盆中(d=15 cm),并放入人工气候室培育(温度25℃,最大湿度60%,最大光照强度10 000 Lux)培养2 月后待用。
1.2 试验设计
1.2.1菌剂制备
菌剂采用MMN 培养液与蛭石配置成固体培养基,高温高压灭菌1 h,待冷却后分别接种上述8种外生菌根真菌的平板菌种,再置于25℃培养室内培养,45 d后即可长满瓶,以备用。
1.2.2接种处理
研究采用盆栽试验,设置2 个接种处理,分别为接种处理(以下简称+M,将8种菌剂等量混合后对幼苗进行接种)和未接种处理(以下简称-M)。接种方法为:在育苗盆底部放入适量灭菌基质,然后选取长势良好的菌剂等量混匀平铺于灭菌基质上,再选培养2 个月生长良好的幼苗栽入其中,尽量使幼苗根系与菌剂充分接触,每盆接种量20.0 g,每盆栽植5 株幼苗,覆灭菌基质,每盆质量控制1.0 kg;对照处理加入经灭菌的20.0 g 等量混合的固体菌剂,同样方法进行幼苗栽植,浇透水后,将不同处理育苗盆随机排布,置于内蒙古农业大学实验苗圃温室大棚内培养。
1.2.3模拟氮沉降处理试验
幼苗接种培养2 个月后,测定+M 处理苗木菌根侵染率达38.57%(-M 处理苗木菌根侵染率为0%),开始模拟氮沉降处理试验。根据试验区氮沉降背景值34.3 kg·N·hm-1·yr-1[8],设置4 个氮浓度处理:不施氮(0N,0 kg·N·hm-1·yr-1)、低氮(LN,15 kg·N·hm-1·yr-1)、中氮(MN,30 kg·N·hm-1·a-1)和高氮(HN,60 kg·N·hm-1·a-1)处理。用自来水溶解的NH4Cl 和NaNO3(NO3-:NH4+为1∶1)作为氮添加溶液,隔5 d 定量浇水150 mL/盆、隔10 d 定量施入氮添加溶液100 mL/盆,共施氮10次。接种和氮沉降处理各设置15个重复。采用喷洒方法将氮施入育苗盆中,既可以模拟降雨过程脉冲式将氮带入土壤中,同时更为均匀。
1.3 根系形态测定
最后一次模拟氮沉降试验结束15 d 后,从各处理中随机选取长势较一致的长白落叶松幼苗5株,用去离子水清洗根系附着杂物后进行根系形态结构的测定。用Epson 数字化扫描仪Expres⁃sion10000XL 进行根系形态扫描,并使用Win RHI⁃ZO 根系图像分析软件对各处理根系形态结构进行定量分析,测定直径0~0.5 mm根系的总根长、总表面积、总体积、根尖数等形态指标。
1.4 土壤酶活性测定
土壤酶活性的测定包括β-1,4-葡萄糖苷酶(BG)、β-1,4-N-乙酰-氨基葡糖氨糖苷酶(NAG)、亮氨酸氨基肽酶(LAP)、酸性磷酸酶(ACP)、碱性磷酸酶(ALP),具体测定参考Sinsabaugh 等的方法[13]。BG、NAG、ACP 的测定,根据预实验准确称取0.25 g 新鲜土壤,加入不同的4 mL 醋酸缓冲液配制的不同反应底物溶液,20℃培养4 h。培养结束后,提取上清液2.5 mL 于试管中,加入NaOH 终止反应和显色,在410 nm 处测定吸光度。ALP 酶和LAP 测定方法与上述酶测定相似,分别准确称取0.25和0.35 g新鲜土样,并分别采用碳酸盐缓冲液和Tris-羟甲基-氨基甲烷缓冲液配制相应底物溶液,LAP 反应4 h 后不加NaOH,直接测定吸光度,以对硝基苯酚的浓度表征酶活性。
1.5 数据处理
利用SPSS 23.0(SPSS for Windows,Chicago,USA)采用双因素方差分析和LSD 多重比较法对接种菌根真菌和氮沉降处理下苗木根系形态和土壤酶差异显著性进行检验。采用Sigmaplot10.0(Systat Software Inc.,San Jose,CA,USA)进行绘图。
2 结果与分析
2.1 氮沉降和接种处理对苗木根系形态的影响
对1 年生长白落叶松苗木根系形态进行双因素方差分析,接种菌根真菌、氮沉降及二者交互作用对苗木直径0~0.5 mm根系的总根长、总表面积、总体积、根尖数的影响均达到极显著水平(P<0.01)(见表1)。在+M 和-M 处理中,长白落叶松苗木直径0~0.5 mm根系形态指标均随氮沉降量递增呈下降的趋势。0N 处理苗木直径0~0.5 mm 根系形态指标均显著高于MN 和HN。在0N、MN处理下,-M处理的总根长、总表面积、总体积、根尖数均显著高于+M 处理。-M 处理下,LN 处理的直径0~0.5 mm 根系总根长和根尖数较0N 处理分别降低了18.9%(P<0.05)和53.3%(P<0.05)。而HN 处理下,+M 处理根系的根尖数较-M 处理降低了32.1%(P<0.05)(见表1)。
2.2 氮沉降和接种处理对幼苗根际土壤酶活性的影响
对1 年生长白落叶松苗木根际土壤酶活性进行双因素方差分析,接种菌根真菌显著影响苗木根际BG、LAP、ALP 和NAG 活性(P<0.01),但对ACP 活性无显著影响。氮沉降对苗木根际土壤酶活性的影响均达到了极显著水平(P<0.01)。接种菌根真菌和氮沉降处理对ACP 无交互作用,而对BG、LAP、ALP和NAG活性的影响达到极显著和显著水平(见表2)。随氮沉降量递增,长白落叶松苗木根际土壤中BG、LAP、ACP和ALP活性均呈先增加后下降的趋势,而NAG 活性呈下降的趋势。+M处理苗木根际土BG 活性显著高于-M 处理。0N 条件下,+M 与-M 相比根际土壤NAG 活性提高了74.7%(P<0.05);LN 条件下,+M 处理苗 木根际土壤LAP 活性较-M 处理提高了83.2% (P<0.05);MN 条件下,+M 处理根际土壤ACP 活性较-M 处理提高了17.6%(P<0.05);但+M 处理根际土壤ALP 活 性 较-M 处 理 降 低 了32.2%(P<0.05)(见表2)。
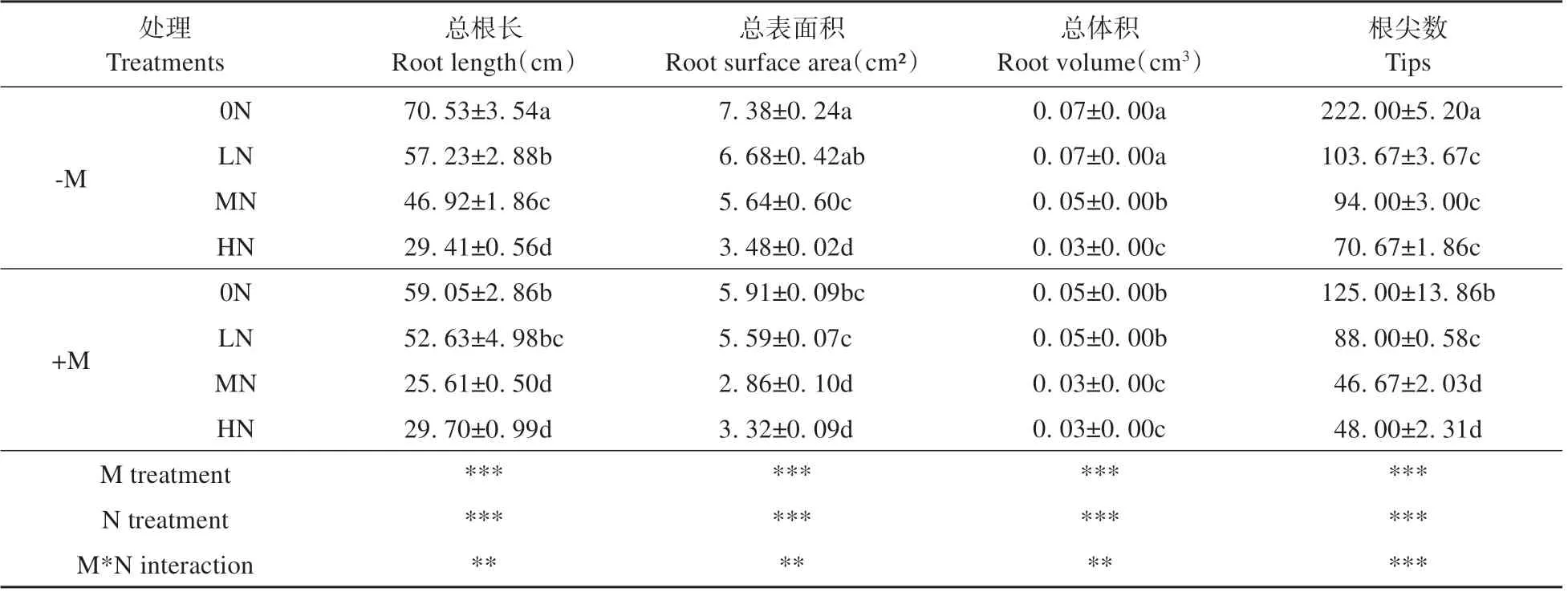
表1 氮沉降和接种菌根真菌对长白落叶松苗木直径0~0.5 mm根系形态的影响Table 1 Root morphology with diameter of 0-0.5 mm of L. olgensis seedlings under nitrogen deposition and inoculated with ectomycorrhizal fungi treatments
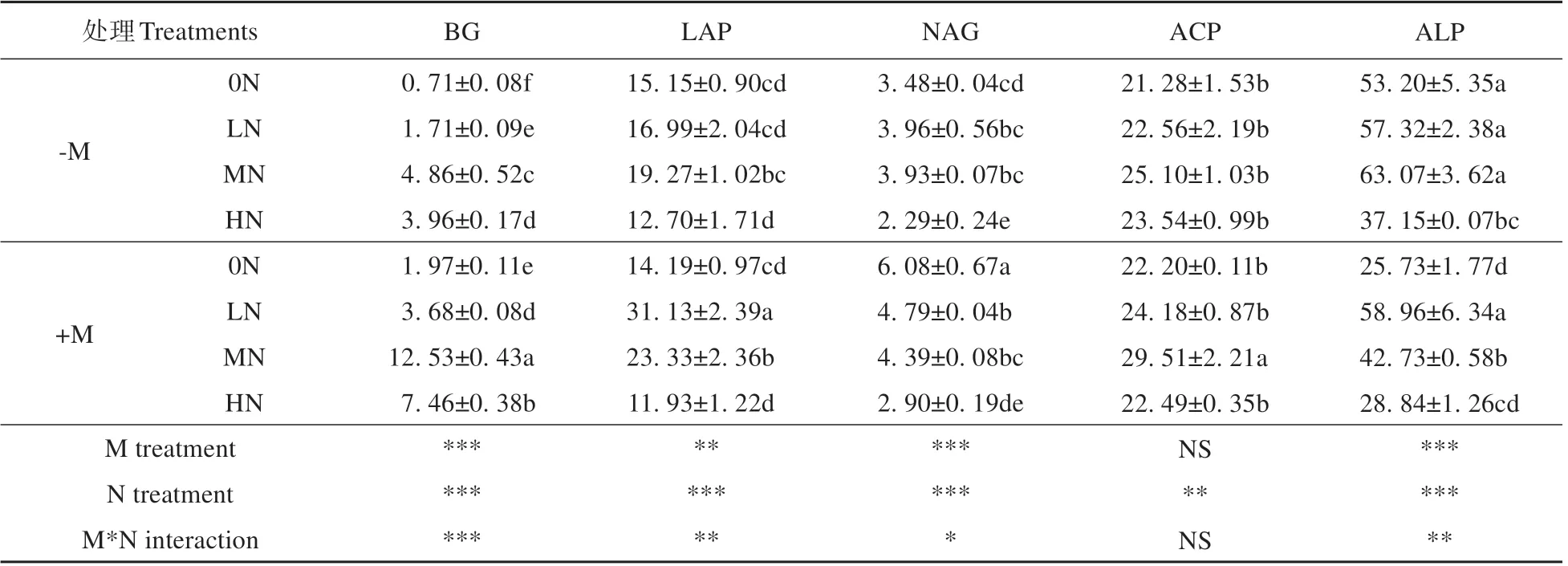
表2 氮沉降和接种菌根真菌对长白落叶松幼苗根际土壤酶活性的影响Table 2 Rhizosphere soil enzyme activities of L. olgensis seedlings under nitrogen deposition and inoculated with ecto‐mycorrhizal fungi treatments(nmol·g-1·h-1)
2.3 根系形态和土壤酶活性间相关性分析
两种接菌处理下,长白落叶松苗木直径0~0.5 mm 根系的形态指标与根际土壤BG 活性呈负相关关系(P<0.05);除根尖数与根际土壤NAG 活性间无显著相关性外,其他根系形态指标与NAG 活性均呈正相关关系(P<0.05);-M 处理下根际土壤LAP 活性与总根长、总表面积和根系总体积呈显著正相关(P<0.05)。接种菌根真菌和氮沉降交互作用的影响下,根系形态指标与根际土壤BG 活性呈显著负相关(P<0.01);除根尖数与根际土壤ACP 活性显著负相关性外(P<0.05),其他根系形态指标与ACP 活性无相关性;除根尖数与根际土壤ALP 活性无显著相关外,其他根系形态指标与ALP活性均呈正相关(P<0.05)(表3)。
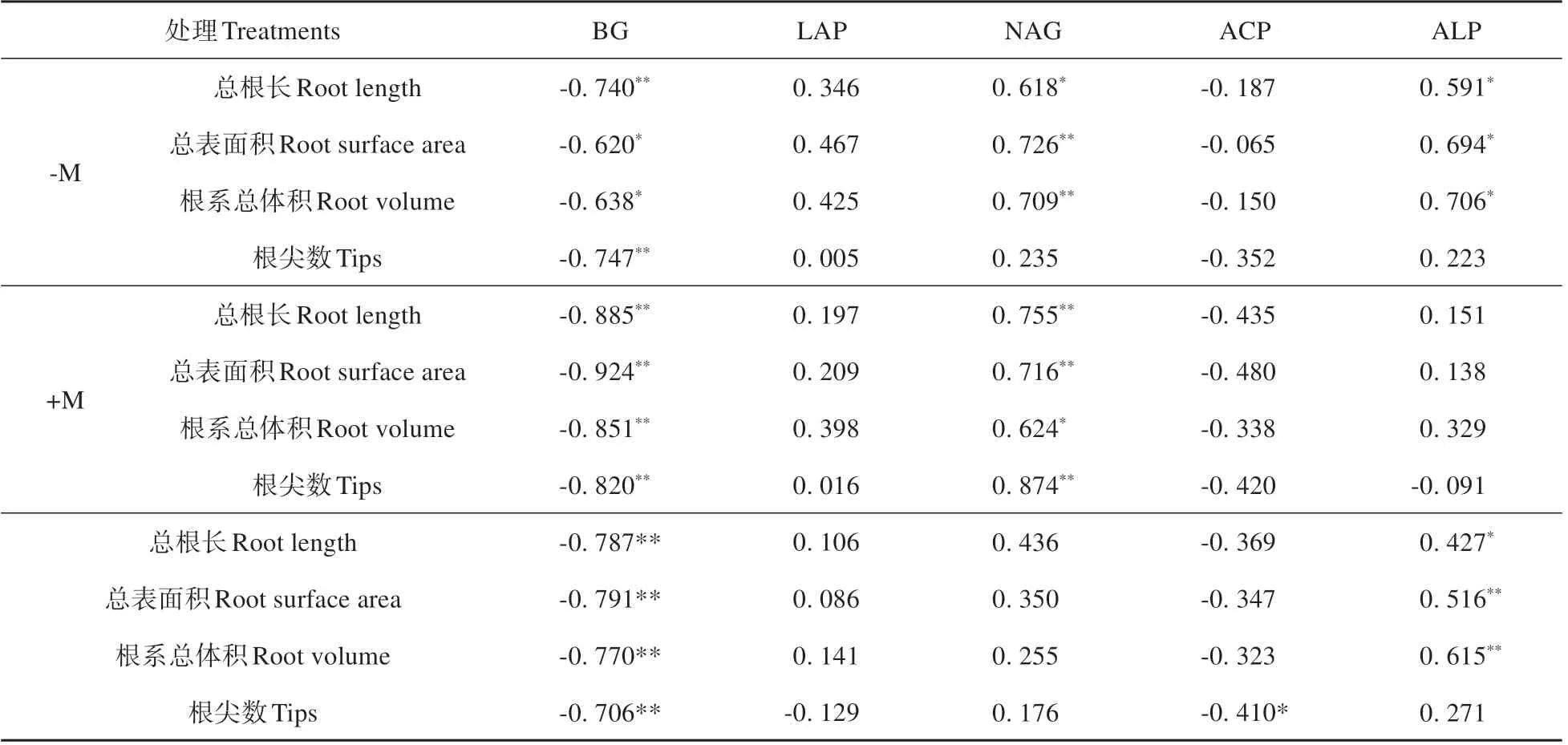
表3 接种菌根真菌处理下长白落叶松苗木直径0~0.5 mm根系形态与根际土壤酶活性相关性分析Table 3 Pearson’s correlation test between root morphology with diameter of 0-0.5 mm and rhizosphere soil enzyme activities of L.olgensis seedlings under inoculated with ectomycorrhizal fungi treatments
3 讨论
3.1 氮沉降和接种处理对苗木根系构型的影响
外生菌根真菌侵染植物根系,形成菌根共生体,增大根系吸收面积,促进了植物对水分和养分的吸收,尤其对外生菌根依赖型树种,共生关系形成后,提高植物对环境胁迫的适应性[14]。根系形态构型中根系长度、表面积、体积、根尖数是衡量植物根系分布范围和养分吸收能力的重要指标。本研究中,接种菌根真菌、氮沉降及二者交互作用对苗木直径0~0.5 mm根系形态的影响均达到极显著水平(P<0.01),且不同接种处理下长白落叶松苗木根系指标均随氮沉降量递增呈下降的趋势,且-M 处理高于+M 处理(见表1)。与以往关于施用氮肥对落叶松人工林1 级根外生菌根侵染及形态的影响研究结果一致[15],原因可能为植物对环境变化具有较强的适应性和可塑性,一定的氮沉降处理消除了土壤氮限制,植物通过调节细根的生长形成最优的资源获取策略[16]。在相同氮沉降处理下,-M处理的总根长、总表面积、总体积、根尖数均高于+M 处理(见表1)。与以往研究关于外生菌根真菌提高油松根系构型的形态指标的研究结果存在差异[14],其原因可能为菌根共生体中棒状和二叉状结构提高了吸收根直径[17],导致接种处理下直径0~0.5 mm 根系中吸收根的根尖数减少;也可能植物菌根形成后,一部分碳水化合物分配给菌根真菌,自身根系形态构型指标降低,该观点也符合植物生长策略[16]。
3.2 氮沉降和接种处理对根际土壤酶活性的影响
土壤酶活性与土壤养分循环密切相关,且高氮输入对森林生态系统平衡产生显著影响[18]。本研究发现,氮沉降对苗木根际土壤酶活性的影响均达到了极显著水平;而接种菌根真菌及其交互作用显著影响苗木根际土壤BG、LAP、ALP和NAG活性,而对ACP 活性无显著影响。同时,随氮沉降量递增,长白落叶松菌根和非菌根苗根际土壤酶(BG、LAP、ACP 和ALP)活性均呈先增加后下降的趋势,而NAG 活性呈下降的趋势(见表2)。与以往关于氮沉降对广东鼎湖山林地土壤酶活性的影响结果一致[19],原因可能为低氮水平缓解了土壤氮限制,促进根系和微生物活性,进而增加了土壤酶活性;而高氮处理可能导致严重的土壤酸化[20~21],影响土壤微生物活性,进而导致高氮处理下土壤酶活性受到限制。本研究也发现,随氮沉降量增加,+M 处理根际土壤酶活性变化量高于-M处理(见表2),表明氮沉降对菌根苗根际土壤酶活性的影响高于非菌根苗。原因可能为HN处理下,根系较容易获得养分,对菌根真菌的依赖性降低,削弱根系和菌根真菌的共生关系[22]。氮沉降处理下,+M 和-M 处理长白落叶松苗木直径0~0.5 mm根系形态与根际土壤BG 活性呈显著负相关(P<0.05),表明氮沉降下根系形态指标降低而土壤BG活性增加。原因为土壤BG 主要来源于土壤微生物[23],氮添加会增加土壤中氮含量、纤维素和半纤维素的浓度,降低木质素和糖类浓度,所以氮添加会促进纤维素降解酶(BG)活性[24]。根据资源配置理论,氮沉降增加土壤无机氮的浓度,土壤微生物可能会减少氮获取酶的产生,以往的研究大多使用资源分配理论来解释氮获取酶对氮添加的响应,与本研究结果根际土壤NAG 活性变化规律结果一致。研究也发现,当营养限制发生变化时(如从N 限制到P 限制),根系和微生物可能会调整相关酶的产生,以保证植物和微生物平衡养分需求与周围环境供应之间的动态平衡[25]。
4 结论
(1)除土壤酸性磷酸酶外,接种菌根真菌、氮沉降及二者交互作用显著影响苗木直径0~0.5 mm根系的形态及根际土壤酶活性。
(2)苗木形成菌根后可以减弱氮沉降对苗木根系构型的影响,尤其在低氮浓度下,菌根苗对根际土壤酶的活化程度显著高于非菌根苗。
(3)高氮浓度显著抑制菌根苗和非菌根苗吸收根根系形态构型。
(4)随着氮浓度的增加,长白落叶松菌根苗显著提高根际土壤相关酶(BG和NAG)的活性。

