阿帕替尼联合培美曲塞治疗老年晚期非鳞非小细胞肺癌的临床效果
余东
非小细胞肺癌是最常见的恶性肿瘤之一,也是我国恶性肿瘤患者死亡的首要原因。按其临床发病率和临床研究进展,将其分为腺癌、大细胞癌和鳞状细胞癌。非小细胞癌与临床小细胞癌相比,生长缓慢,分裂和转移较晚。随着患者的病情发展到晚期,机体各项功能都会受到影响,导致患者身体异常虚弱,病情严重,因此临床急需采取有效的治疗措施。与此同时,非小细胞肺癌占相关文献中所有肺癌的80%左右。当发现疾病时,病情进展到中晚期,生存率较低。放化疗、酪氨酸激酶抑制剂靶向治疗是目前临床上常用的治疗方法,但治疗后患者的病情无法得到明显控制,因此可采用新的临床治疗方法进行靶向治疗或姑息治疗。培美曲塞是一种新的多靶点抗叶酸药物,现已应用于晚期小细胞肺癌的治疗,通过干扰叶酸代谢在细胞复制中发挥抗肿瘤作用。阿帕替尼是一种抑制血管内皮生长因子受体分子的新药,它也可通过限制血管内皮生长因子受体分子的活化在肿瘤细胞中起信号传导作用。临床上,这种药物已经被广泛应用于晚期胃癌的治疗,在肺癌、食管癌等疾病的研究中发挥了重要作用。本文观察应用阿帕替尼联合培美曲塞治疗老年晚期非鳞非小细胞肺癌的临床效果,现报道如下。
1 资料与方法
1.1 临床资料 选取2018年1-12月襄州区人民医院收治的老年晚期非鳞非小细胞肺癌患者50例,根据随机数字表法分为联合组和对照组,每组25例。联合组男14例,女11例;年龄62~79(65.21±2.25)岁;体质量41~81(62.34±11.67)kg;其中腺癌23例、大细胞癌2例。对照组男15例,女10例;年龄61~78(65.45±2.67)岁;体质量41~84(62.56±11.26)kg;其中腺癌23例、大细胞癌2例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,患者家属均知晓研究内容并签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1)老年晚期非鳞非小细胞肺癌患者;(2)有可测量客观病灶;(3)年龄≥60岁;(4)卡氏评分>65分,预计生存期>3个月。排除标准:(1)严重心、肾功能衰竭患者;(2)凝血功能障碍、有出血倾向患者;(3)合并其他恶性肿瘤患者;(4)严重心脑血管并发症、化疗方案禁忌者。
1.3 治疗方法 对照组使用注射用培美曲塞二钠(南京先声东元制药有限公司生产,国药准字H20090135)500 mg/m2静脉滴注,第1天,21 d为1个周期。联合用药组在对照组基础上给予甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司生产,国药准字H20140103)250 mg/d口服,每天1次,第1~21天。21 d为1个周期。2组均治疗3个周期。
2组均在用药前1周开始口服叶酸片(常州制药厂有限公司生产,国药准字H32023302)0.4 mg/d,直至最后一次培美曲塞用药后21 d。从化疗前1周给予维生素B12注射液(国药集团容生制药有限公司生产,国药准字H41020634)每次1 mg肌肉注射,3个周期用药1次。在化疗前1 d和化疗第1、2天均给予地塞米松片(广东华南药业集团有限公司生产,国药准字H44024469)3.75 mg口服,每天2次。
1.4 观察指标 比较2组患者治疗前后T 淋巴细胞亚群(CD3+、CD4+)水平,近期总缓解率和完全缓解率,不良反应发生率及中位无进展生存期。
1.5 疗效评定标准[1]判断疗效的标准是根据世界卫生组织制定的评价标准:(1)完全缓解:晚期非鳞非小细胞肺癌病灶完全消失;(2)部分缓解:晚期非鳞非小细胞肺癌病灶体积缩小≥50%;(3)稳定:晚期非鳞非小细胞肺癌病灶体积缩小<50%;(4)进展:晚期非鳞非小细胞肺癌病灶体积增加。总缓解率=完全缓解率+部分缓解率+稳定率。
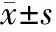
2 结 果
2.1 CD3+、CD4+水平比较 治疗前,2组患者CD3+、CD4+水平差异无统计学意义(P>0.05);治疗3个周期后,2组CD3+、CD4+水平均较治疗前升高,且联合组高于对照组,差异有统计学意义(P均<0.01)。见表1。

表1 2组患者治疗前后CD3+、CD4+水平比较
2.2 近期总缓解率、完全缓解率比较 治疗3个周期,联合组总缓解率为88.00%高于对照组的60.00%,完全缓解率为36.00%高于对照组的8.00%,差异均有统计学意义(χ2=5.094,P=0.024;χ2=5.711,P=0.017)。见表2。
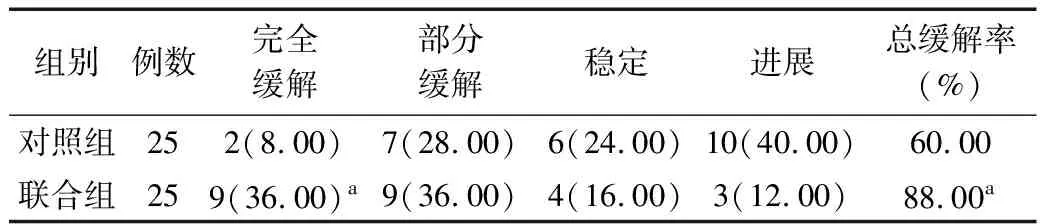
表2 2组患者近期治疗效果比较 [例(%)]
2.3 不良反应比较 2组患者不良反应总发生率均为44.00%,2组比较差异无统计学意义(P>0.05)。见表3。

表3 2组患者不良反应发生情况比较 [例(%)]
2.4 中位无进展生存期比较 联合组中位无进展生存期为(5.16±1.41)个月,长于对照组的(3.16±0.51)个月,差异有统计学意义(t=6.669,P=0.000)。
3 讨 论
随着现代工业的迅速发展,大气污染日益严重,肺癌发病率呈逐年上升趋势。早期肺癌通常很难发现。当大部分患者发现有肺癌时,外科手术、药物及化疗是晚期非小细胞肺癌的主要治疗方法。肿瘤患者年龄越大,机体的适应能力越弱,组织器官退行性病变的程度也就越大。因此,选择一种低毒性、高效率的方法至关重要。
肺癌在我国发病率较高。其中多数患者为非小细胞肺癌。晚期非小细胞肺癌一旦确诊,必须行手术、化疗或生物制剂等辅助治疗,以改善其临床症状,提高生存质量。但是,当上述治疗无效时,临床上通常采用姑息性或靶向性药物治疗[2]。
临床上,多数肺癌患者处于中晚期,且确诊患者多为晚期非鳞状非小细胞肺癌,晚期失去手术治疗指征。综合疗法,如化疗、放疗等,一般用于延长患者生存周期,提高生存率。临床上铂类、紫杉醇类常用于治疗药物,但其不良反应严重,影响患者的耐受性和治疗依从性[3]。
培美曲塞是一种新型的抗叶酸及代谢药物,二氢叶酸还原酶、甘氨酸转氨酶、胸苷酸合成酶的活性均被抑制,其抑制细胞复制的有效方法是阻断或减少核苷酸的生物合成,从而有效地抑制肿瘤生长。根据有关研究表明,培美曲塞骨髓抑制作用较其他化疗药物明显减弱,耐受性好,不良反应发生率低。培美曲塞能引起核苷酸合成及叶酸代谢的异常,破坏叶酸的正常代谢,有效抑制肿瘤生长。白细胞减少症、骨髓抑制症、恶心呕吐、肝肾功能异常是培美曲塞的主要并发症与不良反应。地塞米松在临床上常用于预防皮疹,而维生素B12和叶酸可降低骨髓抑制率。通常在对症支持治疗后,患者的症状会得到改善[4-5]。
在肿瘤发生发展过程中,肿瘤血管生成是肿瘤生长和转移的重要形态基础,也是不可或缺的一个环节。阿帕替尼是目前临床主要的靶向药物。既有抗肿瘤的作用,又有抗血管新生的作用,同时又与其自身的机制密切相关。阿帕替尼治疗血管内皮生长因子受体2的ATP结合位点受到限制,该位点会干扰肿瘤组织下游信号和血管新生。根据有关文献报道,生物免疫疗法在临床上被广泛应用于非小细胞肺癌的治疗,不仅可以提高临床疗效,而且可有效延长患者的生存期,提高患者的生活质量[6-7]。舒尼替尼、索拉非尼等抗血管生成药物与阿帕替尼靶向药物相比,其疗效较差。因此,为了提高疗效,控制病情,临床上使用阿帕替尼。阿帕替尼是我国自主研制的一种小分子抗血管生成靶向药物,该药物作用机制是VEGFR-2和ATP在细胞内高度选择性地结合位点,阻断下游信号传导,抑制肿瘤组织血管生成。在患者体内,阿帕替尼能显著抑制血管内皮生长因子受体-2的表达,且不会抑制其他途径,该药对血管新生的抑制作用有较高的准确性。相关研究表明,阿帕替尼片口服后能迅速被患者吸收,血浆中原型药物浓度升高,峰值平均为1.8~2.3 h,消除率缓慢,消除半衰期最长为9.4 h。因此,阿帕替尼联合可逆 ATP结合转运体介导的多药耐药机制[8-9]。
本研究结果显示,治疗3个周期后,2组CD3+、CD4+水平均较治疗前升高,且联合组高于对照组;治疗3个周期,联合组总缓解率为88.00%高于对照组的60.00%,完全缓解率为36.00%高于对照组的8.00%;2组患者不良反应总发生率均为44.00%,2组比较差异无统计学意义;联合组中位无进展生存期为(5.16±1.41)个月,长于对照组的(3.16±0.51)个月。大多数肺癌是非小细胞肺癌,其病理分型较慢,且在肿瘤扩散转移过程中,易被患者忽略。当患者处于中晚期时,一旦发现有咳嗽、痰中带血、体质量下降等症状,而且随着病程的延长,病情会进一步恶化。培美曲塞通过抑制机体内的叶酸代谢,影响肿瘤细胞核酸的合成,从而发挥较好的抗肿瘤作用[10-11]。但是单用效果不佳,容易导致癌细胞的转移和复发。阿帕替尼是一种新型的胃癌药物,它是VEGFR-2的一部分,主要作用是与细胞内酪氨酸激酶 ATP结合,阻断其VEGF信号通路,抑制磷酸化,逐渐减弱血管生成因子的信号,从而抑制肿瘤生长。阿帕替尼可有效抑制血管内皮细胞的增殖、迁移和形成[12-13]。
综上所述,阿帕替尼联合培美曲塞治疗老年晚期非鳞非小细胞肺癌的临床疗效确切,可进一步改善患者的免疫功能,延长患者的中位无进展生存期,值得推广应用。

