增温对冻土区泥炭沼泽土壤孔隙水甲烷关联微生物和溶解性有机碳的影响
刘 超,王宪伟,宋艳宇,马秀艳,宋长春,董星丰,赵光影
1 哈尔滨师范大学,寒区地理环境监测与空间信息服务黑龙江省重点实验室,哈尔滨 150025
2 中国科学院东北地理与农业生态研究所,湿地生态与环境重点实验室,长春 130102
大兴安岭位于欧亚多年冻土带的南缘,连续大片多年冻土分布面积约6.16×104km2。冻土作为岩石圈和大气圈之间能量交换的产物,长期冷湿的环境为其赋存了大量的有机质,气候变暖正在导致冻土退化,主要表现为活动层厚度逐年增加,分布连续性发生改变,冻土面积减少[1-2]。在此过程中,因长期冷湿环境而赋存于深层土壤中的大量有机质必将暴露于土壤微生物的分解,且土壤有机质的分解很可能使得储存的古碳以二氧化碳、甲烷的形式释放出来,并进一步加速气候变暖,这势必会对该区土壤碳循环产生重大影响[3-4]。泥炭地多与冻土相伴而生,其面积仅覆盖全球陆地总面积的3%,但碳储量却为全球土壤碳库的15%—30%[5]。随着全球温度的升高,我国北方大兴安岭地区泥炭沼泽碳动态正在发生着巨大的变化。因此,多年冻土区泥炭地碳库动态研究显得尤为重要。
甲烷是一种重要的温室气体,其在大气中的浓度极低,但在百年尺度上的增温潜势为二氧化碳的28倍,约占整个温室气体贡献量的15%[6]。甲烷是由产甲烷菌在厌氧条件下生成的,但在其输出到大气之前,约80%—90%会被甲烷氧化菌氧化[7-8]。除排放到大气中和在根系周围被氧化的甲烷外,还有很大一部分甲烷存在于土壤孔隙水中[9]。三江平原沼泽湿地6—10月0—35 cm土壤孔隙水甲烷浓度为240.00—523.10 μmol/L[10],闽江河口湿地1、3、7、10月0—25 cm土壤孔隙水甲烷浓度为2.00—457.00 μmol/L[11]。这一部分甲烷往往容易被人们忽视,但若受到人为或气候的干扰,可能极易释放出来,从而对湿地甲烷排放通量产生潜在影响[12]。Wang等[13]对闽江河口湿地进行研究发现,30 cm土壤孔隙水甲烷浓度与甲烷产生速率及氧化速率均存在显著相关关系。三江平原毛苔草沼泽湿地5—20 cm土壤孔隙水甲烷浓度与甲烷通量呈显著线性关系,且5 cm土壤孔隙水甲烷浓度能够解释甲烷排放通量的91%[14-15]。近年来,已有关于湿地土壤孔隙水甲烷及影响因子的研究发现土壤孔隙水甲烷的产生主要受温度及底物供应的影响,Kelley等[16]对美国White Oak河口潮汐河岸湿地研究发现夏季土壤孔隙水甲烷浓度相对较高。Yang等[11]在闽江河口区的研究发现湿地孔隙水甲烷浓度与土壤温度呈显著正相关关系。土壤孔隙水中高浓度的溶解性有机碳(DOC)能够提高沼泽湿地产甲烷速率和数量[17-18]。杨文燕等[10]在季节性冻土区三江平原的研究发现湿地土壤孔隙水甲烷浓度与土壤DOC浓度存在显著正相关关系。因此,甲烷的产生是温度和底物共同作用的结果,即温度对产甲烷的影响取决于底物的可利用性。
甲烷的产生是微生物作用的过程,因此微生物行为也是影响甲烷排放的重要因素[19]。尽管多年冻土区土壤环境极端冷湿,但仍然存在大量的产甲烷菌和甲烷氧化菌[20-21],目前冻土退化背景下泥炭沼泽土壤孔隙水中甲烷关联微生物及溶解性有机碳作何反应尚不清楚,其对温度升高的响应仍需进一步探索。因此,本研究选取大兴安岭柴桦-泥炭藓(OH)和狭叶杜香-泥炭藓(OL)两种典型植被群落泥炭沼泽,设置OTC增温及对照实验,分析土壤孔隙水中产甲烷菌功能基因(mcrA)、甲烷氧化菌功能基因(pmoA)数量变化,并结合溶解性有机碳阐释其可能的机理,以期为深入揭示未来气候暖化对冻土区泥炭沼泽甲烷释放的影响及其机制提供重要的数据支持和理论依据。
1 材料与方法
1.1 研究区概况
研究区位于黑龙江省漠河县图强林业局奋斗林场(52°56′N,122°47′E),属大陆性季风气候,年平均气温-4.3℃,年平均降水量为452 mm,降雨主要集中在7—9月。最低温为-52.3℃,最高温为37℃。该区属于连续多年冻土区,活动层深度约为50—70 cm。植被种类主要包括柴桦(Betulafruticosa)和笃斯越橘(Vacciniumuliginosum)相对较高的落叶灌木,狭叶杜香(Ledumpalustre)相对较矮的常绿灌木,白毛羊胡子草(Eriophorumvaginatum),地表有泥炭藓(Sphagnumspp.)覆盖。
1.2 样品采集与测定
本实验选取柴桦-泥炭藓和狭叶杜香-泥炭藓两种典型植被群落泥炭沼泽,分别布置开顶增温箱(Open Top Chamber,OTC)。OTC下部直径、高度和开口直径分别为2.6、2.3、1.3 m,详见文献[22]。在OTC内和对照样地分别设置孔隙水采样装置,设置3个重复。孔隙水采集装置使用内部装有不锈钢管作为取水口,下端有集水孔且用纱布包裹,底端为密封的PVC管。不锈钢管顶端连有软胶皮管,胶皮管另一端与三通阀相连以便采集水样。每次采样前,先用注射器将管内孔隙水取出。采样时将PVC管放入相应深度土壤中,静置1 h,每次取样30 mL。采样装置示意图及具体采样方法详见文献[15]。于2017年生长季(6、7、8、9月)分上、中、下三层采集柴桦-泥炭藓泥炭沼泽增温(OH-T)及对照(OH-CK),狭叶杜香-泥炭藓泥炭沼泽增温(OL-T)和对照(OL-CK)土壤孔隙水样品。生长季随着温度的升高和融深的增加,采集的深度也随季节加深,6月土壤孔隙水采集深度为5、10、15 cm,7月为10、20、30 cm,8月为10、20、30 cm,9月为20、30、40 cm。孔隙水带回实验室后过0.22 μm滤膜。提取滤膜上固体样品DNA,并应用荧光定量PCR仪测定mcrA和pmoA丰度。滤液中的DOC浓度使用Multi N/C 2100 TOC仪(德国耶拿)进行测定。土壤融深使用带有刻度的钢钎进行测量,3次重复。使用数字温度计分别测量OTC内外0、5、10、15 cm土壤温度。剖面上,地温随深度增加而降低。OTC增温处理后,6—9月0、5、10及15 cm柴桦-泥炭藓泥炭沼泽土壤温度分别增加(0.92±0.23)℃、(1.93±0.29)℃、(1.81±0.28)℃、(1.72±0.31)℃,狭叶杜香-泥炭藓泥炭沼泽土壤温度分别增加(1.06±0.24)℃、(2.21±0.25)℃、(2.00±0.32)℃、(1.72±0.22)℃。
1.3 数据分析
使用SPSS 16.0 进行三因素(增温、取样深度和采样时间)方差分析、样本t检验及一元线性回归分析。图形处理采用Origin 8制图软件完成。
2 结果
2.1 土壤融深变化特征
不同植被群落类型下大兴安岭泥炭沼泽土壤融深不尽相同。其中,8月OH与OL间土壤融深存在显著性差异(P<0.05)。OTC增温后,土壤融深在两种植被群落间的差异与对照处理一致。增温增加了生长季OH及OL土壤融深(图1)。具体表现为增温后OH生长季平均融深为47.3 cm,高于增温前的平均融深40.4 cm;增温后OL生长季平均融深为48.9 cm,高于增温前的平均融深41.8 cm。6月土壤融深的增幅最大,7月OL及8月OH和OL土壤融深在增温与对照间的差异达到显著水平(P<0.05)。总体来看,OTC对生长季大兴安岭OL土壤融深的增加幅度要高于OH。可见,本研究的OTC模拟增温效果比较理想。

图1 生长季OTC内外土壤融深变化特征
2.2 土壤孔隙水中产甲烷菌数量变化特征
分别分析两种植被群落类型OTC内、外土壤孔隙水的mcrA数量,结果表明:与对照相比,OTC内OH及OL土壤孔隙水mcrA数量均有所增加(图2)。OH生长季平均增幅为54.52%,OL生长季平均增幅为44.97%。6月OH-CK及OL-CK土壤孔隙水mcrA数量分别为6.28×109—8.80×109拷贝/mg DNA和4.81×109—5.00×1010拷贝/mg DNA,增温显著提高了OH土壤孔隙水mcrA数量(P<0.05),OTC对OH及OL土壤孔隙水mcrA数量增幅分别为90.84%和55.38%。7月OH-CK及OL-CK土壤孔隙水mcrA数量分别为1.80×1011—5.91×1011拷贝/mg DNA和2.52×1011—7.59×1011拷贝/mg DNA,但OTC对两种植被群落类型土壤孔隙水mcrA数量无显著影响(P>0.05)。8月OH-CK土壤孔隙水mcrA数量均值(9.90×1010拷贝/mg DNA)显著低于OL-CK(3.67×1011拷贝/mg DNA)(P<0.05),增温显著提高了OH土壤孔隙水mcrA数量(P<0.05),OTC对OH及OL土壤孔隙水mcrA数量增幅分别为63.3%和48.31%。9月OH-CK土壤孔隙水mcrA数量均值(7.71×1010拷贝/mg DNA)显著高于OL-CK(1.09×1010拷贝/mg DNA)(P<0.05),增温显著提高了OH土壤孔隙水mcrA数量(P<0.05),OTC使得OH及OL土壤孔隙水mcrA数量分别增加了85.40%和60.65%。OTC增温后,两种植被间mcrA数量仍存在显著性差异,具体表现为,6、9月土壤孔隙水mcrA数量为OH-T显著高于OL-T,而8月土壤孔隙水mcrA数量则为OL-T显著高于OH-T(P<0.05)。
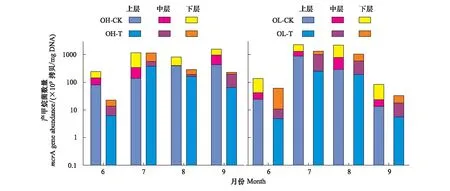
图2 生长季OTC内外不同深度土壤孔隙水产甲烷菌变化特征
剖面上,OH-CK土壤孔隙水mcrA数量在6月和7月表现为由表层至深层逐渐增加,8月和9月表层土壤孔隙水mcrA数量反而高于深层,而OL-CK土壤孔隙水mcrA数量在剖面上的变化特征各月份间比较一致,均表现为随深度增加而增加。OTC增温后,剖面上两种植被群落类型各月份土壤孔隙水mcrA数量均表现为深层高于表层。如表1所示,采样时间、增温、取样深度、增温与采样时间的交互作用及采样时间与取样深度的交互作用对两种植被群落类型土壤孔隙水mcrA数量影响显著(P<0.05)。各因素对OH土壤孔隙水mcrA数量的影响强度表现为F增温>F采样时间>F取样深度,在OL中表现为F采样时间>F增温>F取样深度。
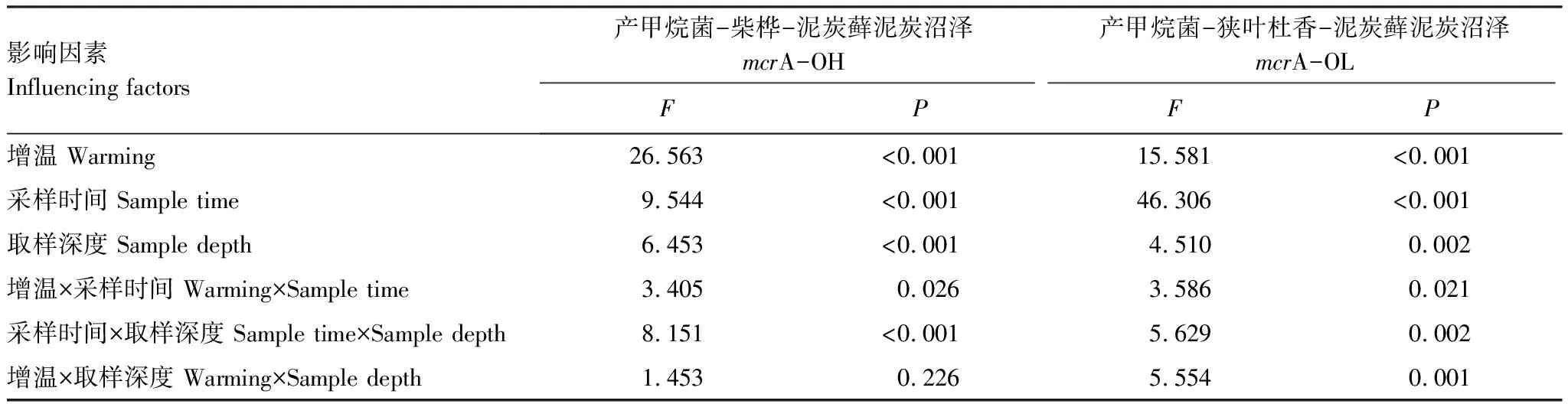
表1 生长季土壤孔隙水产甲烷菌影响因素
2.3 土壤孔隙水中甲烷氧化菌数量变化特征
对比OTC内外两种植被群落类型,增温处理使得6月和9月土壤孔隙水pmoA数量大于对照处理,而7月和8月随温度升高土壤孔隙水pmoA数量反而降低(图3)。总体来看,增温使得OH生长季土壤孔隙水平均pmoA数量降低了46.2%,使得OL生长季土壤孔隙水平均pmoA数量降低了31.42%。6月OH-CK及OL-CK土壤孔隙水pmoA数量分别为7.56×109—1.23×1010拷贝/mg DNA和2.74×109—1.42×1010拷贝/mg DNA,增温处理对两种植被群落类型土壤孔隙水pmoA数量影响并不显著(P>0.05)。7月OH-CK土壤孔隙水pmoA数量均值(4.79×1011拷贝/mg DNA)显著高于OL-CK(7.77×1010拷贝/mg DNA)(P<0.05),增温处理对两种植被群落类型土壤孔隙水pmoA数量影响并不显著(P>0.05)。8月OH-CK及OL-CK土壤孔隙水pmoA数量分别为8.45×1010—5.87×1011拷贝/mg DNA和1.99×1011—3.80×1011拷贝/mg DNA,增温显著降低了OH及OL土壤孔隙水pmoA数量(P<0.05),增温使得OH和OL土壤孔隙水pmoA数量分别减少了56.10% 和56.06%。9月OH-CK土壤孔隙水pmoA 数量均值(2.17×109拷贝/mg DNA)显著低于OL-CK(1.20×1010拷贝/mg DNA)(P<0.05),增温显著提高了OH及OL土壤孔隙水pmoA数量(P<0.05),OTC处理下OH和OL土壤孔隙水pmoA数量增幅分别为46.02% 和81.16%。OTC增温后,两种植被群落间土壤孔隙水pmoA数量仍存在显著性差异,7月和8月土壤孔隙水pmoA数量均表现为OH-T显著高于OL-T,而9月土壤孔隙水pmoA数量表现为OL-T显著高于OH-T(P<0.05)。
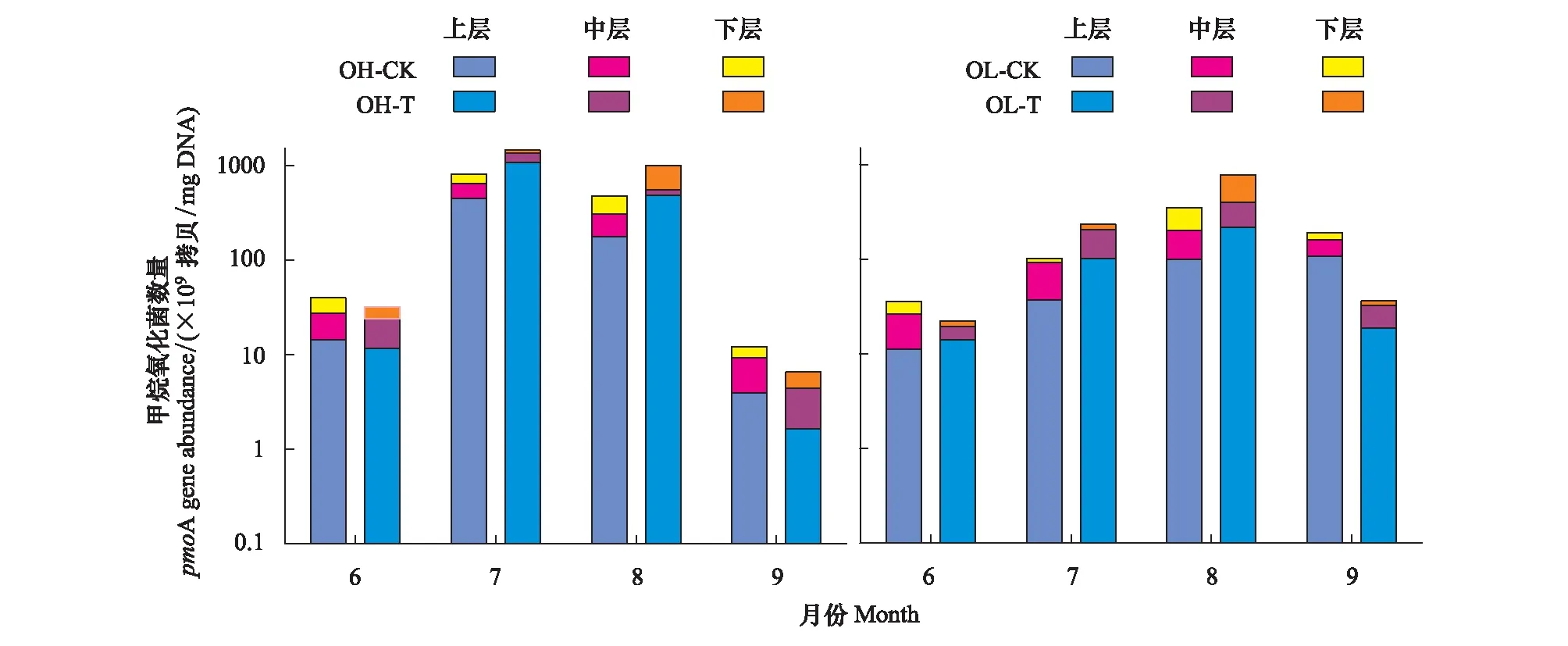
图3 生长季OTC内外不同深度土壤孔隙水甲烷氧化菌变化特征
土壤孔隙水pmoA数量在剖面上的分布特征与mcrA存在很大差异,OH-CK土壤孔隙水pmoA数量于6、7、8月均表现为表层最高,而9月则为中层最高。OL-CK土壤孔隙水pmoA数量于6、7、9月均表现为由表层至深层逐渐降低,而在8月时其深层土壤孔隙水pmoA数量反而增大。增温后,两种植被群落类型土壤孔隙水pmoA数量在剖面上于6、7、9月随深度增加而降低,而8月深层pmoA数量反而高于表层,且8月的OL-T土壤孔隙水pmoA数量表现为中层显著高于表层和深层(P<0.05)。如表2所示,增温、采样时间、取样深度、增温与采样时间的交互作用、采样时间与取样深度的交互作用对两种植被群落类型土壤孔隙水pmoA数量影响显著(P<0.05)。其中,采样时间对两种植被群落类型下土壤孔隙水pmoA数量影响最大。
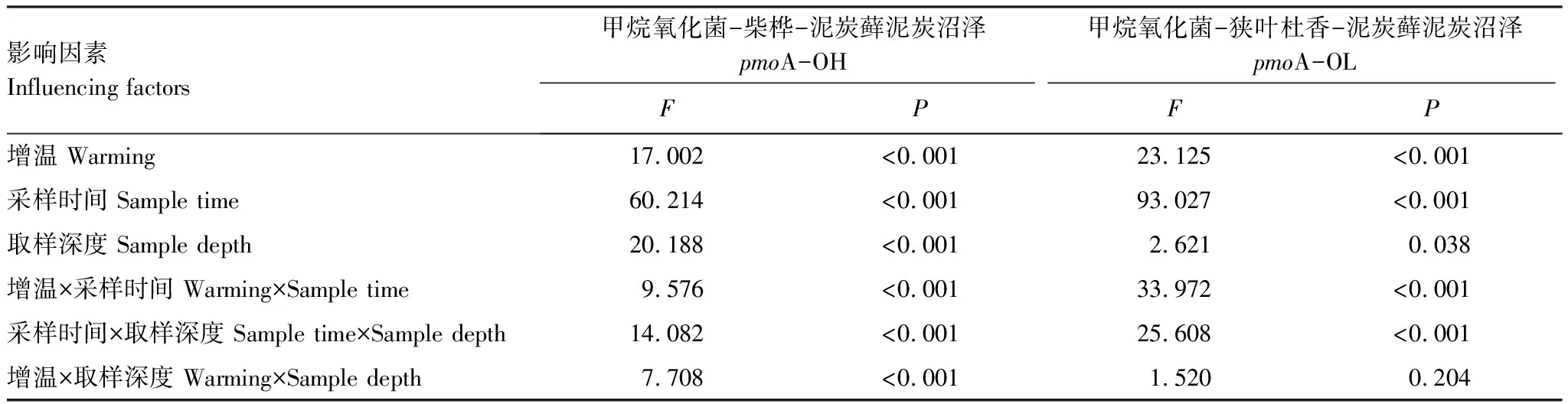
表2 生长季土壤孔隙水甲烷氧化菌影响因素
2.4 土壤孔隙水中DOC浓度变化特征
OTC增温处理下两种灌丛-泥炭藓泥炭沼泽土壤孔隙水DOC浓度均有所增加(图4)。OH生长季平均增幅为34.16%,OL生长季平均增幅为28.33%。6月OH-CK土壤孔隙水DOC浓度均值(21.27 mg/L)显著低于OL-CK(29.35 mg/L)(P<0.05),增温显著提高了OH土壤孔隙水DOC浓度(P<0.05),OTC对OH和OL的DOC浓度的增幅分别为19.52% 和19.36%。7月OH-CK土壤孔隙水DOC浓度均值(17.11 mg/L)显著高于OL-CK(5.55 mg/L)(P<0.05),增温显著提高了OH及OL的DOC浓度(P<0.05),增温导致 OH和OL的DOC浓度增幅分别为58.43% 和53.90%。8月OH-CK及OL-CK的DOC浓度分别为21.53—28.47 mg/L和18.16—24.63 mg/L,增温处理对两种植被群落类型土壤孔隙水DOC浓度的影响并不显著(P>0.05)。9月OH-CK及OL-CK的土壤孔隙水DOC浓度分别为28.08.69—41.21 mg/L和33.69—43.00 mg/L,增温显著提高了OH及OL的DOC浓度(P<0.05),增温导致OH和OL的DOC浓度分别增加了35.51% 和34.93%。OTC增温处理下的6、7、9月不同植被类型间土壤孔隙水中DOC浓度与对照处理表现一致,而8月的OH-T的DOC浓度显著高于OL-T(P<0.05)。

图4 生长季OTC内外不同深度土壤孔隙水溶解有机碳含量
垂直剖面上,OH-CK土壤孔隙水DOC浓度在6、7、8、9月较为一致,均为深层高于表层;而OL-CK的土壤孔隙水中DOC浓度剖面分布特征在各月份间差异较大,其中6、8、9月分布特征与OH-CK一致,而7月时表现为随深度逐渐降低的趋势。增温处理后两种植被群落类型下DOC浓度剖面变化规律一致,均表现为深层高于表层。如表3所示,增温和采样时间对两种植被群落类型土壤孔隙水DOC浓度影响显著(P<0.05),且增温与采样时间的交互作用对OH的DOC浓度影响显著(P<0.05)。
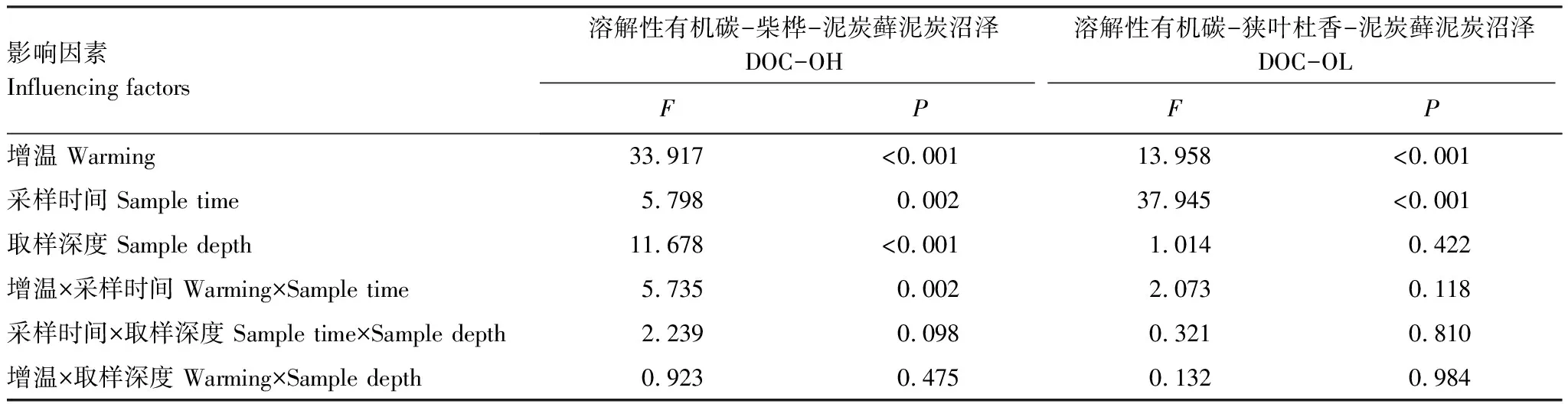
表3 生长季土壤孔隙水溶解性有机碳影响因素
一元线性回归分析结果表明,OH土壤孔隙水中DOC浓度可解释土壤孔隙水中mcrA数量变化的29.00%,回归方程为y=8.84×109X(P<0.01)。OL土壤孔隙水中DOC浓度可解释土壤孔隙水中mcrA数量变化的24.10%,回归方程为y=-1.05×1010X+5.76×1011(P<0.01)。而土壤孔隙水中DOC浓度对两种植被群落下土壤孔隙水中pmoA数量影响并不显著(P>0.05)。
3 讨论
3.1 增温对土壤孔隙水中产甲烷菌和甲烷氧化菌数量的影响
全球气候变暖及其导致的多年冻土退化已经使得大兴安岭多年冻土区环境发生显著变化,而参与土壤孔隙水甲烷排放过程的产甲烷菌和甲烷氧化菌的组成及活性极易受到土壤温度以及土壤养分有效性等的影响[21]。因此,土壤孔隙水中的产甲烷菌和甲烷氧化菌对多年冻土退化的响应将可能决定多年冻土退化后湿地甲烷通量变化。本研究表明增温处理提高了大兴安岭两种典型植被群落类型泥炭沼泽土壤孔隙水中产甲烷菌数量,这与位于西伯利亚北部[21]、北极[23]以及阿拉斯加[24]泥炭地的相关研究结果一致。其原因为寒区微生物的生长最适温度可能远高于原位温度[25]。同时,温度的变化将导致一系列级联反应发生,Saarnio等[26]认为低温限制了根系分泌物的分解,从而减少了产甲烷底物的供应,抑制了甲烷的产生和排放。Dorrepaal等[27]研究发现增温能促进CO2的排放,而CO2的浓度的增加可为氢型产甲烷菌提供更多底物。Allan等[28]研究表明,温度变化会改变湿地生态系统产甲烷菌群落结构和多样性,使得产甲烷优势菌群发生演替。丁维新等[29]则认为,不同气候带不同类型湿地土壤最佳产甲烷温度存在差异,这与产甲烷菌的类型及其对环境的适应能力有关。
甲烷氧化菌对增温的响应在本研究中较为复杂,其变化因月份而异。蔡传辉[30]指出15—35℃是甲烷氧化菌适应性强的温度范围,且其丰度随温度升高而升高,但也有研究表明甲烷氧化菌对温度的敏感性较产甲烷菌低[31]。我们的研究发现增温显著降低了8月柴桦-泥炭藓泥炭沼泽和狭叶杜香-泥炭藓泥炭沼泽的pmoA数量,其原因可能与菌群结构的变化有关。Knoblauch等[32]研究发现,增温使得冻土中Ⅰ型甲烷氧化菌的重要性下降,而Ⅱ型甲烷氧化菌的重要性增加。在冻土环境中,Ⅰ型甲烷氧化菌占有绝对优势[33]。在全球气温不断上升背景下,大兴安岭泥炭沼泽土壤孔隙水微生物群落组成、多样性和活性将作出怎样的响应需要进一步的深入研究。
本研究中,产甲烷菌的数量在柴桦-泥炭藓泥炭沼泽和狭叶杜香-泥炭藓泥炭沼泽中有所差异,且柴桦-泥炭藓泥炭沼泽的产甲烷菌对增温响应更加敏感。王洁等人[34]研究同样发现不同植被类型湿地产甲烷菌群落具有差异。其原因可能为,产甲烷菌是一类能够将无机或有机化合物厌氧硝化转化成甲烷和二氧化碳的古细菌,而植物通过根系分泌物(如有机酸、糖类、氨基酸等)和脱落物尤其是残留物为产甲烷菌提供底物[35]。不同植被群落类型,其根系分泌物不同,进而导致产甲烷菌数量不同。研究同样发现不同植被下土壤孔隙水中甲烷氧化菌数量存在差异。这可能是因为植被根系周围的根际土壤常处于好氧状态,为甲烷氧化菌创造了极佳的微环境[36],同时植物根系释放的氧气会在根际形成高氧化还原电位的氧化区,为甲烷氧化菌提供有利条件,增加了甲烷的消耗,而不同植物根系分泌氧气能力的差异可能导致了甲烷氧化菌丰度的差异[31]。
3.2 增温对土壤孔隙水中DOC浓度的影响
土壤孔隙水的DOC主要来源于植物凋落物、根系及其分泌物、微生物代谢物[37]。本研究中OTC处理增加了两种植被群落泥炭沼泽土壤孔隙水DOC浓度,这与前人的研究结果相似,Kane等[38]研究表明增温处理导致生长季土壤孔隙水DOC浓度增加15%。Christ等[39]研究表明,随着温度升高,DOC的产生量随温度增加呈指数函数增加。这可能是由于增温能够促进植物生长发育进而增加根系分泌物,同时增温使得降解土壤基质的微生物活性升高[40]。温度的升高能够加速土壤微生物的周转代谢,导致土壤有机碳的矿化和转化速率升高,从而对DOC的动态变化产生影响[39,41]。此外,本研究中两种植被群落土壤孔隙水中DOC含量存在差异的原因可能为,植被类型不同导致凋落物的数量和质量、微生物群落的结构和活性、微生物残体和代谢产物以及根系分泌物和根系周转等存在差异,进而影响DOC的含量和空间分布[42]。
植物通过根系分泌物和脱落物为产甲烷菌提供底物,而底物丰富度直接决定了产甲烷菌功能的发挥[43]。DOC作为土壤微生物的可利用性底物,为产甲烷菌提供基质,从而增加甲烷排放[44]。已有研究发现,与冻土的原位地表温度相比,DOC组成结构及含量对产甲烷作用的影响更显著[33,45]。同样,本研究中OH土壤孔隙水中mcrA数量随DOC含量增加而增加,且DOC含量可解释产甲烷菌变化的29%。而OL土壤孔隙水中mcrA数量随DOC含量增加反而降低。这是由于两种植被群落的有机质组成存在差异。后者的有机酸具有较强的抗分解能力,无法进一步转化为可供产甲烷菌直接利用的的底物[46]。
4 结论
通过OTC模拟增温实验观测到大兴安岭多年冻土区生长季柴桦-泥炭藓和狭叶杜香-泥炭藓泥炭沼泽土壤孔隙水mcrA数量、pmoA数量及DOC浓度对增温响应存在差异。增温提高了柴桦-泥炭藓和狭叶杜香-泥炭藓泥炭沼泽土壤孔隙水中产甲烷菌数量,且柴桦-泥炭藓泥炭沼泽土壤孔隙水中产甲烷菌数量对增温更加敏感。增温对甲烷氧化菌数量的影响因月份而异,6月和9月增温提高了pmoA数量,而7月和8月pmoA数量随温度升高反而降低,说明增温有利于土壤孔隙水甲烷的排放。增温提高了大兴安岭多年冻土区柴桦-泥炭藓和狭叶杜香-泥炭藓泥炭沼泽土壤孔隙水中DOC浓度。此外,两种植被群落泥炭沼泽土壤孔隙水中DOC浓度可分别解释产甲烷菌变化的29.00%和24.10%,说明泥炭沼泽土壤孔隙水产甲烷过程受可利用碳基质的影响。因此,未来气候变暖可能会通过提高孔隙水产甲烷数量和溶解有机碳含量进而促进大兴安岭多年冻土区泥炭沼泽甲烷排放。

