环氧丙烷对仿刺参抗氧化酶和免疫酶活性的影响
王丽梅,李多慧,罗耀明,鹿志创,何平
(1.辽宁省海洋水产科学研究院,辽宁省海洋生物资源和生态学重点实验室,辽宁 大连 116023;2.大连市现代农业生产发展服务中心,辽宁 大连 116085)
环氧丙烷(Propylene epoxide)(又称1,2-环氧丙烷,甲基环氧乙烷,氧化丙烯)为无色醚味液体,低沸点、易燃,是非常重要的有机化合物原料,被广泛应用于各个领域。环氧丙烷具有急性毒性,长期接触低质量浓度环氧丙烷的职业人群具有细胞遗传学毒性,可损伤人的DNA[1,2],损害动物和人周围神经[3]。近20 年来,环氧丙烷需求强劲增长,认我国和印度为首的亚太地区是环氧丙烷产能和消费增长最快的地区[4]。2018 年我国环氧丙烷产能达到3.39×106t/年,供应量达到2.74×106t[5]。随着有机化工产业的迅速发展,越来越多的有机物通过生产和使用进入到环境的各个领域,而海洋是其进入环境后的重要归宿。海洋中有机物污染主要来源于海上船载化学品的泄漏、沿海石油化工企业的废水排放以及化学品船有毒液体物质(NLS)污水的直接排放[6]。有机化工产业的发展增加了有机物环境污染及其引发的生态风险[7]。
仿刺参(Apostichopus japonicus)是我国水产品中单一经济总量较大的海水养殖种类。仿刺参对生长环境要求较高,对环境污染较为敏感,遇到强烈刺激或环境异常时,常产生化皮、“排脏现象”;仿刺参容易饲养,基础生物学研究较深入,常被用于环境毒理学的相关研究[8-14]。仿刺参属非特异性免疫,而行使免疫功能的细胞主要存在于体腔细胞中[15]。超氧化物歧化酶(Superoxide dismutase,SOD)是机体产生的一种内源性生物酶,可以有效清除氧自由(ROS)和超氧阴离子,阻止ROS 对细胞膜、生物酶以及DNA 的破坏[16,17],在维持生物机体内的ROS产生与消除的动态平衡中起重要的作用[18]。过氧化氢酶(Catalase,CAT)也具有清除ROS 的功能,对增强吞噬细胞防御能力和机体免疫功能有重要作用[19]。CAT 活性的变化能够反应出生物在有机物胁迫下的免疫力[20]。酸性磷酸酶(Acid phosphatase,ACP)是溶酶体的一种标志酶,主要参与细胞内蛋白质的消化和吸收[22-22]。碱性磷酸酶(Alkaline phosphatase,ALP)参与生物体营养物质如脂质、糖类、钙和无机磷酸盐的吸收[23],在碱性环境中(最佳pH 约为10)可以催化各种醇和磷酸苯酚的水解[24]。ACP 和ALP是参与生物体生长代谢、保持内环境稳定及维持机体健康所必需的酶,对生物体的免疫作用具有重要意义。有关有机污染物对水生生物毒理学的研究较多[25-30],但环氧丙烷对海洋生物急性毒性及毒理学的报道较少[9,31]。本研究通过探讨环氧丙烷对仿刺参体内的抗氧化酶和免疫酶活性的影响,可为研究环氧丙烷对海洋生物的毒性提供理论参考。
1 材料与方法
1.1 材料
试验用仿刺参幼参取自大连金州区杏树屯某育苗场,在实验室暂养1 周后用于正式试验。暂养期间,每日按照仿刺参体质量的5%投喂配合饵料,死亡率为0。禁食24 h 后,选取大小均匀、健康刺参[体质量(5.23±0.96)g],水温控制在13.9℃~15.9℃,溶解氧>6 mg/L,盐度30~31 进行试验。
试验使用的主要仪器与试剂有:多功能酶标仪(瑞士Tecan)、CTl5RE 型台式微量高速离心机(日本Hitachi)、Me104e 电子天平(瑞士Mettler toledo)、IMS-100 全自动雪花制冰机(常熟市雪科电器有限公司)。环氧丙烷为化学纯,购自中国国药有限公司。SOD、CAT、ACP 和ALP 活性及总蛋白含量等由南京建成生物工程研究所的试剂盒测定。
1.2 方法
先配制成0.04 g/mL 环氧丙烷母液,根据急性毒性的预试验结果,调配出所需试验质量浓度:100.00 mg/L、200.00 mg/L、300.00 mg/L、400.00 mg/L、500.00 mg/L 和600.00 mg/L,每个梯度设3 个平行样。每个10 L 玻璃缸中放入20 头幼参,随时观察其生活情况,统计24 h、48 h、72 h、96 h 幼参死亡率。
参照《水生生物检测手册》静水式毒性法[32]进行试验。死亡率为每组3 个平行结果的平均值,按照周永欣的《水生物毒性试验方法》[33]进行校正。参照熊治延[34]方法计算剂量-反应相关关系、半致死质量浓度、95%置信区间和安全质量浓度等。
仿刺参亚致死效应的试验方法参照高士博等[11]、罗耀明等[8],用急性毒性试验得到的96 h 半致死质量浓度来设计亚致死效应试验,3 个环氧丙烷质量浓度按等比级数(1/5、1/25、1/125 的96 h-LC50)分别设定为0.83 mg/L(低质量浓度)、4.15 mg/L(中质量浓度)和20.77 mg/L(高质量浓度),以自然海水为对照组,每组设3 个平行。每个10 L 玻璃缸中放入30 头幼参,试验期间不充气、不投饵,每24 h 换水1 次。试验开始后24 h、48 h、72 h 及96 h,每次从每缸随机取5 头仿刺参作为一个样本,用0.9%的生理盐水冲洗后,用灭菌滤纸吸干体表水分,在灭菌冰培养皿中迅速解剖,收集仿刺参体腔液装进离心管中,放入超低温冰箱(-80℃)中冷冻保存待用。
总蛋白含量、SOD、CAT、ACP、ALP 活性的测定参照各测试盒说明书进行。
SOD、CAT、ACP、ALP 酶活性定义单位分别为U/mg、U/mg、U/g 和金氏单位/g,即酶活水平/总蛋白含量。
1.3 数据处理
数据采用SPSS17.0 统计软件进行单因素方差分析(one-way ANOVA),用Duncan 法做多重比较,显著性水平为P<0.05,极显著性水平为P<0.01。
2 结果与分析
2.1 环氧丙烷对超氧化物歧化酶活性的影响
中、高质量浓度环氧丙烷暴露24 h 时,诱导了仿刺参体腔液中SOD 活性,其中高质量浓度的诱导活性显著增高(P<0.05〉;暴露48 h 时,各质量浓度环氧丙烷对SOD 活性均有诱导作用,但均无显著影响(P>0.05);暴露72 h 时,各质量浓度对SOD 活性均有抑制作用,中质量浓度有显著抑制作用(P<0.05),高质量浓度有极显著抑制作用(P<0.01);暴露96 h 时,低、中质量浓度环氧丙烷对仿刺参体腔液中SOD 活性的诱导及抑制均不显著(P>0.05),只有高质量浓度抑制作用显著(P<0.05)(图1)。
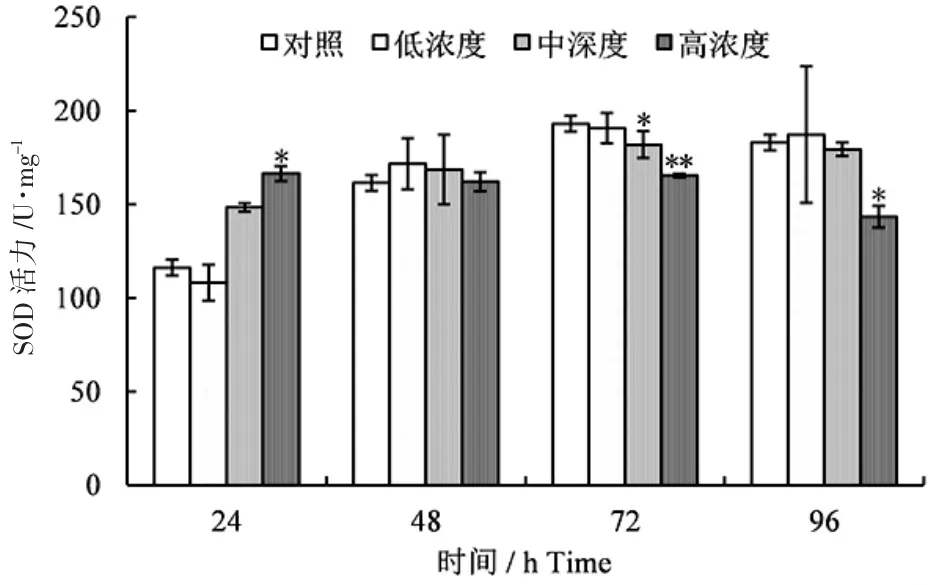
图1 环氧丙烷对仿刺参体腔液中SOD 活性的影响Fig.1 Effect of propylene oxide on SOD activity in the coelomic fluid of sea cucumber A.japonicus
2.2 环氧丙烷对过氧化氢酶活性的影响
环氧丙烷对CAT 活性的影响见图2。由图2 可知,暴露24 h 时,不同质量浓度环氧丙烷对仿刺参体腔液中CAT 活性均呈不同程度诱导作用,只有高质量浓度有极显著的诱导作用(P<0.01),其他质量浓度诱导不显著(P>0.05);暴露48 h 时,反应最强烈,不同质量浓度环氧丙烷对其活性均有极显著抑制作用(P<0.01);暴露72 h 时,不同质量浓度环氧丙烷对CAT 活性均有诱导,只有低质量浓度有极显著诱导作用(P<0.01);暴露96 h 时,不同质量浓度环氧丙烷对CAT 活性影响呈现分化现象,低、高质量浓度具有抑制作用,中质量浓度有诱导作用,但影响均不显著(P>0.05)。

图2 环氧丙烷对刺参体腔液中CAT 活性的影响Fig.2 Effect of propylene oxide on CAT activity in the coelomic fluid of sea cucumber A.japonicus
2.3 环氧丙烷对刺参酸性磷酸酶活性的影响
在暴露24 h 时,环氧丙烷对仿刺参体腔液中的ACP 活性有一定的诱导作用和抑制作用,但作用均不显著(P>0.05);在暴露48 h 时,不同质量浓度环氧丙烷对ACP 活性有诱导作用,但不显著(P>0.05);在暴露72 h 时,中、高质量浓度组的环氧丙烷对ACP 活性分别有极显著(P<0.01)和显著(P<0.05)抑制作用;在96 h 时低、高质量浓度环氧丙烷对ACP 活性有抑制作用,其中高质量浓度组环氧丙烷对其有极显著(P<0.01)抑制作用,中质量浓度有不显著的诱导作用(P>0.05)(图3)。

图3 环氧丙烷对刺参体腔液中ACP 活性的影响Fig.3 Effect of propylene oxide on ACP activity in the coelomic fluid of sea cucumber A.japonicus
2.4 环氧丙烷对刺参碱性磷酸酶的影响
在暴露24 h 时,不同质量浓度环氧丙烷对刺参体腔液中碱性磷酸酶(ALP)活性有一定的诱导和抑制作用,但作用均不显著(P>0.05);在48 h 时,各质量浓度环氧丙烷对仿刺参体腔液中ALP 活性均有诱导作用,高质量浓度组有极显著诱导作用(P<0.01);暴露72 h 时,低质量浓度环氧丙烷对ALP活性有极显著诱导作用(P<0.01),中质量浓度对其有显著抑制作用(P<0.05);暴露96 h 时,不同质量浓度环氧丙烷对ALP 活性均有抑制作用,高质量浓度环氧丙烷抑制作用显著(P<0.05)(图4)。

图4 环氧丙烷对刺参体腔液中ALP 活性的影响Fig.4 Effect of propylene oxide on ALP activity in the coelomic fluid of sea cucumber A.japonicas
3 讨论
3.1 环氧丙烷对刺参体腔液中抗氧化酶活性的影响
抗氧化酶SOD 和CAT 活性的改变可以反映生物体在不同胁迫条件下的生理状况[35]。受到环氧丙烷胁迫后,随着作用时间的延长,仿刺参体腔液中不同抗氧化酶活性的变化趋势不同,首先表现在短期的毒物兴奋效应,可能因机体内稳态受到干扰而引起过度补偿[36,37],即生物体的一种自我矫正[38]。短期环氧丙烷胁迫,机体产生防御能力和免疫力,在高质量浓度污染物刺激下,体内产生大量ROS,细胞迅速启动一系抗氧化通路维持细胞内环境稳定[14],阻止ROS 对生物体的破坏,诱导仿刺参体内SOD、CAT 的活性显著增强,通过消除体内ROS,来调节其体内内环境的稳态;随着作用时间延长和ROS 的质量浓度增加,机体内抗氧化酶无法及时消除过多ROS,破坏了体内内环境的稳态,抑制了生物体内抗氧化酶[39],导致抗氧化酶活性降低。48 h时在不同质量浓度污染物胁迫下CAT 活性均被破坏,受到极显著抑制;暴露时间进一步延长则抑制作用逐渐减小至无显著影响,抗氧化酶活性恢复,而72 h 时在中、高质量浓度环氧丙烷刺激下SOD活性在才受到显著抑制,而这时CAT 活性得到恢复,机体的抗氧化能力增强,有效清除体内ROS,SOD 活性恢复要慢,直到96 h 时高质量浓度组还对其有显著抑制作用,持续损伤体内的SOD 活性。这一结果与张喆等[29]研究十溴联苯醚对菲律宾蛤仔(Ruditapes philippinarum)抗氧化酶活性影响的结果相似,与罗耀明等[8]研究异戊二烯对刺参抗氧化酶活性的影响不同,在其研究中短期内异戊二烯对仿刺参体腔液SOD 活性有诱导作用与本试验相同,但诱导作用比本试验大,到96 h 时中、低质量浓度组仿刺参SOD 活性还有显著诱导作用,只有高质量浓度组有极显著抑制作用,而本试验后期只有显著抑制作用;异戊二烯从胁迫开始就一直抑制刺参体内的CAT 活性,且随着时间延长质量浓度增高抑制作用更强,表现为单调的剂量—效应关系。可能正因为异戊二烯对CAT 活性有显著抑制,导致其毒性比环氧丙烷更强,这与罗耀明等[9]比较几种有机污染物对刺参幼参毒性结果一致。与本试验结果不同的是,姜北[10]研究认为,中、低质量浓度苯系物对仿刺参SOD 活性有诱导作用,而高质量浓度有抑制作用。高士博等[11]研究发现,暴露12 h 苯系物诱导了刺参呼吸树中CAT 酶活性,抑制了肠组织中CAT活性。这种短期诱导作用与本试验相同,不同的是有的化合物对仿刺参抗氧化酶只有诱导作用,而无抑制作用。田秀慧等[40]研究表明,氨基脲对仿刺参的SOD 和CAT 活性均有诱导作用,诱导强度随时间延长而降低;同样,张晶[12]研究表面活性剂成分十二烷基磺酸钠(SDS)对仿刺参幼参的毒理效应,对比幼参体肌中的SOD 和CAT 活性变化发现,污染暴露对幼参体壁肌中SOD 和CAT 活性的诱导效应存在时间依赖性,对内脏中SOD 活性的诱导效应存在时间依赖性,与SDS 暴露质量浓度无关。
3.2 环氧丙烷对刺参体腔液中免疫酶活性的影响
本实验中,前期(24 h)环氧丙烷胁迫对ACP、ALP 免疫酶活性无显著影响,仿刺参细胞膜能正常吸收脂质、糖类、钙和无机磷酸盐;直到暴露48 h时,高质量浓度环氧丙烷的强刺激下ALP 产生毒物兴奋效应[36,37],极显著诱导了其活性,表明刺参在有机物胁迫下,提高了自身的非特异性的免疫功能,随着时间延长,中、高质量浓度环氧丙烷对免疫酶活性产生了显著抑制作用。免疫酶活性的变化促进或抑制了刺参机体的营养吸收,打破刺参生长代谢的平衡,阻碍了机体蛋白质的消化吸收,可能导致仿刺参营养不良,影响机体健康。
与抗氧化酶活性相比,环氧丙烷影响仿刺参体腔液中免疫酶活性的时间滞后、程度小,这一与罗耀明等[9]研究的结果一致。从污染物对两种免疫酶活性影响来看,对ACP 活性无显著诱导,只有作用时间长的显著抑制作用;而ALP 活性变化与此不同,是先诱导后抑制,这一结果与本试验的抗氧化酶SOD 活性变化趋势相似,这表明外源性化合物对仿刺参机体内ALP 活性的影响与机体抗氧化还原系统间存在一定的联系[40]。本试验结果与罗耀明等[9]研究结果不同,异戊二烯对仿刺参体腔液中免疫酶活性只有显著诱导作用,而无暴露时间延长的显著抑制作用。田丽粉等[30]认为,低质量浓度的原油对牙鲆(Paralichthys olivaceus)幼鱼的肝脏ALP活性只有诱导作用,随着质量浓度的升高对其活性影响越大。
3.3 结论
(1)环氧丙烷对仿刺参体腔液中SOD、ACP、ALP和CAT 4 种酶活性影响不同,对CAT 活性抑制作用最大,但恢复也最快;除对ACP 活性诱导作用不显著外,对其他3 种酶活性均是前期显著诱导,后期活性均受到显著抑制;对SOD、ACP、ALP 活性抑制作用持续时间长,至96 h 时高质量浓度环氧丙烷仍有显著抑制作用。
(2)环氧丙烷对仿刺参体内免疫酶活性的影响时间滞后于抗氧化酶活性的影响,影响程度较小。

