Zeb2通过EMT过程调节小鼠脊髓损伤后星形胶质细胞增多及运动功能恢复
张润琛,李 辉,陈旭义,涂 悦
(1.天津中医药大学研究生院,天津 300193;2.武警特色医学中心神经创伤研究所,天津 300162)
脊髓损伤(spinal cord injury,SCI)会引发星形胶质细胞增生[1],星形胶质细胞增多和星形胶质细胞边界形成在保护神经元和神经功能方面发挥重要作用,破坏星形细胞对损伤的反应会增加病变程度,并恶化神经功能的恢复[2-4]。SCI的星形细胞反应与非神经组织的伤口愈合有许多相似之处[5],例如在一些组织中,严重的损伤和炎症可导致纤维化和形成类似于慢性星形胶质细胞边界的疤痕组织边界。非神经伤口愈合过程涉及上皮细胞向间充质表型的过渡,包括广泛的细胞骨架重塑,降解的细胞间连接[6]。这种上皮-间充质转化(epithelial-to-mesenchymal transitions,EMT)通过信号传导途径促进的,例如JAK/STAT、表皮生长因子和肿瘤坏死因子α等[7,8]也可促进受伤后的星形胶质细胞增多[9]。除伤口愈合外,EMT还在神经发育和癌症转移中也是一个经过充分研究的过程[10]。
Zeb2编码锌指同源域转录因子蛋白,在伤口愈合、神经发育和癌症控制细胞活动性、细胞黏附和细胞骨架重组中具有确定的作用[11]。 Zeb2还调节神经发育中的多个过程,包括神经外胚层形成、其他细胞增殖和分化[12-14]。然而,尚不清楚Zeb2在正常或病理条件下成人中枢神经系统中的作用。本研究通过Zeb2条件敲除探讨Zeb2在调节SCI中对损伤的星形细胞的作用。
1 材料与方法
1.1 实验动物与主要材料
24只C57BL/6J 雄性健康小鼠,3~4个月龄,重约25 g,购自北京维通利华,12只Zeb2cKO(选择性星形胶质细胞内Zeb2基因敲除)雄性健康小鼠,3~4个月龄,重约25 g,购自苏州塞业生物,饲养在SPF级实验室,分开置于笼中圈养,提供充足食物和水。兔抗鼠Zeb2一抗、兔抗鼠GFAP一抗、兔抗鼠N-cadherin一抗、兔抗鼠E-cadherin一抗(美国,Sigma公司);兔抗鼠β-actin一抗(美国,Abcam公司);蛋白酶K(瑞士,Roche公司);4′,6-diamidino-2-phenylindole(DAPI)(美国,Cayman Chemical),BCA 蛋白试剂盒(中国,碧云天科技公司)。
1.2 SCI模型制备及分组
根据Allen's方法的改进脊髓打击器[9,15]诱导小鼠SCI模型。2.5%异氟烷麻醉小鼠后消毒,切开分离皮肤,行椎板切除术显露脊髓T10段。打击器(重10 g,直径3 mm,长度200 mm)从50 mm的高度掉落到脊髓表面,止血后缝合皮肤。成功诱发SCI可导致脊髓充血、摆尾反射、后肢抖动伸直。在手术后的前2 d,每天2次给予丁丙诺啡(0.05 mg/kg)以减轻疼痛,每天要提供1~2次乳酸林格氏液(1 mL),以防止脱水。在手术后的前3 d,每天1次给予庆大霉素(5 mg/kg),以防止感染。所有小鼠被放置在24℃的环境中,提供充足的水、食物和干净的垫料,每日3次间歇性辅助排尿。实验分为对照组(sham组12只C57小鼠)、脊髓损伤组(SCI组12只C57小鼠)和脊髓损伤Zeb2条件敲除组(Zeb2cKO组12只Zeb2cKO小鼠),SCI组和Zeb2cKO组采用脊髓打击法建立SCI小鼠模型,sham组仅切除椎板,各组小鼠分别通过腹膜内注射以100 mg/kg剂量的他莫昔芬(2.5 mg溶于0.1 mL玉米油/乙醇按9∶1的混合物中)。在SCI前3 d、SCI当天和SCI后3 d,每天他莫昔芬腹腔注射。2周后将小鼠安乐死,取脊髓用于进一步实验。
1.3 运动功能评分
在SCI后1、3、7、14 d使用Basso Beattie Bresnahan(BBB)运动能力评定量表[16]进行后肢运动功能评估。BBB评分范围从0分(完全后肢瘫痪)到21分(正常运动)不等。评分由实验小鼠的运动能力决定,包括后肢的运动、负重、前肢和后肢运动的协调性。小鼠被放置在木制模型的开阔区域4 min,由2名研究人员采用盲法对其进行评分。
1.4 组织收集
通过CO2过度通气处死小鼠。对于进行定量PCR和Western印迹的小鼠,取出脊髓组织立即—80℃储存用于下一步实验分析。对于进行HE及免疫荧光分析的小鼠,先用盐水和肝素经心脏灌注,然后在Sorenson缓冲液中加入4%多聚甲醛,将组织固定。
1.5 定量PCR
冷冻组织用杵在浸没在干冰/乙醇中的微离心管中研磨。根据制造商的说明,使用QIAshredder离心柱和动物小RNA提取试剂盒分离RNA。使用Nanodrop微量分光光度计定量RNA,并用Superscript®III First-Strand Synthesis试剂盒生成cDNA。使用荧光实时定量PCR系统进行实时RT-PCR扩增。具体引物序列如下:Zeb2上游引物(5'-TAGCCGGTCCAGAAGAAATG-3')和下游引物(5'-GGCCATCTCTTTCCTCCAGT-3');β-actin上游引物(5'-GAGAGGGAAATCGTGCGTGAC-3')和下游引物(5'-CATCTGCTGGAAGGTGGACA-3')。
1.6 Western印迹
将脊髓组织病灶中心机械破碎后用1×RIPA缓冲液超声处理终浓度为1∶100的蛋白酶抑制剂混合物。将样品在4 ℃下以15 000 g离心40 min,将上清液用于Western blot研究含有蛋白酶抑制剂的RIPA缓冲液产生总蛋白样品。采用BCA蛋白定量法分析确定总蛋白质浓度。使用BCA蛋白质测定试剂盒测量每个样品的总蛋白质量。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,半干转移至聚偏二氟乙烯膜。将膜在4 ℃下用含10%脱脂奶粉的TBST缓冲盐水封闭1 h,然后在含一抗的10%脱脂奶粉的TBST缓冲液过夜:兔抗Zeb2抗体(1∶1 000)兔抗GFAP抗体(1∶1 000)兔抗N-cadherin抗体(1∶1 000)兔抗E-cadherin抗体(1∶1 000)兔抗β-actin抗体(1∶1 000)。TBS-T冲洗4次,然后将膜与辣根过氧化物酶偶联的IgG抗兔(1∶10 000)二级抗体孵育2 h,TBS-T冲洗4次, ECL plus用于信号检测,Image J 软件用于定量分析。
1.7 免疫荧光
将固定好的小鼠脊髓损伤节段制成蜡块,切成5 μm厚连续切片,脱蜡,蛋白酶K修复30 min,用含0.1% Triton X-100 (PBST)的PBS洗涤30 min,5% BSA和10%正常驴血清封闭非特异性抗体60 min,分别用Zeb2/DAPI、GFAP/DAPI荧光标记染色。首先将切片分别与抗Zeb2、GFAP的兔一抗(1∶5 000)在4 ℃条件下孵育24 h。随后用PBS冲洗切片,分别并用二抗孵育(Zeb2∶绿色驴抗兔IgG绿色荧光团,1∶1 000;GFAP:红色驴抗兔IgG绿色荧光团,1∶1 000)室温下保存1 h。最后使用DAPI染色。所有切片在共聚焦纤维镜下观察。通过计算扫描软件对阳性荧光面积进行量化。
1.8 苏木精-伊红染色
将固定好的脊髓损伤节段,脱水后石蜡包埋脊髓,取5 μm厚连续纵切面。苏木精染色观察切片组织病理学变化。苏木精染色8 min, 1%酸性乙醇(1% HCl + 70%乙醇)染色5 min,蒸馏水冲洗。之后切片用伊红染色3 min,然后用酒精梯度脱水,二甲苯清除酒精。独立观察者使用倒置荧光显微镜收集图像。
1.9 统计学处理
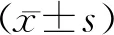
2 结果
2.1 靶向敲除Zeb2小鼠的运动恢复受损
通过对小鼠SCI术后1、3、7、14 d的运动功能进行BBB评分,结果SCI组BBB评分较sham组明显下降,差异有统计学意义(P<0.05)。而与SCI组相比,Zeb2cKO组在第14天的评分明显降低,差异有统计学意义(P=0.038 6),见表1。

表1 小鼠BBB运动功能评分
2.2 SCI诱导Zeb2表达
与sham组相比,SCI组 Zeb2表达水平明显增高。免疫印迹检测显示Zeb2表达水平明显高于sham组,差异具有统计学意义(P<0.05),见图1 A、B;定量PCR检测显示Zeb2基因表达水平明显高于sham组,差异具有统计学意义(P<0.05),见图1C;免疫荧光定量检测显示Zeb2表达水平明显高于sham组,差异具有统计学意义(P<0.05),见图1D、E及表2。与SCI组比较,敲除Zeb2基因明显降低Zeb2表达水平。免疫印迹检测显示Zeb2表达水平明显低于SCI组,差异具有统计学意义(P<0.05),见图1 A、B;定量PCR检测显示Zeb2基因表达水平明显低于SCI组,差异具有统计学意义(P<0.05),见图1C;免疫荧光定量检测显示Zeb2表达水平明显低于SCI组,差异具有统计学意义(P<0.05),见图1D、E及表2。
A:Zeb2及β-actin免疫印迹条带;B:Zeb2定量;C:Zeb2基因定量PCR结果;D:Zeb2免疫荧光图片,比例尺50 μm;E:Zeb2荧光定量分析。与sham组比较,*P<0.05;与SCI组比较,#P<0.05。

表2 各组Zeb2蛋白表达量
2.3 靶向敲除Zeb2减少SCI后星形胶质细胞增多
与sham组相比,SCI组 GFAP表达水平明显增高。免疫印迹检测显示GFAP表达水平明显高于sham组,差异具有统计学意义(P<0.05),见图2A、B;定量PCR检测显示GFAP基因表达水平明显高于sham组,差异具有统计学意义(P<0.05),见图2C;免疫荧光定量检测显示GFAP表达水平明显高于sham组,差异具有统计学意义(P<0.05),见图2D、E及表3。与SCI组比较,敲除GFAP基因明显降低GFAP表达水平。免疫印迹检测显示GFAP表达水平明显低于SCI组,差异具有统计学意义(P<0.05),见图2 A、B;定量PCR检测显示GFAP基因表达水平明显低于SCI组,差异具有统计学意义(P<0.05),见图2C;免疫荧光定量检测显示GFAP表达水平明显低于SCI组,差异具有统计学意义(P<0.05),见图2D、E及表3。

A:GFAP及β-actin免疫印迹条带;B:GFAP定量;C:GFAP基因定量PCR结果;D:GFAP免疫荧光图片,比例尺50 μm;E:GFAP荧光定量分析。与sham组比较,*P<0.05;与SCI组比较,#P<0.05。

表3 各组GFAP蛋白表达量
2.4 靶向敲除Zeb2改变EMT相关蛋白水平
免疫印迹检测结果显示,与sham组比较,SCI组E-cadherin表达水平明显降低,差异具有统计学意义(P<0.05),见图3A、B;与sham组相比,SCI组N-cadherin表达水平明显升高,差异具有统计学意义(P<0.05),见图3A、C;与SCI组相比, Zeb2cKO组E-cadherin表达水平明显升高,差异具有统计学意义(P<0.05),见图3A、B;与SCI组相比,Zeb2cKO组N-cadherin表达水平明显降低,差异具有统计学意义(P<0.05),见图3A、C及表4。
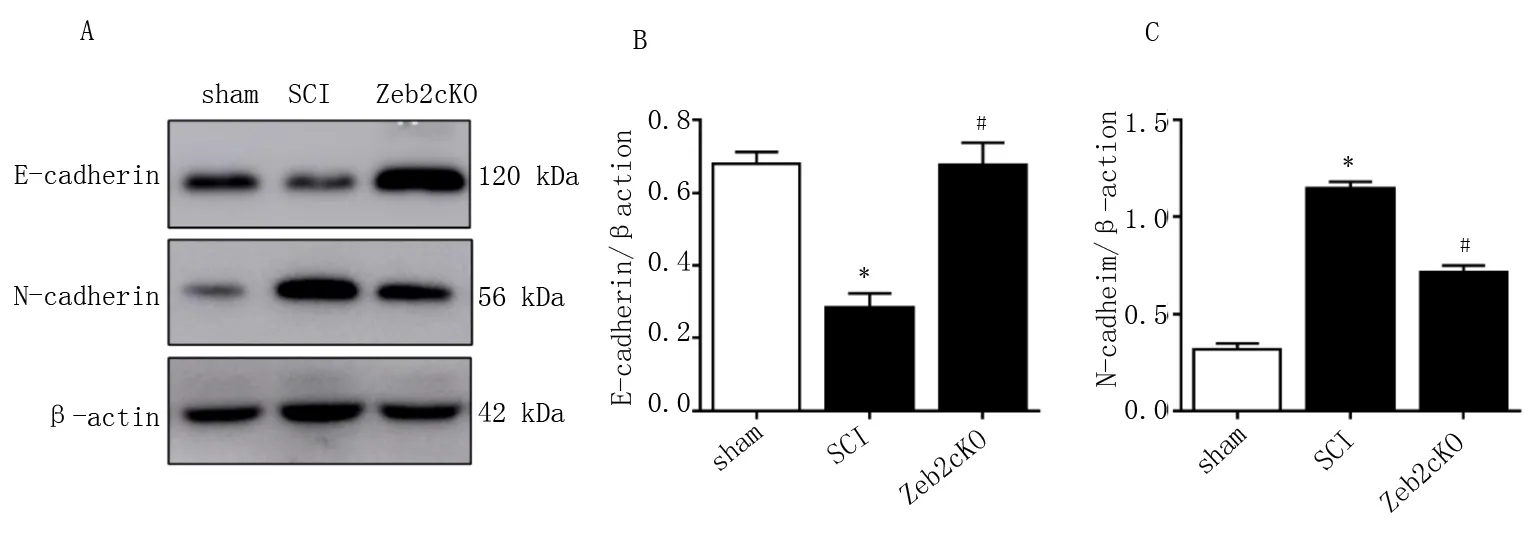
A:E-cadherin、N-cadherin及β-actin免疫印迹条带;B:E-cadherin定量;C:N-cadherin定量。与sham组比较,*P<0.01;与SCI组比较,#P<0.01。

表4 各组小鼠EMT相关蛋白及病理学定量
2.5 靶向敲除Zeb2加重脊髓组织病理学表现
实验14 d光镜下可见:SCI组在损伤灶周围有片状瘢痕区,部分组织空泡化,见图4A。而Zeb2基因敲除后Zeb2cKO组瘢痕区域面积增大,组织空泡化加重,见图4A。HE染色图像定量分析:与sham组相比,SCI组脊髓泡腔面积比明显增大,差异均具有统计学意义(P<0.05),与SCI组相比,Zeb2cKO组脊髓泡腔面积比明显增大,其差异具有统计学意义(P<0.05),见图4 A、B及表4。

A:各组小鼠脊髓苏木素伊红染色,放大倍数分别为1×,20×和40×;B:脊髓空泡面积定量。与sham组比较,*P<0.05;与SCI组比较,#P<0.05。
3 讨论
本研究提出Zeb2可能是脊髓损伤后星状胶质增生的重要调节剂。选择性敲除星形胶质细胞中Zeb2基因可减少星形胶质细胞增生,增加病变大小并损害运动功能的恢复。总之,这些发现表明Zeb2在星形细胞对损伤的反应中的关键作用是促进星形胶质细胞增生和保持神经功能。
由于星形胶质细胞中Zeb2的敲除还不完全,因此本研究可能低估了星形细胞Zeb2靶向缺失的全部效应。在先前的研究中,星形胶质细胞的基因改造通常使用组成性启动子(如GFAP)来驱动重组,因为靶基因的丢失不会明显地破坏神经发育[2,4],而Zeb2在神经系统中扮演了重要的角色[12,17,18],为防止神经系统发育中断小鼠无法正常生长,使用条件性他莫昔芬的驱动重组来敲除星形胶质细胞中的Zeb2。因为有研究表明在GFAP启动子控制下的Zeb2敲除,在出生后约2周出现严重的震颤和平衡控制方面的缺陷[19]。这种系统在损伤前接受他莫昔芬后不会使小鼠产生震颤或平衡缺陷,可以通过他莫昔芬给药而阻断星形胶质细胞中Zeb2的表达。
据报道在成年脊髓中,室管膜细胞是损伤后神经干细胞的来源,可产生多种细胞类型,包括星形胶质细胞[20,21]。但有报告说,室管膜细胞仅在严重损伤与室管膜层受损相关的情况下才产生星形胶质细胞,即使在这些情况下,对损伤后星形胶质细胞产生的贡献也很小[22]。未来需要使用谱系追踪研究来明确鉴定这些细胞的起源。
Zeb2在星形胶质细胞对损伤的反应中的调节作用增强了我们对其分子机制的理解,这些分子机制是星形胶质形成和其他组织伤口愈合之间共有的细胞过程的基础[5]。 Zeb2被鉴定为损伤后星形胶质细胞中EMT相关基因子集的一部分,该子集包括许多编码细胞表面、细胞黏附、细胞骨架以及细胞间和细胞内信号蛋白的基因,它们共同构成星形胶质细胞增生和伤口愈合中成分:细胞骨架重组、细胞连接修饰、组织重塑和沉积。总之,这些分子和细胞上的相似性强烈表明诱导星形胶质细胞增多是一种类似于EMT的过程。并且本研究发现在反应性星形胶质细胞增多的过程中上调了典型的EMT相关蛋白。
脊髓损伤后Zeb1/2的表达水平上调,但Zeb1在多种细胞类型中表达,包括星形胶质细胞、少突胶质细胞、神经元、小胶质巨噬细胞和内皮细胞,而Zeb2仅限于星形胶质细胞。这种差异表达表明Zeb2是星形胶质细胞特异性应答的一部分。尽管Zeb2 mRNA表达高,但未受伤的组织中Zeb2蛋白水平低,与癌细胞中其翻译调控一致[15],Zeb2 lncRNA的表达诱导Zeb2蛋白水平在损伤后增加。 Zeb2lncRNA被鉴定为是几种损伤后表达水平显著改变的星形胶质细胞lncRNA之一,这表明Zeb2lncRNA可能在指导星形细胞对损伤的反应中起关键作用。
反应性星形胶质细胞增多在神经系统损伤后恢复的急性和亚急性阶段的保护作用,以及在长期恢复中的作用,引起了人们对这些细胞靶向治疗以改善神经系统损伤的功能结局的兴趣[22,23]。确定合适的靶标并推进此类方法的开发,需要对分子调控途径有更全面地了解,从而指导对损伤的星形细胞反应。在这项研究中已经确定Zeb2是SCI后星形胶质增生的重要调节剂。且本研究证明靶向敲除Zeb2会影响病灶大小和运动功能的恢复。已知几个已被确定触发和维持星形胶质细胞增生的因素和分子途径[24],但几乎所有这些因子和通路都在损伤后的几种细胞中发挥作用。而Zeb2似乎是星形胶质细胞特异性因子,这为神经损伤选择性靶向反应性星形细胞以改善神经功能的恢复提供了分子基础。

