电针改善小鼠脓毒症后认知功能障碍作用及机制研究
李秀娟,肖亚平,周 钰
(新疆医科大学第一附属医院针灸推拿科,新疆 乌鲁木齐 830000)
研究显示,严重的创伤可引起一定程度的脓毒症,同时可并发多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS)和全身炎性反应综合征(Systemic inflammatory response syndrome,SIRS)[1]。在脓毒症后期,MODS以及SIRS常常可引发不同程度的弥散性脑损伤,即为ICU常见的一种脓毒症脑病(Sepsis associated encephalopathy,SAE)[2]。另外,其主要是一种弥散性脑功能障碍疾病,是由外周感染,而非明显中枢神经系统感染引发[3]。相关研究显示,脓毒症伴有脑功能障碍时的死亡率相对较高[4]。此外有70%左右的患者伴有不同程度的认知功能障碍,包括有记忆力、学习能力的降低以及注意力的改变等[5]。但目前临床上对于其发病机制尚未有权威性说明,且尚无相对有效的治疗方法。本研究通过探讨电针是否可以改变模型小鼠术后认知功能损伤,为针灸对脓毒症的临床治疗提供理论参考。
1 材料与方法
1.1 材 料 动物和饲料均由湖南紫光古汉制药股份有限公司提供,异氟烷和吸入麻醉机(武汉兴起点生物科技有限公司),小鼠白介素6(IL-6)、肿瘤坏死因子α(TNF-α)检测试剂盒购于北京热景生物技术有限公司;韩氏电针仪(M153934型)购于无锡市裕龙电子科技有限公司,多功能酶标仪(SpectraMax M3型;上海道尚生物科技有限公司),对小鼠的处理过程均符合2006年颁布的《关于善待实验动物的指导性意见》[6]。
1.2 模型制备 盲肠结扎穿孔术(CLP)法制备脓毒症小鼠,对小鼠进行腹部备皮消毒、2%异氟烷吸入性麻醉后,沿着腹部正中线位置,在其下腹部切2.5 cm切口,将盲肠暴露出来,并对其根部进行结扎处理,为形成肠瘘,采用16号针对小鼠盲肠进行3次的贯穿性穿刺,留置橡皮条引流,避免针孔的闭合,最后将盲肠复位到腹腔位置,逐层缝合。术后按照50 ml/kg的比例,进行0.9%氯化钠溶液皮下注射以避免小鼠休克,自由饮水[7]。
1.3 分 组 按照处理方式的不同将模型组随机分为脓毒症组(A组)、脓毒症+电针组(B组)、脓毒症+电针非经非穴组(C组)三组,各10只。其中B组术后给予双侧“足三里”穴位(腓骨小头、膝关节后外侧下约5 mm)7 mm针刺,之后连接电针仪进行30 min的持续性刺激,刺激强度为2~100 Hz,2~3 mA;C组采用相同的强度和频率对“非经非穴”(穴位外侧0.5 cm处)进行刺激,而A组不进行处理。另取10只同批次健康小鼠作为对照组(D组)。
1.4 观察项目及测定方法
1.4.1 血清神经元特异性烯醇化酶(NSE)浓度及炎症因子水平:术后6 h,2%异氟烷吸入性麻醉,开腹,腹部主动脉取血,置于普通血浆管中,离心处理后,取上清液,采用酶标仪,通过酶联免疫吸附法对血清NSE、IL-6、TNF-α值进行测定,试剂盒购于美国R&D公司,操作方法严格按照说明书执行。
1.4.2 海马组织中丙二醛 (MDA)、过氧化氢酶(CAT)及超氧化物歧化酶 (SOD)水平:术后取出各组小鼠海马组织,匀浆离心后,取上清液。采用可见分光光度计对海马组织中CAT、SOD的活性以及MDA质量浓度进行测定。试剂盒购于南京建成生物工程研究所,操作方法严格按照说明书执行。
1.4.3 海马组织脑源性神经营养因子(BDNF)水平:取海马组织上清液,蛋白浓度采用BCA法进行测定,加缓冲液进行5 min煮沸变性处理,SDS凝胶电泳,转至PVDF膜上,在采用5%的脱脂乳进行1 h的封闭处理,加入一抗,4 ℃条件下孵育过夜,洗膜,再加入二抗,室温条件下,进行1 h的孵育。最后显影采用电化学发光法进行,灰度值采用Image J软件进行分析处理,对海马BDNF含量进行测定。
1.4.4 行为学测试:小鼠建模完成后22 d,进行相应的旷场试验,将其放置于试验箱中,进行5 min的探索,对中央格停留时间和运动总距离进行记录。28 d时进行相应的条件恐惧实验,训练阶段将小鼠放入测试箱中进行3 min的探索,之后进行0.5 min的声音刺激,最后进行2 s的电刺激(0.75 mA),在对30 s时间的僵直行为进行记录。在训练后24 h后,进行真正的场景性恐惧测试,将小鼠置于训练试验箱中,进行3 min的僵直行为监测。2 h以后,进行相应的声音条件性测试,先适应3 min,之后给予相同声音刺激条件下,监测3 min的僵直行为,记录各组大鼠的条件性僵直时间和场景性僵直时间[8]。

2 结 果
2.1 各组小鼠术后血清TNF-α、IL-6和NSE水平变化比较 见表1。与D组相比,A组小鼠血清TNF-α、IL-6和NSE水平均升高(均P<0.05);B组小鼠上述指标明显均低于A组(均P<0.05);且C组和A组两组小鼠上述指标比较,差异均无统计学意义(均P>0.05)。

表1 各组小鼠术后血清TNF-α、IL-6和NSE水平变化比较
2.2 各组小鼠术后海马组织SOD、MDA和CAT水平变化比较 见表2。与D组相比,A组小鼠海马组织SOD、CAT水平均显著降低,海马组织MDA水平均升高(均P<0.05);与A组相比,B组小鼠上述指标均改善(均P<0.05);且C组和A组两组小鼠上述指标比较,差异均无统计学意义(均P>0.05)。

表2 各组小鼠术后海马组织SOD、MDA和CAT水平变化比较
2.3 各组小鼠术后海马组织BDNF相对含量比较 见表3。与D组相比,A组小鼠海马组织BDNF含量降低(P<0.05);B组小鼠海马组织BDNF含量明显高于A组(P<0.05);且C组和A组两组小鼠上述指标比较,差异无统计学意义(P>0.05)。
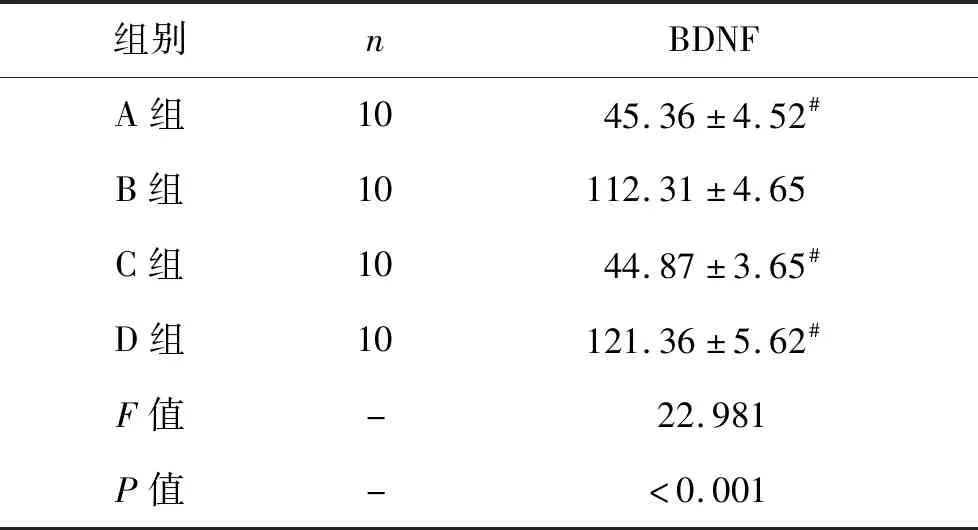
表3 各组小鼠术后海马组织BDNF相对含量比较(%)
2.4 各组小鼠术后行为学指标变化比较 见表4。与D组相比,A组小鼠运动总距离显著降低,中央格停留时间和场景性僵直时间升高(均P<0.05);与A组相比,B组小鼠上述指标改善(均P<0.05);且C组和A组两组小鼠上述指标比较,差异均无统计学意义(均P>0.05)。

表4 各组小鼠术后行为学指标变化比较
3 讨 论
目前临床上对于脓毒症尚无特殊治疗方法,出现相关并发症时,给予相应的对症处理[9]。相关研究显示,电针“足三里”治疗脓毒症患者,可以保护其肝肾、心脏以及肠道等外周器官,减轻其损伤[10]。而目前临床上对于针刺治疗脓毒症术后脑损伤影响的报道相对较少,故本文制备小鼠脓毒症模型,分析电针对脓毒症后认知功能障碍的影响。而相关研究显示,对于脓毒症患者,常常出现较为严重的炎性反应[11]。IL-6和TNF-α是脑损伤的重要炎性指标,其可传递外周炎性信号至大脑中,对脑部相应炎性细胞进行激活[12]。同时,IL-6和TNF-α还可影响脑血管细胞膜渗透性,破坏血脑屏障,脑部炎性反应进一步加剧[13]。而NSE是一种可以对脓毒性休克和脓毒症患者脑功能损伤进行有效反映的血浆标志物,其表达和释放与脑组织炎性反应关系密切,对患者认知功能障碍产生一定程度的影响[14]。文中炎性因子结果提示,电针“足三里”穴位,可以降低血清NSE水平,有效抑制脑组织炎性反应,减轻脑功能损伤。尽管本文研究显示,电针“足三里”可以有效的保护脓毒症小鼠脑组织,避免其发生损伤,但其内在作用机制尚不明确[15]。相关研究显示,电针“足三里”主要是通过兴奋胆碱能抗炎通路对脏器功能进行保护[16]。另外,也有研究显示,电针“足三里”可对迷走神经传出纤维放电和迷走中枢核团进行增强[17]。此外,电刺激迷走神经可以降低脑损伤后神经损伤、脑水肿以及血脑屏障通透性[18]。
大量研究显示,氧化应激反应也是脓毒症后脑功能损伤的重要因素。脓毒症产生的内毒素可诱导机体产生大量活性氧簇,增加脂质过氧化反应,降低机体抗氧化防御,致使机体抗氧化还原失衡[19]。中枢神经系统具有抗氧化防御弱、高代谢、高氧耗等特点,容易发生损伤,大量的活性氧簇可对细胞膜以及线粒体酶复合物进行损伤,从而致使ATP合成障碍以及细胞氧供不足,最终引发细胞损伤甚至坏死[20]。在脓毒症动物模型中,给予外源性抗氧化剂可有效减轻脑损伤,尤其是与记忆和学习相关的海马组织损伤[21]。CAT和SOD是一种内源性抗氧化酶,可以对机体清除活性氧能力进行有效反映。MDA可以反映活性氧破坏机体细胞的严重程度[22]。而文中氧化应激结果显示,电针“足三里”可以一定程度减少脓毒症小鼠氧化产物、提高氧化酶活性。提示电针“足三里”可以有效保护小鼠脑部与记忆和学习相关的海马组织,减轻脑部损伤。BDNF是保持突触可塑性、维持神经元存活的重要神经营养因子家族成员[23]。相关研究显示,伴有记忆力和学习力下降的脓毒症患者,其海马组织BDNF水平也呈现一定程度的降低[24]。而文中电针“足三里”可以一定程度增加BDNF的表达,提高小鼠认知功能和突触可塑性。文中小鼠行为学变化,提示电针“足三里”可以减少海马炎性因子和应激指标的释放,改善脓毒症小鼠的认知功能。
综上所述,电针“足三里”可以有效的降低脓毒症小鼠术后炎症因子、应激反应指标的释放量,减轻脑部损伤,改善其认知功能,对脓毒症的临床治疗具有一定的指导意义。

