微血管侵犯阳性肝癌病人肝切除肿瘤复发的危险因素分析
苏 展,杨为中,车金辉,周武元
肝癌是危害极大的消化系统恶性肿瘤,我国每年的肝癌新发病例约占全球新发病例的55%,死亡率约占全球的45%[1]。随着诊疗技术的提高,早期肝癌的检出率明显提高、死亡率明显下降,肝癌切除术后的1年生存率也从30%~40%上升至80%以上,但术后复发率仍处于较高水平[2]。临床研究[3]显示,肿瘤分化程度、肿瘤大小及边缘等均与肝癌切除术后复发有关。其中,微血管侵犯(microvascular invasion,MVI)主要表现为内皮细胞衬覆的血管腔内癌细胞巢团,邹国华等[4]认为其主要通过侵犯癌旁肝组织而引起复发,当肿瘤细胞沿血管迁徙,还可发生肝内或肝外转移。但肿瘤复发的因素较多[5],本研究对MVI阳性肝癌病人肝切除肿瘤复发的危险因素进行分析。现作报道。
1 对象与方法
1.1 研究对象 选择2016年12月至2018年12月我科收治的60例肝癌病人作为研究对象。其中男36例,女24例,年龄35~78岁。纳入标准:(1)经血清甲胎蛋白(AFP)、影像学、病理学等检查,均符合肝癌诊断标准[6];(2)均符合肝切除术标准,肿瘤局限于肝的1叶或半肝内,第1、2肝门下腔静脉未受侵犯,可保留30%以上的正常肝组织等。排除标准:(1)肝硬化面积超过肝组织的70%;(2)多发性肿瘤且范围超过半肝、已有远处转移或广泛种植;(3)有明显腹水、下肢水肿等;(3)有消化道出血、顽固性肝性脑病等全身情况不耐受肝切除术;(4)预计生存期<3个月;(5)临床资料不全或随访时间<12个月。
1.2 方法 病人均根据临床检查结果制定肝切除方案,采取免疫核糖核酸、干扰素、维生素K1等提高免疫力、凝血功能,术中视肿瘤范围、浸润深度及周围组织粘连情况等进行肿瘤切除,并将切除的组织及时送检,术后密切监测病人生命体征、对症进行抗感染和保肝治疗,并通过电话、门诊随访12个月。
本研究所有病例切除的组织均进行大体及镜下病理检查,根据手术病理结果将其分为MVI阳性组和MVI阴性组。MVI阳性标准[7]:显微镜下可见内皮细胞衬覆的血管腔内癌细胞巢团,且血管腔内出现悬浮癌细胞数目≥50个,癌细胞巢团主要出现在癌旁组织、门静脉小分支。
1.3 观察指标 (1)基本资料:性别、年龄、病理类型、肿瘤分化程度、手术切缘、肿瘤最大直径、肿瘤边缘、肿瘤包膜、解剖性肝切除、AFP、肝硬化、肝炎、肝功能Child-Pugh分级。(2)术后并发症。(3)随访12个月的复发率、死亡率。
1.4 统计学方法 采用χ2检验、秩和检验和多因素logistic回归分析。
2 结果
2.1 2组病人相关资料比较 根据手术病理结果,MVI阳性组20例,MVI阴性组40例。2组性别、年龄、病理类型、手术切缘、解剖性肝切除、肝硬化、肝炎、肝功能Child-Pugh分级差异均无统计学意义(P>0.05),2组肿瘤分化程度、肿瘤最大径、肿瘤边缘是否光滑、肿瘤包膜是否完整、AFP水平差异均有统计学意义(P<0.05~P<0.01)(见表1)。

表1 2组病人相关资料比较[n;百分率(%)]
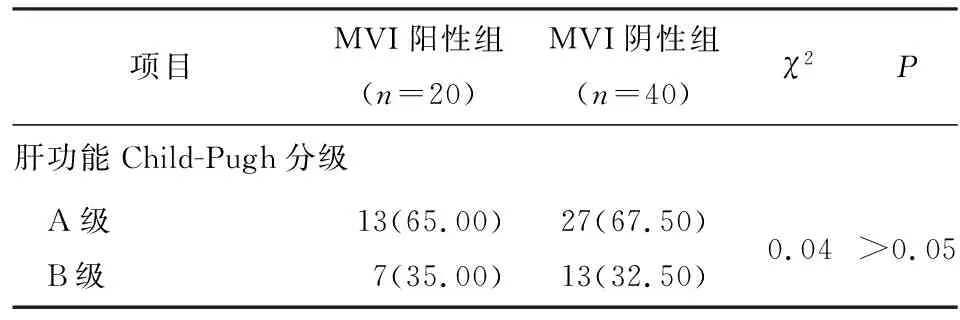
续表1
2.2 2组病人术后并发症比较 MVI阳性组病人术后并发症总发生率为20.00%,与MVI阴性组的7.50%比较差异无统计学意义(P>0.05)(见表2)。

表2 2组病人术后并发症比较[n;百分率(%)]
2.3 2组病人随访12个月的复发率、死亡率比较 随访12个月,MVI阳性组病人复发率25.00%(5/20),高于MVI阴性组的5.00%(2/40)(χ2=5.18,P<0.05);MVI阳性组病人死亡率10.00%(2/20),与MVI阴性组的5.00%(2/40)差异无统计学意义(χ2=0.54,P>0.05)。
2.4 MVI阳性肝癌的多因素logistic回归分析 经多因素logistic回归分析,肿瘤低分化、肿瘤最大径>5 cm、肿瘤边缘不光滑、无肿瘤包膜、AFP>400 μg/L均为MVI肝癌的独立危险因素(P<0.05~P<0.01)(见表3)。
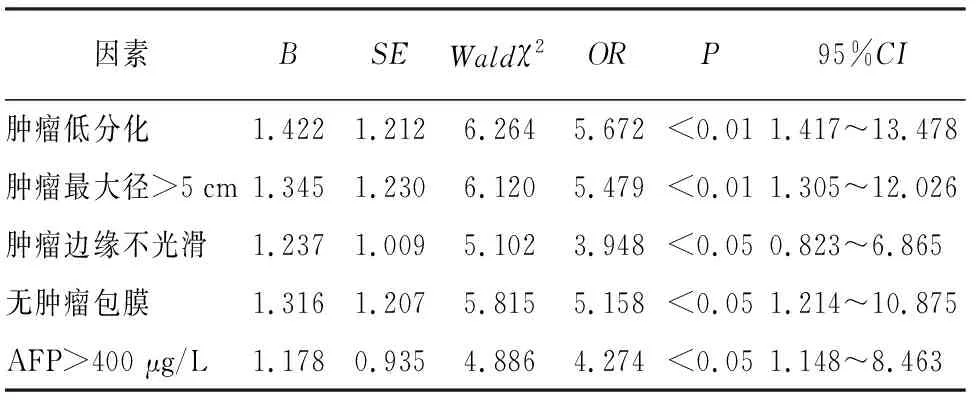
表3 MVI阳性肝癌的多因素logistic回归分析
3 讨论
手术是目前治疗肝癌的首选方式,一般认为无肝硬化肝癌,但可保留正常肝组织30%以上病人、有肝硬化肝癌,但可保留正常肝组织40%以上病人,均可通过手术获得较好的远期疗效[8]。但即使是适宜手术切除的肝癌,术后仍然会因MVI出现肝癌的复发与转移。如MVI发生在门静脉小分支时,可通过癌细胞的分裂增殖形成门静脉癌栓,进而在肝癌术后形成肝内转移灶,但MVI常难以在术前通过影像学检查或术中解剖时确认[9]。因此,笔者认为,对于术中无明显门静脉癌栓,但经手术病理结果证实存在MVI的病人,可给予术后门静脉化疗或预防性肝动脉化疗栓塞,以改善预后,减少复发。分化程度越低的肿瘤侵袭性越大,会引起原发性肝癌发生早期转移,从而导致肿瘤切除不彻底[10]。本研究中,MVI阳性组的肿瘤分化程度明显低于MVI阴性组,这提示分化程度越低,肝癌切除术后的疗效越差。刘驰等[11]认为,当肿瘤直径≥2 cm,低分化区会逐渐代替高分化区,促使肿瘤的恶性程度升高。其次,随着肿瘤的增大、浸润,肿瘤完整切除率和术后肝功能随之下降,且残肝易有微小灶,MVI的概率也相对更高[12]。
此外,我国85%左右的肝癌病人均合并有肝硬化、肝炎等慢性肝病,若手术性创伤过大不仅会导致肝功能衰竭、腹水等严重并发症,还会加速术后早期肿瘤复发[13]。如何在保证切除效果的同时,降低正常肝组织的切除量,还需结合影像学、分子技术对等进行研究。肿瘤越大,血供越丰富,边缘与正常肝组织的界限也越难区分清楚,易增加术中出血量;而肿瘤边缘不光滑者,肿瘤细胞的侵袭力相对较高,可逐渐促进肿瘤边缘正常肝组织的MVI[14]。有报道[15-16]称,在恶性肿瘤切除术中,有时会发现部分肿瘤有包膜,但大多不完整,这是因为恶性肿瘤多呈侵袭性生长,随着分化程度的降低或MVI的增多,可突破包膜,甚至破裂出血,引起坏死、感染等。但也有研究[17]认为,原发性肝癌本就会出现肿瘤周围纤维组织、受压小血管等组成的假性包膜,其形成受多种因素影响,且可通过影像学检查明确。所以,对于无肿瘤包膜或包膜完整的病人,还应结合其他检查,谨慎判断是否存在MVI阳性。AFP的升高,通常与肝细胞的死亡与再生有关,因此MVI及肿瘤浸润加快时,AFP常呈高水平[18]。
本研究中,2组病人的术后并发症发生率虽无明显差异,但MVI阳性组随访12个月的复发率高于MVI阴性组,提示MVI阳性对预测肝癌的复发有较高价值,而肿瘤低分化、肿瘤最大径>5 cm、肿瘤边缘不光滑、无肿瘤包膜、AFP>400 μg/L均为MVI阳性肝癌病人肝切除肿瘤复发的独立危险因素,临床可据此调整治疗方案。但本文并没有对病人不同时段的复发率、死亡率进行详细研究,且随访时间较短、研究病例较少,在今后的临床中还需扩大样本数量进一步研究。

