阿尔茨海默病伴抑郁患者外周血炎性因子、25羟维生素D水平的研究*
潘名志 徐晓文 任秀乾 杨勇 杜向东
阿尔茨海默病(AD)是常见老年病,它既不能有效预防也不能被治愈。患者除具有多重认知功能缺陷和社会功能减退等核心特征外,还会伴发某些精神性症状,抑郁是AD患者最常见的精神心理行为症状之一[1,2]。AD和抑郁症通常被视为两种不同的精神疾病,但两者都存在如认知功能缺陷、执行功能降低、躯体化症状等诸多共同特征。此外,在AD和抑郁症两种疾病患者中均存在某些大脑区域的变化,但健康人却无此变化[3]。这些发现提示:阿尔茨海默病和抑郁症的病因可能存在相似之处,诸如外周血液中促炎细胞因子水平升高及维生素D水平降低等危险因素[4,5]。鉴于此,本研究检测AD患者血清中炎性因子和25-OH-VD水平,旨在探讨其水平与认知功能缺陷及抑郁的相关性。
对象与方法
1 研究对象 选取苏州大学附属广济医院2016年1月~2019年6月住院治疗的AD患者46例。入组标准[6,7]:①符合美国国立老化研究所和阿尔茨海默病协会AD诊断标准;②简易智力状态检查量表(MMSE)评分<24分、临床痴呆评定量表评分(CDR)≥ 1、Hachinski缺血指数量表(HIS)评分<4分;③无内分泌疾病,入组前后未服用影响其代谢的药物;④根据临床表现和检查排除其他原因所致的痴呆患者。采用汉密顿抑郁量表(HAMD)对入组资料进行筛选,HAMD评分>17设为AD伴抑郁组,共20例;HAMD评分≤7设为AD无抑郁组,共26例。同时随机选取我院同期健康志愿者设为正常对照组,共24例。本研究经本院伦理委员会批准(苏广伦审2015-017号),患者及其监护人同意,并签署知情同意书。
2 研究方法
2.1 细胞因子的测定:以上患者均空腹于清晨采血3 mL,37 ℃水浴30 min后,以3000 r/min离心15min,将分离的血清立即转移到两个1 mL冻存管中,置于-70℃冰箱中储存供测定用。采用ELISA法测定白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α)的水平,试剂购自Boster Biological Technology公司。严格遵照说明书要求进行操作,以标准管浓度水平为横坐标,吸光度为纵坐标,建立标准曲线,根据各样本的吸光度值计算出各个因子浓度水平。
2.2 25-OH-VD的测定:试剂购自Abbott公司,采用ARCHITECT-iSR型化学发光分析仪进行测定,测定过程严格按照仪器标准操作规程执行。
3 统计学处理 数据应用IBM SPSS23.0软件进行分析,计量资料采用均数±标准差(±s)表示,计数资料组间比较采用χ2检验,三组间比较采用单因素方差分析,两两比较采用LSD-t法,两变量间相关性分析采用Pearson相关性分析,P<0.05表示差异有统计学意义。
结 果
1 三组受试对象一般资料比较 三组研究对象性别、年龄、受教育年限及体重指数均无显著性差异(P>0.05)。(P>0.05),MMSE评分各组之间差异具有显著性(P<0.05)。结果见表1。
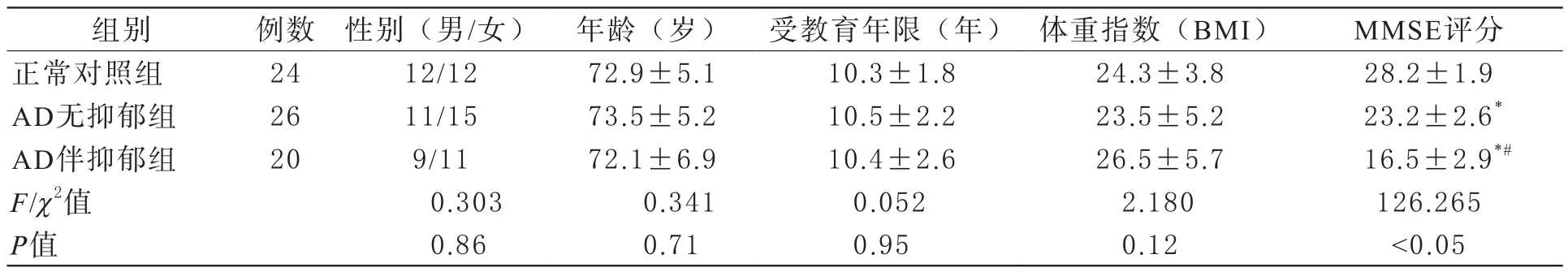
表1 三组受试对象一般资料比较
2 三组研究对象血清学指标比较 与正常对照组比较,AD伴抑郁组、AD无抑郁组IL-1β、IL-6、TNF-α水平明显增高,25-OH-VD水平明显降低,各组间差异显著(P<0.05)。与AD无抑郁组比较,AD伴抑郁组IL-6、TNF-α水平升高,25-OH-VD水平降低,两组间差异显著(P<0.05)。结果见表2。
表2 三组研究对象血清学指标比较(±s)

表2 三组研究对象血清学指标比较(±s)
注:与正常对照组比较,*P<0.05;与AD无抑郁组比较,#P<0.05
组别 IL-1β(pg/mL) IL-6(pg/mL) TNF-α(pg/mL) 25-OH-VD(nmol/L)正常对照组 11.7±3.4 7.7±2.6 64.1±23 44.7±9.9 AD无抑郁组 23.5±4.6* 11.5±3.6* 94.2±22* 34.7±8.3*AD伴抑郁组 25.2±5.4* 16.8±4.1*# 122.8±32*# 26.1±6.7*#F值 62.395 37.960 28.947 26.451 P值 <0.05 <0.05 <0.05 <0.05
3 MMSE评分与IL-1β、IL-6、TNF-α、25-OH-VD相关性分析 AD无抑郁组MMSE评分与IL-1β水平呈负相关(r=-0.433,P<0.05);与IL-6、TNF-α、25-OH-VD水平之间无显著相关性(r=-0.087、-0.219、0.205,P>0.05)。AD伴抑郁组MMSE评分与IL-β、IL-6、TNF-α水平呈负相关(r=-0.437、-0.371、-0.532,P<0.05),与25-OH-VD水平呈正相关(r=0.512,P<0.05)。结果见表3。
4 25-OH-VD浓度与IL-1β、IL-6、TNF-α相关性分析 AD无抑郁组25-OH-VD与IL-1β水平呈负相关(r=-0.418,P<0.05);与IL-6、TNF-α水平无显著相关性(r=-0.198;-0.202,P>0.05)。AD伴抑郁组25-OH-VD水平与IL-1β、IL-6、TNF-α水平均呈负相关(r=-0.452、-0.441、-0.471,P<0.05)。结果见表4。
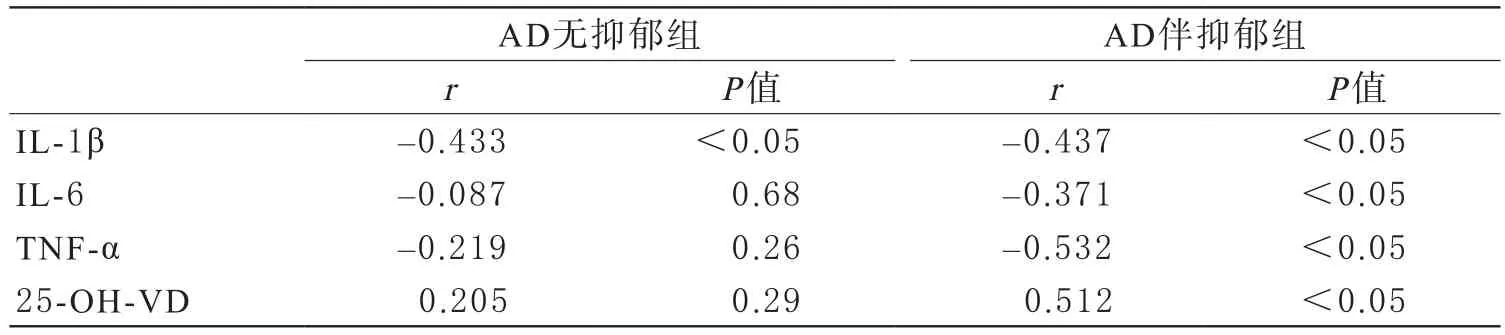
表3 MMSE评分与IL-1β、IL-6 、TNF-α、25-OH-VD相关性分析
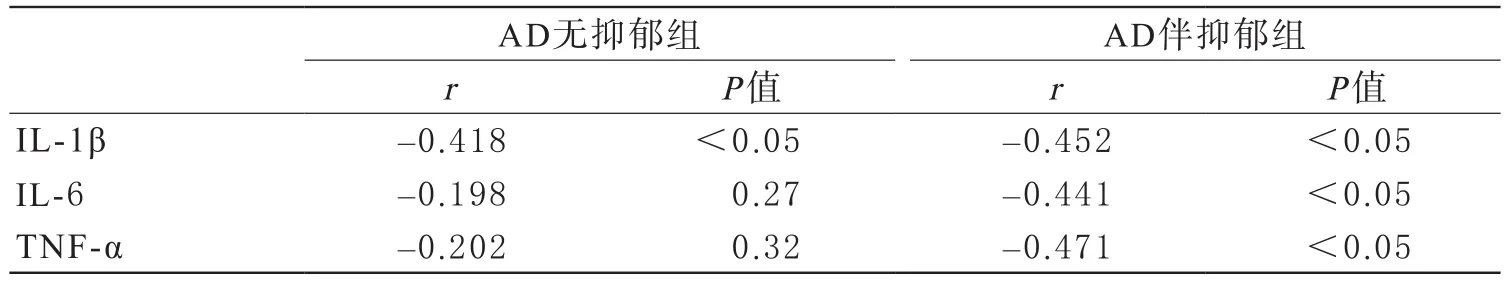
表4 25-OH-VD与IL-1β、IL-6 、TNF-α相关性分析
讨 论
大量研究提示痴呆与抑郁相关,炎症反应机制在其病理生理变化中起着关键作用,并与其他机制相互交织,参与疾病的发展。活化的小胶质细胞和星形胶质细胞引起的炎症反应是AD病理学的一个重要因素,这可从AD患者大脑的尸检分析和动物模型的研究中得到证实[8]。这种炎症反应可能是由可溶性淀粉样β肽或淀粉样纤维引起的,导致小胶质细胞的活性增加,产生干扰素、趋化因子、白介素、蛋白酶抑制剂和神经毒性产物,引起神经元损伤丢失和神经细胞凋亡,促进了神经退行性病变的发展进程[9,10]。RAPPMA研究发现:抑郁能加剧AD患者海马体中的炎症斑块形成和纤维缠结数量增加[11]。这表明抑郁会增加细胞中炎症因子的表达,导致抗炎反应和免疫抑制的减少。外周血中的炎症因子可以改变血-脑屏障的渗透性,促进炎症因子进入大脑,引起中枢神经系统促炎反应增加,而中枢神经系统细胞因子可引起突触特性、神经传递和下丘脑-垂体-肾上腺轴活性的改变,以及不同脑区的神经传递和β肽代谢变化[12],这些都可能导致AD和抑郁症的发生。此外促炎细胞因子水平增高可干扰5-羟色胺正常代谢,并且降低突触可塑性和海马神经再生功能,从而导致引起AD的β-淀粉样蛋白沉积,因此慢性炎症可能是抑郁促进AD发展的原因[13]。在本研究中,我们发现AD的IL-1β、IL-6、TNF-α水平明显高于正常对照组,考虑到外周血炎性因子过度表达对相关的情绪障碍和认知缺陷具有重要的影响[12],随即我们评估了AD患者的MMSE评分与血清IL-1β、IL-6、TNF-α之间的关系。结果显示:AD无抑郁组MMSE评分与IL-6、TNF-α水平无显著相关性;AD伴抑郁组MMSE评分与IL-6、TNF-α水平呈负相关,且AD伴抑郁组MMSE评分显著低于AD无抑郁组。这提示抑郁可能促进炎性因子的过度释放,从而导致AD患者认知功能缺陷。
维生素D(VD)是类固醇衍生物.可以通过1,25-(OH)2D3形式与VD受体的特定靶器官结合并发挥其生物学功能,具有神经保护、减少氧化应激损伤、促进β-淀粉样蛋白清除等作用[14]。VD参与人体新陈代谢,1-25(OH)2D3是最重要的循环方式,故临床上常以外周血1-25(OH)2D3的水平来评价患者VD的摄入、存储和转化情况。流行病学病例对照和基于大量人群的随访研究表明,人体低维生素D水平除了可能会影响神经可塑性、神经递质转换外,还可能会影响其他对情绪、行为、记忆和认知有明显影响的脑功能分子机制[15,16]。相关研究文献表明:血液中25-OH-VD低水平不但与认知能力下降和阿尔茨海默病密切相关[17],还与抑郁症有关[18]。本研究发现:AD伴抑郁组25-OH-VD水平最低,较正常对照组降低近50%,且与MMSE评分呈正相关,即AD患者25-OH-VD水平越低,认知功能缺陷就越严重。本研究还发现:AD伴抑郁组25-OH-VD水平与IL-6、TNF-α之间有密切的负相关性,而正常对照组和AD无抑郁组中则未发现这种相关性,这可能因为维生素D具有免疫调节活性,通过抑制p38-MAP激酶途径和VDR介导的相互作用和抑制NF-κB信号传导,进而抑制单核细胞和巨噬细胞中炎性因子的产生,如IL-6、TNF-α等[12,19]。因此,AD患者25-OH-VD水平的显著降低可能会导致患者体内的IL-6、TNF-α水平的升高。此外AD伴抑郁组患者25-OH-VD水平降低、炎性因子IL-6、TNF-α水平升高,与AD伴抑郁组患者认知MMSE评分降低有着密切的关联,提示临床上可尝试通过补充维生素D或用促炎细胞因子的特异性受体拮抗剂进行干预治疗。
综上所述,AD伴抑郁的患者外周血炎性细胞因子IL-6、TNF-α水平明显升高,25-OH-VD水平明显降低,MMSE评分与IL-1β、IL-6、TNF-α水平呈负相关,与25-OH-VD水平呈正相关。这与AD患者的认知有着紧密的联系。因此,外周血炎性因子和25-OHVD水平在AD伴抑郁患者临床诊疗中有着重要的意义,可能为今后AD的诊断和治疗带来新的思路。
利益冲突 所有作者均声明不存在利益冲突

