身体形态指数与新诊2型糖尿病合并非酒精性脂肪肝的关系
叶菁菁,秦瑜,赵丽,杨玲
(江苏大学附属医院 内分泌代谢科,江苏 镇江 212000)
随着肝炎疫苗的普及,不良饮食和生活习惯的形成,非酒精性脂肪肝(NAFLD)已成为我国慢性肝病首要病因。NAFLD可对肝组织造成有害影响;30%~70%的隐源性肝硬化可归因于NAFLD和非酒精性脂肪性肝炎(NASH)[1]。同时,NAFLD相关的肝细胞癌的患病率正在增加[2]。目前我国范围内普通人群中NAFLD发病率为20%~33%,而2型糖尿病(T2DM)患者的NAFLD发病率高达70%[3]。提示T2DM可能是非酒精性脂肪肝危险因素之一。而肥胖与糖尿病及NAFLD均存在密切联系,其潜在机制包括胰岛素抵抗、微炎症反应等[4]。
身体形态指数(ABSI),由Krakauer于2012年开发的一种新的人体测量参数,已经被开发出来用于评估肥胖,并且比体重指数(BMI)更能反映腹部肥胖[5]。有研究发现在普通人群中,ABSI与非酒精性脂肪肝存在相关性,然而,目前还不确定ABSI是否与糖尿病患者的NAFLD有关。鉴于此,本研究旨在探讨新诊T2DM患者中ABSI与NAFLD的关系。
1 资料与方法
1.1研究对象 回顾性分析2012年01月-2014年08月江苏大学附属内分泌科住院且数据完整的新诊T2DM患者107例,均符合世界卫生组织(WHO)1999年制定的关于T2DM的诊断标准,同时未接受过任何降糖药物治疗;由经验丰富的超声科医生对所有研究对象行腹部彩色超声检查;NAFLD诊断符合《非酒精性脂肪性肝病防治指南》中的腹部超声诊断标准。排除标准:妊娠及哺乳期妇女;长时间大量饮酒者(男性近1年每周饮用乙醇量>210 g、女性近1年每周饮用乙醇量>140 g);可导致脂肪肝的特定疾病;近3个月内使用过影响肝功能、血脂的药物;1型糖尿病及其他类型糖尿病、糖尿病急性并发症;恶性肿瘤、严重感染、血液病、严重肝肾功能不全及其他内分泌疾病如甲状腺功能减退等;缺失与研究相关重要资料者。根据检测结果将研究对象分为单纯T2DM(T2DM组)50例、T2DM合并NAFLD(试验组)57例。同时选取体检中心体检的健康人群(对照组)48例。
1.2研究方法
1.2.1一般资料 采集病史:记录研究对象性别、年龄、既往史和饮酒情况;研究对象着轻薄衣物,由专人培训后进行测量静息状态血压、体重、身高、颈围、腰围(WC)、HC,计算腰臀比(Waist hip rate, WHR)、腰高比(waist height rate, WHtR)、BMI=体质量(kg)/身高2(m2)、ABSI = 腰围(m)/[身高(m)1/2× 体重指数(kg/m2)2/3]。
1.2.2临床标本的收集 所有研究对象晚餐后禁食、禁水8~10 h,次日行糖耐量试验(oral glucose tolerance test,OGTT)及胰岛素释放试验。采肘静脉血,全自动生化分析仪(美国贝克曼AU5821)测定空腹血糖(FPG)、餐后2小时血糖(2 hPG)、总胆固醇(TC)、三酰甘油(TG)等相关指标。空腹胰岛素(FINS)采用放射免疫法测定,计算HOMA-IR=FPG×FINS/22.5。
1.2.3影像学检查 所有患者均空腹接受腹部超声检查, 由经验丰富的超声专科医师严格按照仪器使用手册进行操作。患者取仰卧位,双手抱头,探头与皮肤表面垂直,选择肝左右叶为检测区域,超声仪采用美国GE公司logicE10彩色超声诊断仪。
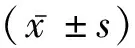
2 结 果
2.1研究对象基线特征 155例研究对象年龄20~81岁,平均(51.2±13.7)岁。试验组FINS、HOMA-IR、LDL-C、TG、TC、尿酸、白细胞、NLR均高于对照组及T2DM组,HDL-C明显低于其余两组,差异有统计学意义(P<0.05或P<0.01)。与对照组相比, 试验组及T2DM组FPG及2 hPG明显升高,差异有统计学意义(P<0.05),见表1。
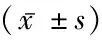
表1 3组临床资料比较
2.2各组人体成分指标水平比较 试验组ABSI、腰围、WHR、BMI、WHtR均较其余两组升高,差异有统计学意义(P<0.05),见表2。
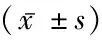
表2 3组体成分的比较
2.3ABSI水平三分位分组后各临床指标比较 根据ABSI水平将研究对象按三分位分组,随着ABSI水平升高,FPG、2 hPG、LDL-C、TG、TC、HOMA-IR及 NLR显著升高(P<0.05或P<0.01),HDL-C水平显著降低(P<0.01),见表3。
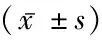
表3 ABSI三分位数区间各临床指标的比较
2.4ABSI与各临床指标的相关性 为进一步探讨ABSI与各代谢指标之间的关系,首先进行了两变量之间的 Pearson相关性分析。结果显示,ABSI与FPG、2 hPG、HOMA-IR、TG、TC、LDL-C、NLR呈正相关,相关系数分别为分别为(r=0.49,P<0.01)、(r=0.52,P<0.01)、(r=0.23,P<0.01)、(r=0.22,P<0.01)、(r=0.25,P<0.01)、(r=0.18,P<0.05)、(r=0.32,P<0.01), 与HDL-C呈显著负相关, 相关系数为(r=-0.20,P<0.05),与FINS、尿酸无显著相关性。
2.5Logistic回归分析新诊T2DM患者合并 NAFLD的相关人体成分指标 以是否发生NAFLD为因变量,以 WC、WHtR、WHR、BMI、ABSI为自变量,行二元logistic 回归分析,结果显示ABSI、WC、WHtR是新诊T2DM合并 NAFLD的危险因素。
2.6T2DM合并NAFLD的ROC曲线分析 T2DM合并NAFLD患者的WC、WHtR、WHR、BMI、ABSI进行ROC曲线分析,结果ABSI的AUC为0.78, 敏感度96.5%,特异度59.2%;BMI的AUC为0.54,敏感度63.2%,特异度53.1%;WHtR的AUC为0.772,敏感度71.9%,特异度71.4%;WHR的AUC为0.61,敏感度82.5%,特异度46.9%;WC的AUC为0.626,敏感度82.5%,特异度44.9%。AUC 越大诊断价值越高,其中 ABSI的AUC最大(0.78),诊断力最强,见图1。
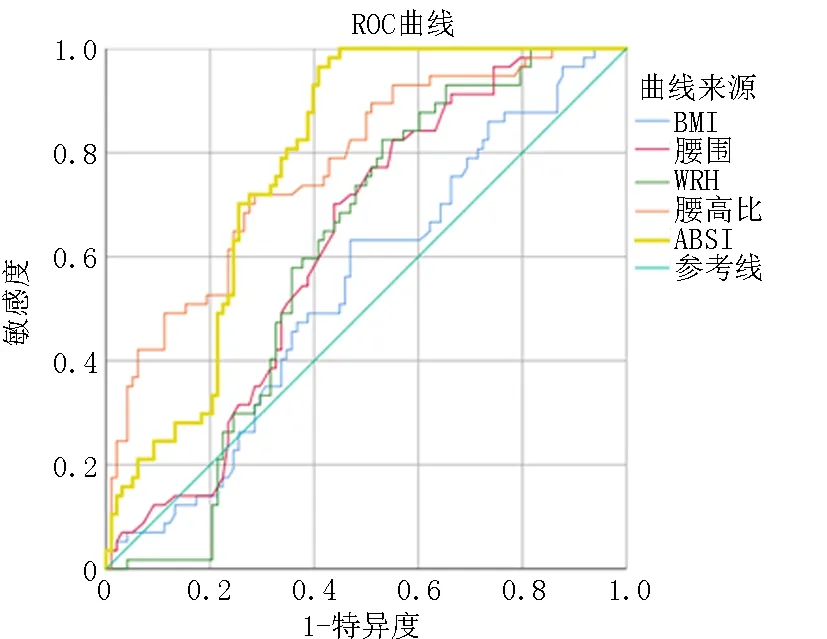
图1 不同人体测量指标诊断脂肪肝的曲线下面积
3 讨 论
NAFLD包括NASH、肝纤维化、肝硬化,晚期可能导致肝衰竭等,严重时可致死亡,其特征是在没有过量饮酒并排除其他可能导致肝脏脂肪变性疾病的情况下,TG在肝细胞内过度蓄积(肝脂肪变性)[6]。据估计,NAFLD在未来20年内可能成为肝移植的主要原因,严重危害人类健康,并且使医疗保健系统成本不断增加[7]。临床数据显示,T2DM人群NAFLD的患病率大约是一般人群的3倍,提示T2DM可能是NAFLD危险因素之一[8]。同时,T2DM还可能会增加NAFLD发展为肝硬化、肝癌等终末期肝病的风险。并且NAFLD本身也是T2DM及其并发症的危险因素, 可促进糖尿病并发症自然病程的恶化[9]。因此,T2DM合并NAFLD的早期筛查和干预具有重要意义,应该受到广泛关注和重视。
糖尿病并发NAFLD的影响因素较多,具体发病机制尚不完善明确。本研究发现,试验组 FINS、HOMA-IR、LDL-C、TG、TC、尿酸、白细胞、NLR水平均显著高于T2DM组及对照组,HDL-C 水平明显降低,提示NAFLD与脂代谢紊乱及胰岛素抵抗、全身微炎症状态等密切相关。上述结果与目前国内外研究发现一致。Cruz等[10]研究发现胰岛素抵抗和相关的高胰岛素血症与NAFLD发病风险呈正相关,且胰岛素抵抗能预测NAFLD的发生。刘婷等[11]研究发现,血清尿酸水平与NAFLD密切相关,血尿酸水平升高可诱导产生活性氧相关炎性细胞因子,从而进一步激活肝内细胞启动纤维化,是促进T2DM 合并NAFLD 患者肝纤维化发生发展的独立危险因素之一。
众所周知,肥胖是T2DM及NAFLD共同的病理生理基础,本研究发现T2DM合并NAFLD组肥胖评价指标如WC、WHtR、WHR、BMI均较其余两组升高。肥胖包括皮下脂肪的增多和内脏脂肪的堆积,其中内脏脂肪堆积与NAFLD关系更为密切[12]。内脏脂肪增加可显著增加胰岛素抵抗和高脂血症的风险,继而引起炎症反应,诱导肝脏脂肪变性。一项为期4年随访的前瞻性研究发现内脏脂肪含量是NAFLD独立危险因素,内脏脂肪水平越高,NAFLD的发生率越高[13]。ABSI是近年来新提出的一种人体成分指标,可用于评估内脏、腹部及全身肥胖情况,其独特之处在于ABSI与内脏脂肪呈正相关,并被认为与BMI无关[14]。Motamed等[15]研究表明,在一般人群中ABSI与NAFLD之间存在显著关联性,且不受年龄,血脂异常和胰岛素抵抗等其他潜在介质的影响。Zhao等[16]针对来自参加NAGALA研究的15 462名18~79岁的日本成年人的数据研究发现,脂肪肝患者中ABSI越高,发生糖尿病发的风险越大。国外有研究发现,ABSI与T2DM发生风险的增加呈线性相关,ABSI对糖尿病的预测能力明显高于腰围,同时独立于BMI影响[17]。但目前尚无研究探索在新诊断T2DM人群中ABSI与NAFLD的关系。
本研究发现,试验组ABSI水平均显著高于T2DM组及对照组,ABSI水平升高是 T2DM 合并 NAFLD 的危险因素。为进一步分析,ABSI与T2DM 合并 NAFLD的关系,据ABSI三分位数将研究对象分为Q1~Q3组,观察不同ABSI水平NAFLD相关代谢指标的变化。结果发现随着ABSI水平增高,FPG、2 hPG、、HOMA-IR、TG、TC、LDL-C、NLR显著升高,且呈正相关。其中HOMA-IR是目前常用判断胰岛素抵抗的指标,国内外许多研究证实胰岛素抵抗是 NAFLD及T2DM发生发展的中心环节[18]。它降低胰岛素抑制脂肪酶的活性,促进外周组织的脂肪分解,增加血液中游离脂肪酸及TG水平,导致肝脏内游离脂肪酸呈超负荷状态,最终形成肝细胞内TG堆积。在肝内脂质堆积的基础上,又会进一步导致肝内炎症反应,促进NAFLD病情发展[19]。而NLR为反映机体整体的炎症状态指标,NLR值越高,机体炎症反应越重,有研究显示NLR可作为T2DM合并NAFLD的预测指标[20]。
为评估不同人体成分指标对 NAFLD的预测能力,本研究构建了ROC 曲线,本研究发现ABSI对 T2DM 合并 NAFLD 的诊断价值高于 BMI、WHtR、WHR、WC;这可能与上述人体成分指标评估肥胖能力的差异有关。BMI是反映肥胖的常用指标,但不能区分内脏肥胖和整体肥胖[21]。腰围被广泛用于反映腹型肥胖,WHR和WHtR反映中心性肥胖,但易受测量方法、呼吸等因素影响。而ABSI则全面考虑了体重、腹部脂肪和身高等因素,属于综合性指标,结果相对稳定[22]。
综上所述,T2DM合并NAFLD患者ABSI显著增加,且与胰岛素抵抗、NLR密切相关。ABSI其检测方法简便、低成本、非侵入性和易获取等优点,故适合大规模筛查,可以把ABSI 作为预测 T2DM 合并 NAFLD风险的有效指标之一,为早发现NAFLD 提供一定的依据。本研究也具有一定的局限性,首先该研究为一项单中心研究,纳入病例数量一般。其次,本研究缺少机制研究。

