NLR、PLR、CEA在晚期非小细胞肺癌预后中的价值
鲍欣然,哈敏文
(锦州医科大学附属第一医院 胸部肿瘤一病区, 辽宁 锦州 121000)
肺癌作为目前在全世界范围内癌症发病率排名首位的恶性肿瘤,严重威胁着人类的健康,其中非小细胞肺癌(NSCLC)所占的比例约为85%[1]。有证据表明,炎症是肿瘤微环境的重要组成成分之一,全身性炎症通过促进肿瘤细胞的增殖及肿瘤血管的生成从而起到抑制宿主的抗肿瘤免疫反应的作用[2]。有研究证实机体内的炎症反应和多种癌症的预后相关,在诸多炎症指标中,中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)被证实与恶性肿瘤有明显的相关性,可为预后提供重要的信息[3]。大多数恶性肿瘤在生长、转移过程中伴随着NLR的改变,NLR可以预测肺癌患者的预后[4]。有研究指出,外周血PLR在NSCLC患者的术后辅助化疗的疗效评估中有重要的意义[5]。多项研究表明NLR、PLR与胃癌[6], 食管癌[7],肝细胞癌[8]等多种肿瘤的发生及预后相关。癌胚抗原(CEA)作为一种广谱的肿瘤标记物存在于多种癌症中,在结肠癌、胃癌中有预测肿瘤复发和存活率的价值[9-10]。在临床上,这些指标价格低廉、易于获取且可重复测试,本文旨在探讨检测NLR、PLR、CEA水平对晚期NSCLC预后的评估价值。
1 资料与方法
1.1病例选择 2016年1月至2020年1月在锦州医科大学附属第一医院住院的晚期NSCLC患者135例,其中男81例,女54例,平均年龄为(59.2±8.6)岁;按病理类型分组:鳞癌56例,腺癌79例。按有无吸烟史分组,曾经及现在吸烟者72例,不吸烟者63例;按ECOG评分分组:0~1分:95例,≥2分:40例。入组标准:①所有患者均通过组织学病理确诊为NSCLC且分期为Ⅲ~Ⅳ期;②从未接受过任何抗肿瘤治疗;③具有完善的锦州医科大学附属第一医院检验科的血常规检测报告可用于NLR、PLR评价;④ PS评分在2分以下;⑤生存时间超过3个月。排除标准:①同时合并两种或两种以上恶性肿瘤;②组织学病理为SCLC;③患有肺栓塞、急性心肌梗死、脑血栓和慢性炎症的病史;④临床资料不完整者;⑤使用可能影响白细胞和血小板的药物或输血。本课题通过锦州医科大学附属第一医院伦理委员会批准。
1.2研究方法 所有血液标本均为患者初次入院次日清晨采集空腹静脉血,无溶血、脂血等现象,统一使用血细胞分析仪及其配套设施检测血细胞相关参数。再通过锦州医科大学附属第一医院电子病例系统收集患者年龄、性别、家族史、吸烟史、病理类型、TNM分期、ECOG评分、初诊为NSCLC时淋巴细胞计数、血小板计数、中性粒细胞计数及癌胚抗原等相关临床资料。计算出患者初次治疗前NLR和PLR数值,NLR:外周血中性粒细胞计数与淋巴细胞计数的比值,PLR:外周血血小板计数与淋巴细胞计数的比值。本研究中的分期是根据美国癌症联合委员会和国际抗癌联盟制定的第八版肺癌分期指南行TNM分期。
1.3观察指标 从初次治疗开始作为观察起点,所有入组患者的随访截止日期是2020年1月31日,每半年随访1 次,通过门诊、电话、短信等方式随访患者的生存状态。4年的总生存时间(OS)是本研究中确定的终点,定义为自首次治疗开始的时间至死亡或截止日期的时间。
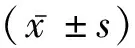
2 结 果
2.1不同NLR、PLR、CEA组临床资料比较 高低NLR组病理类型、吸烟史比较差异有统计学意义(P<0.05),性别、年龄、ECOG评分方面比较均无统计学意义(P>0.05)。高低PLR组病理类型比较差异有统计学意义(P<0.05),其余均无统计学意义(P>0.05)。高低CEA组病理类型、吸烟史比较差异有统计学意义(P<0.05),其余均无统计学意义(P>0.05)。见表1~3。
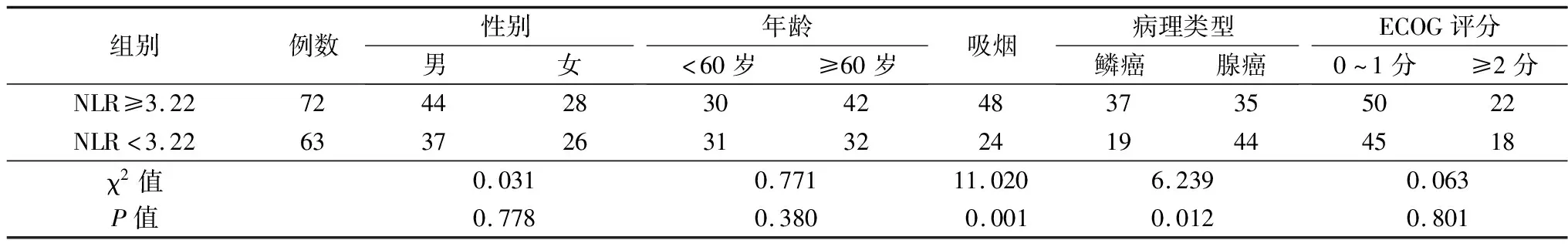
表1 高低NLR组临床资料比较(例)
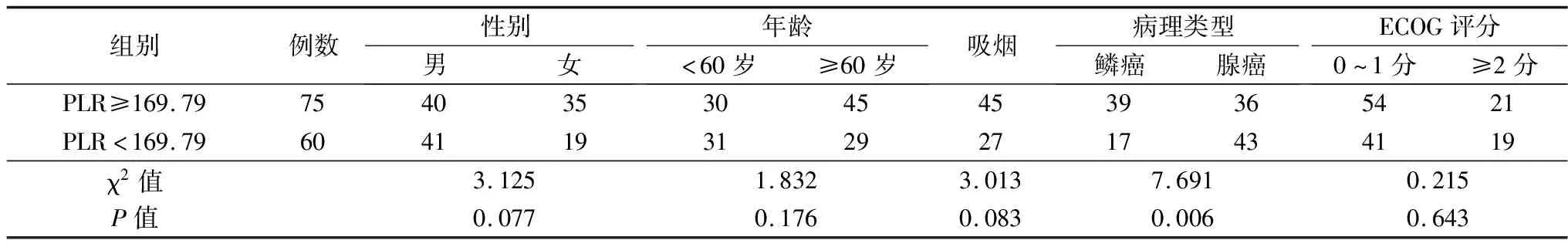
表2 高低PLR组临床资料比较(例)
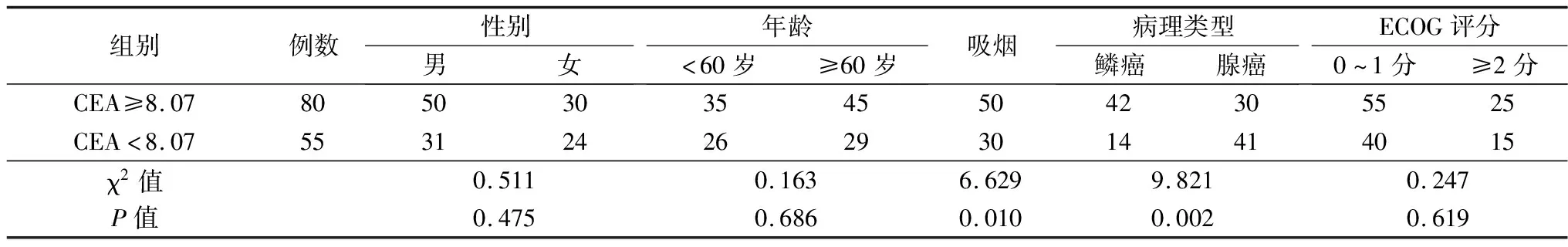
表3 高低CEA组临床资料比较(例)
2.2NLR、PLR、CEA与晚期NSCLC患者生存时间的关系 在所有入组的晚期NSCLC患者中,低NLR组中位OS为22.8个月,高NLR组中位OS为16个月,低NLR组中位OS明显高于高NLR组(χ2=10.05,P<0.01)。低PLR组中位OS为21.5个月,高PLR组中位OS为15.2个月,低PLR组中位OS明显高于高PLR组(χ2=6.128,P=0.013)。低CEA组中位OS为23.2个月,高CEA组中位OS为15个月,低CEA组中位OS明显高于高CEA组(χ2=12.18,P<0.01)。见图1~3。
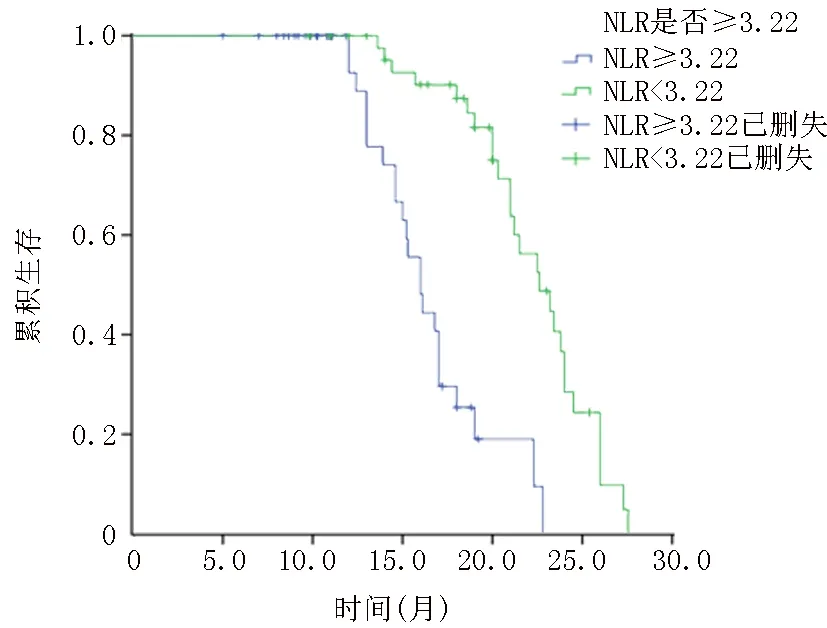
图1 高低NLR组生存关系曲线
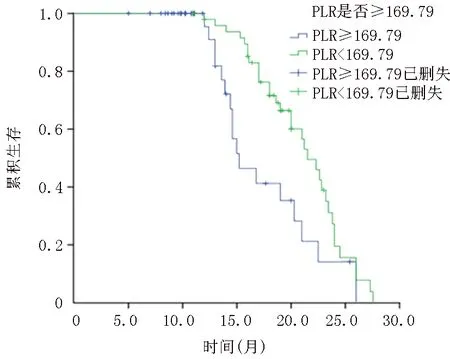
图2 高低PLR组生存关系曲线
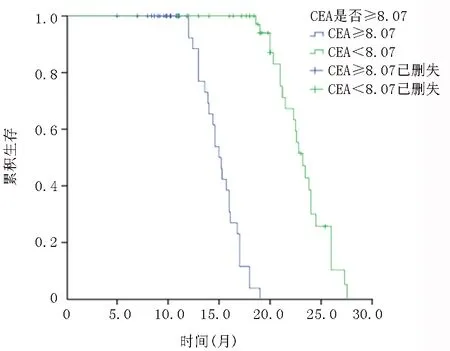
图3 高低CEA组生存关系曲线
2.3NLR、PLR、CEA对晚期NSCLC预后的评估价值 NLR、PLR、CEA指标的ROC曲线下面积(AUC)最大的是NLR,为0.761;与PLR、CEA的AUC比较差异有统计学意义(P<0.05),NLR在晚期NSCLC患者中预后的预测效能最好。见表4、图4。

表4 NLR、PLR、CEA预测NSCLC患者预后的价值
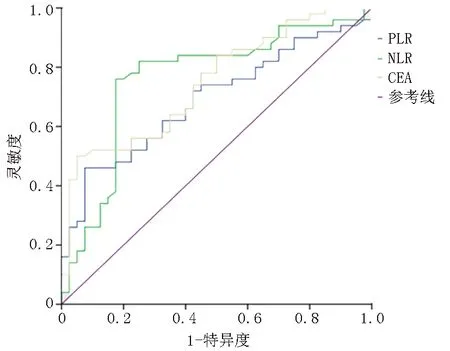
图4 NLR、PLR、CEA单独预测NSCLC预后的ROC曲线
3 讨 论
目前肺癌仍是全球发病率及死亡率最高的恶性肿瘤,而其中NSCLC所占的比例约为85%,随着人们对NSCLC研究的不断深入,包括多种癌症相关驱动基因的识别、新药的层出不穷、多学科综合诊疗的合理应用, 使NSCLC的预后得到了显著改善, 但是NSCLC患者的5年生存率仍不乐观, 仅为18%[1]。
炎症与癌症的关系最早是由Virchow于1863年提出,目前炎症在各种恶性肿瘤的发生、发展中所发挥的重要作用已被广泛接受[11]。炎症反应是机体免疫系统的应激性反应,在肿瘤发生发展中起到了关键作用[12]。恶性肿瘤的全身性炎症被认为是由于肿瘤细胞的缺氧或肿瘤细胞的坏死及其相关的抗凋亡信号通路激活而引起的反应[13]。当恶性肿瘤发生时,机体自身会释放一定数量的炎症介质及趋化因子,在这种微环境下更适宜肿瘤细胞生长、繁殖,同时会减少机体自身的免疫反应,从而起到促进恶性肿瘤发生及发展的作用[14]。国内外学者一直在探寻与NSCLC预后相关的全身性炎症的生物标记物。人血中的NLR及PLR可作为评估患者的炎症非特异性指标,且作为血液学评价方法既方便又经济。包括中性粒细胞,肿瘤坏死因子,淋巴细胞,白细胞介素、血小板以及C反应蛋白(CRP)等其他因素与多种癌症的预后有关,中性粒细胞和血小板在体内可促进肿瘤进展并抑制抗肿瘤免疫力[15]。当机体发生慢性炎症后,中性粒细胞可以从外周循环系统聚集到肿瘤组织[16]。从而激活了炎症细胞和肿瘤细胞的转录因子,例如信号转导核因子-κ-基因结合(NF-κB)及转录激活因子3(STAT3),进一步促进了趋化因子和细胞因子等炎症介质的产生。中性粒细胞还可以通过释放大量的活性氧(ROS)来引起细胞的DNA损伤和遗传的不稳定性,进而导致癌症的发生[17]。血小板也是外周血的主要成分之一,一方面通过分泌炎性介质和生长因子,例如血管内皮生长因子(VEGF)等,来刺激肿瘤血管的生成[18]。另一方面血液中释放的血小板反应蛋白会增加肿瘤细胞的黏附,从而导致血液高凝状态,当肿瘤与机体相互作用的时候,会出现反应性血小板增多的现象[19]。血小板增多症是副癌综合征,被广泛接受为癌症患者的不良预后因素。而淋巴细胞,尤其是T淋巴细胞则在宿主的抗肿瘤免疫中发挥着重要作用, 可以通过激发抗肿瘤免疫活性来抑制恶性肿瘤的进展,并且治疗相关的淋巴细胞减少与癌症的预后不良相关[20]。然而,该领域的主要挑战之一是仍然缺乏对全身性炎症指标的共识。因此, 外周血NLR和PLR的失衡为肿瘤患者预后提供了新的视角。
本研究显示NLR与晚期NSCLC患者的病理类型、吸烟史有关;而PLR与晚期NSCLC患者的病理类型有关;CEA与晚期NSCLC患者的病理类型、吸烟史有关。
本研究发现低NLR组中位OS明显高于高NLR组。低PLR组中位OS明显高于高PLR组。低CEA组中位OS明显高于高CEA组。NLR在晚期NSCLC患者的预后中预测价值最大。国内研究报道,NLR、PLR可预测三阴性乳腺癌、肺癌、结肠癌患者的预后,上述报道的结果与本研究结果相一致[21-23]。有研究证实晚期NSCLC中低PLR的患者对一线化疗的有效率以及疾病控制率均明显高于高PLR的患者[24]。国外研究发现,通过检测化疗前外周血PLR水平在预测卵巢癌患者的一线化疗的疗效中起重要作用[25]。有研究证实大多数肿瘤可能起源于持续感染或慢性炎症发生的部位,这些部位含有大量的白细胞和刺激肿瘤细胞增殖、迁移,细胞外基质重塑和新血管形成的因子。在多种炎症因子的相互作用下刺激机体发生相应的应激反应, 进而导致炎症细胞过度聚集, 最终引起细胞发生氧化损伤等有害的生物学效应, 从而影响了机体内正常的微环境, 使人体内的正常细胞癌变为肿瘤细胞, 并且能加速肿瘤细胞的生长、侵袭及转移,对患者的预后有着重要的意义[26]。为NSCLC的预后找到了更简单、便捷且重复性高的监测指标。
本研究显示NLR、PLR、CEA均可作为预测晚期NSCLC预后的理想指标, 其中NLR的预测效能最佳。尚有很多问题亟待解决,例如:①纳入样本量较少,②通过干预NLR、PLR、CEA能否改善患者总生存率,③外周血NLR、PLR的临界值在国际上仍未有统一的共识,故我们选取的临界值可能有一定误差。需要大样本量的前瞻性研究来进一步解决以上问题。

