血清免疫球蛋白及补体C3、C4水平与高血压性脑出血患者预后的关系
吴 亮, 刘 明
(宁德师范学院附属宁德市医院 神经外科,福建 宁德 352100)
高血压是我国重要的公共卫生问题之一。流行学数据显示[1-2],我国高血压发病率呈逐年升高趋势,这导致临床收治的与高血压相关心脑血管疾病患者有所增加。高血压性脑出血(hypertlensive intracebral hemorrhage, HICH)是常见的高血压相关疾病[3]。HICH是指具有明确高血压病史的患者,在基底核、脑室、丘脑、小脑等部位突然发生脑实质出血,并排除外伤及其他继发性脑出血。当前缺乏对HICH有效的治疗方案,且存活患者也将遗留不同程度的神经功能缺损,导致HICH致残率、致死率均较高。尽早评估预后,并采取针对性手段,对于改善患者预后、提高患者救治成功率有重要意义。受HICH病情变化迅速及HICH预后影响因素众多等影响,临床医师多难以仅凭经验在早期判断患者预后情况。已有研究表明[4],免疫与脑损伤患者病情密切相关。且有研究提示[5],HICH患者血肿周围存在以Toll样受体-4表达上调介导免疫反应。细胞免疫、体液免疫是人体两大特异性免疫,当前关于细胞免疫的研究较多,而本文就体液免疫在HICH患者中的表达情况及其对预后的影响加以探究,以期辅助临床预后评估。研究结果如下。
1 资料与方法
1.1研究对象 选取2019年6月至2020年6月我院收治的150例HICH患者作为研究对象。男88例,女62例,平均年龄(53.82±6.82)岁,发病至接受救治时间0.5~22小时,平均(6.23±2.04)小时。所有患者根据发病3个月后改良Rankin量表评分(Modified Rankin Scale,mRS)划分为预后良好组(mRS评分≤2分)97例和预后不良组(mRS评分>2分)53例。另择同时期体检正常的30例健康人作为对照组,男18例,女12例,平均年龄(54.73±6.43)岁。纳入标准:(1)均符合《自发性脑出血诊断治疗中国多学科专家共识》[6]中诊断标准,且均经影像学手段提示典型出血部位并排除其他脑血管病变;(2)临床资料完整;(3)首次发病,且发病24h内得到救治;(4)均在我院进行治疗,无中途转入者;(5)患者或患者家属均知情,并签署知情同意书。排除标准:(1)既往卒中;(2)临床史或家族史精神疾病患者;(3)发病前合并肢体功能障碍、神经系统功能缺损;(4)先天性免疫缺陷;(5)发病1个月内手术史、感染史、输血史;(6)既往头颅手术史、创伤史,及合并肿瘤者。本研究获医学伦理委员会批准。
1.2方法 所有患者入院第1天开始完善各项检查,包括格拉斯哥昏迷量表(Glasgow Coma Scale, GCS)评分、脑卒中神经缺损程度的量表(National Institutes of Health Stroke Scale, NIHSS)评分、收缩压、舒张压,并保存CT、MRI等影像学检查结果,记录血肿量。所有患者在入院第1、3、11天清晨抽取肘静脉血,对照组仅在入院第1天抽取1次空腹肘静脉血,所有血液标本加抗凝并离心制取血清标本,-70 ℃下保存待测;取血清标本上AU640全自动生化分析仪(Olympus,日本),免疫透射比浊法测定血清中免疫球蛋白IgG、IgA、IgM及补体C3、C4水平。
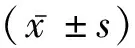
2 结 果
2.1HICH患者临床资料 预后不良组与预后良好组在基线收缩压、舒张压上比较差异均无统计学意义(P>0.05);但预后不良组GCS评分低于预后良好组(P<0.05),NIHSS评分、血肿量、WBC高于预后良好组(P<0.05)。见表1。
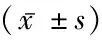
表1 不同预后HICH患者临床资料
2.2不同受试者体液免疫水平比较 3组受试者体液免疫IgG、IgM及补体C3、C4水平比较差异有统计学意义(P<0.05),预后不良组、预后良好组IgG、IgM及补体C3、C4水平均低于对照组(P<0.05),预后不良组IgG、IgA、IgM及补体C3、C4水平均低于预后良好组(P<0.05)。见表2。
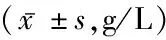
表2 3组免疫球蛋白及补体C3、C4水平比较
2.3不同预后HICH患者体液免疫水平变化 2组患者均第3 d血清IgG、IgM水平下降至最低;组间、同时点比较,预后不良组第1、3 d血清IgG、IgM、C3、C4均低于预后良好组(P<0.05),预后不良组第11 d血清补体C3、C4均高于预后良好组(P<0.05)。2组IgG、C3、C4的组间、不同时点及组间和不同时点的交互作用均有统计学意义(P<0.05),不同时间、组别的IgM比较差异有统计学意义(P<0.05),IgA水平无变化(P>0.05)。见表3。
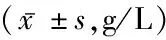
表3 不同预后HICH患者免疫球蛋白及补体C3、C4水平变化
2.4IgG、IgM、C3、C4与GCS评分、NIHSS评分、血肿量、WBC的相关性分析 IgG、IgM、C3、C4水平与GCS评分均呈正相关(P<0.01);IgG、IgM、C3、C4水平与NIHSS评分、血肿量及WBC呈负相关(P<0.01)。见表4。

表4 体液免疫指标与GCS、NIHSS评分、血肿量及WBC的相关性分析
3 讨 论
本研究显示,与预后良好组比较,预后不良组基线GCS评分降低,NIHSS评分、血肿量增加。GCS评分常被用于预测HICH远期预后及再出血风险,NIHSS评分显示患者神经缺损程度,GCS、NIHSS评分与血肿量、脑损伤程度密切相关,血肿量越高、脑实质损伤范围越大,导致意识障碍程度加大、神经系统受损程度加深[7-9]。HICH患者形成的血肿不仅引发神经细胞、神经胶质细胞直接损伤的原发性脑损伤,还因不断扩大的血肿体积诱发一系列的免疫炎症反应,促进神经细胞的死亡、加重血脑屏障损害[10-11]。炎症反应在脑损伤中的作用机制已有诸多研究。炎症反应被认为参与了脑出血的生理病理机制,在脑出血血肿内部及周围存在着中性粒细胞、巨噬细胞渗出和小胶质细胞的快速活化为特征的炎性反应[12-13],各信号通路通过加剧组织氧化损伤、促进血脑屏障开放、介导凝血反应等加重病情。既往认为中枢神经属于“免疫特区”,但随着认识的加深,当前认为免疫应答和调节参与了神经系统损伤。本组案例结果显示,与正常人比较,HICH患者IgG、IgM及补体C3、C4水平均显著下降,而基线体液免疫与能有效反应HICH患者脑损伤程度和评估预后的基线GCS评分、NIHSS评分、血肿量及WBC均呈一定的相关性。
HICH患者早期存在着免疫抑制。这是因为机体受创伤及手术刺激的影响,处于高分解代谢的应激状态,消耗性下降及炎症时相关酶水解作用加强,从而表现为HICH患者体液免疫受到抑制。与预后良好组相比,预后不良组应激反应更为激烈,抑制作用也更为明显。因交感神经、丘脑直接参与了免疫调控[14],随着脑出血导致患者脑组织损伤、坏死扩大,产生的缺血、缺氧环境又会导致神经内分泌系统紊乱、免疫调节网络失衡以及破坏细胞膜而导致免疫球蛋白合成增多。本研究也观察到预后良好组、预后不良组患者均在第3 d出现IgG、IgM水平的上升。受损组织释放的水解酶、细胞坏死后释放的线粒体等都可激活补体,而补体C3、C4的过度激活会导致血管壁的连续性受损而增加血管通透性,补体C3、C4裂解片段C3b、C4b附着于细胞表面并促进巨噬细胞吞噬[15]。本研究结果显示,HICH患者在第3天便开始出现补体C3、C4的过度激活。相较于预后良好组,预后不良组免疫球蛋白及补体C3、C4变化更为明显,即预后不良组体液免疫抑制或激活程度更为明显。这可能是因为,免疫过度抑制会降低患者抵抗外界病原菌能力而增加感染风险,免疫过度激活又会破坏血泡屏障、促进巨噬细胞吞噬、增加细胞毒性而损害神经元并诱发全身性炎症反应。这提示,临床对于基线体液免疫受到抑制更为严重的HICH患者要尤为重视其不良预后的发生,此外,是否能够通过免疫制剂降低患者免疫抑制程度以提高患者预后,则需要后续研究。
综上所述,HICH患者体内存在体液免疫抑制,血清免疫球蛋白及补体C3、C4水平均低于正常人水平,且HICH不良预后患者体液免疫抑制或激活程度高于预后良好患者。受HICH影响因素众多,临床对于HICH的预后评估需要多方面的评价,本研究仅对体液免疫对HICH患者预后价值加以分析,细胞免疫对于HICH的预后是否也有相似的价值,则需要进一步的研究。此外,本研究除选择样本较少可能导致的统计学偏差外,本研究中以mRS评分划分患者预后效果,未对出血部位、治疗方式、血肿量不同的HICH患者做更细致的研究,这有待于大样本、多中心的研究。

