粟酒裂殖酵母Atp25蛋白定位和功能研究
张 云,黄 鹰
(南京师范大学生命科学学院,江苏 南京 210023)
线粒体是半自主性细胞器,包含自身的基因组mtDNA(线粒体DNA),编码少部分线粒体蛋白质. 裂殖酵母的线粒体基因组有8个mRNA(表达蛋白分别为Cox1、Cox2、Cox3、Cob1、Atp6、Atp8、Atp9、Var1)、2个 rRNA和一个编码tRNA 5′末端加工酶中RNA的组分rnpB. 线粒体由线粒体内膜和线粒体外膜组成[1],是细胞功能的核心. 多年来人们对于线粒体的研究重点一直放在其主要功能方面,即以ATP的形式为细胞提供大部分能量,然而线粒体在其他各种代谢过程中也是必不可少的,包括氧化磷酸化、氨基酸代谢和铁硫团簇的形成[2-4]等. 包括人类和酵母在内的各种生物体中,线粒体在调节细胞凋亡和衰老方面发挥着重要作用. 人类线粒体功能障碍会导致多种疾病的产生,如糖尿病、心脏病和癌症. 线粒体功能异常也与神经退行性疾病有关,如帕金森氏症、阿尔茨海默氏症和亨廷顿病[5-7].
酵母ATP合酶是一种旋转的分子机器,主要负责产生ATP,为细胞生命活动提供能量. ATP合酶由17个不同的亚基组成,分为可溶性F1区段和膜嵌入F0区段[8]. F1区段的催化头和F0区段中的膜集成式电机模块通过两个杆相连,即F1中央杆和F0外围杆[9]. ATP合酶是真核细胞中最重要的酶之一,负责在有氧条件下合成真核细胞中90%以上的ATP. 大多数酵母ATP合酶亚基蛋白由细胞核基因组编码,在胞质核糖体上翻译并被运输至线粒体[10-11]. 酵母细胞作为研究ATP合酶的模式生物,便于研究者更加深入地了解ATP合酶复合物的结构、功能和生物发生过程[12].
芽殖酵母中Atp25蛋白的相关研究较为透彻,ATP25对于ATP合酶中ATP9mRNA稳定性和Atp9蛋白的表达是必需的,ATP25缺失引起ATP9mRNA及其翻译产物的缺失,从而阻止功能性F0的装配,因而ATP25对ATP合酶功能的正常发挥至关重要[13-15]. 粟酒裂殖酵母作为一种独特的酵母,其与高等真核生物有许多共同的特征. 在裂殖酵母中,Atp25蛋白的定位及其对线粒体功能的影响尚未明确. 本文主要研究粟酒裂殖酵母中Atp25蛋白定位和参与线粒体功能的机制.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
菌株:粟酒裂殖酵母单倍体菌株yHL6381(h+,his3-D1,leu1-32,ura4-D18,ade6-M210)、大肠杆菌EscherichiacoliTop10.
质粒:pFA6a-KanMX6、pJK148、pYJ19.
1.1.2 培养基
LB培养基:Tryptone 1g,Yeast Extract 0.5 g,NaCl 1 g,Agar Powder(固体)1.5 g,ddH2O 100 mL;YES培养基:Yeast Extract 0.5 g,Glucose 3 g,Adenine、Histidine、Uracil、Leucine各250 mg,Agar Powder(固体)2 g,ddH2O 100 mL;EMM-Leucine培养基:C8H5KO40.3 g,Na2HPO4·12H2O 0.555 g,NH4Cl 0.5 g,100×Salt Stock 1 mL,1 000×Vitamin 100 μL,1 000×Mineral Stock 10 uL,Adenine、Histidine、Uracil各250 mg,Glucose 2 g(单独灭菌),Agar Powder(固体)2 g,ddH2O 100 mL;YES+3%甘油:Yeast Extract 0.5 g,Glycerinum 3 mL,Adenine、Histidine、Uracil、Leucine各250 mg,Agar Powder(固体)2 g,ddH2O 100 mL.
1.1.3 试剂与仪器
试剂:Proofast Siper-Fidelity DNA Polymerase购自ATG公司;4×Wiper Mix、5×Super Mix、SYBR qPCR Master Mix和产物纯化试剂盒购自南京诺唯赞生物科技有限公司;PCR引物由上海捷瑞生物工程有限公司合成;质粒提取试剂盒购自北京擎科新业生物技术有限公司;3.5×MES、37.5%丙烯酰胺、10% APS、TEMED购自上海生工生物工程股份有限公司;Mitotrack线粒体染色剂购自南京丁贝生物科技有限公司;T4 DNA连接酶购自Takara公司.
仪器:Odyssey双色红外激光成像系统;Applied Biosystems仪器;上海知楚振荡培养箱;垂直电泳仪;恒温培养箱;高压灭菌锅;高速离心机;BIO-RAD Thermal Cycler PCR仪等.
1.2 方法
1.2.1 生物信息学分析
采用生物软件Vector NTI中AlignX进行蛋白序列分析;采用在线网站(http://ihg.gsf.de/ihg/mitoprot.hml)分析线粒体定位序列;采用在线网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析蛋白质结构.
1.2.2 菌株构建
通过查阅Pombase网站获得atp25基因序列,在外显子上下游设计引物,扩增得到上下游同源臂,通过酶切酶连将其构建到质粒pFA6a-KanMX6上,获得重组质粒. 以重组质粒为模板PCR获得上游同源臂、KanMX6、下游同源臂单一目的片段,经过醋酸锂转化将目的片段导入野生型yHL6381菌株中,通过同源重组的方法获得Δatp25菌株;PCR扩增atp25外显子序列及其启动子、终止子序列,将其构建到质粒pJK148上,获得重组质粒,NruⅠ限制性内切酶分别切割重组质粒、pJK148空载质粒获得线性片段并导入Δatp25菌株中,通过同源重组整合到Leu位点得到全长回补菌株Atp25、空载回补菌株PJK148;PCR扩增atp25外显子序列将其构建到质粒pYJ19上,获得重组质粒,NruⅠ限制性内切酶切割重组质粒并导入Δatp25菌株中,通过同源重组整合到Leu位点得到Atp25-GFP菌株;构建pPFA6a-上游同源臂-myc-hph-下游同源臂重组质粒,PCR获得单一目的片段,导入菌株yHL6381中得到Atp25-Myc菌株.
1.2.3 表型实验
将菌株(yHL6381、Δatp25、PJK148、Atp25)分别接种至5 mL液体培养基YES中,30 ℃、200 r/min振荡过夜培养;转接至新鲜的YES中调整OD=0.2,振荡培养过夜测量OD值,取菌液调整初始OD=3,进行10倍梯度稀释,使用漩涡仪振荡混匀,取3 μL菌液点圈至YES、YES+3%甘油固体板,倒放置30 ℃恒温培养箱培养数天,拍照培养皿.
1.2.4 荧光定位实验
将菌株Atp25-GFP接种至5 mL EMM-Leucine液体培养基中,30 ℃、200 r/min培养过夜,再转接至新鲜的液体培养基中,调整OD=0.2,放入振荡培养箱30 ℃、200 r/min培养7 h至OD=0.6~0.8之间,取约100 μL菌液离心,1×PBS清洗细胞3次,最后100 μL 1×PBS重悬细胞,加入1 μL Mitotrack Red染料,振荡染色30 s,离心弃上清,10 μL 1×PBS重悬菌液,取2.5 μL制片,进行荧光观察.
1.2.5 存活率测定
将yHL6381、Δatp25菌株接种至YES液体培养基中,30 ℃、200 r/min过夜振荡培养,转接至新鲜的YES液体培养基,调整OD600=0.2,30 ℃、200 r/min培养,每隔12 h取一次菌液,调整OD=3后进行稀释,12 h、24 h、36 h稀释10-4倍,48 h、60 h稀释10-3倍,72 h稀释10-2倍,取100 μL涂布于YES平板,重复 3组,30 ℃培养3 d,计算每个时间点下培养基中的菌落数,得出不同时间点的存活率(不同时间点的存活率=不同时间点的活菌数/12 h的活菌数×100%).
1.2.6 Western-blot检测Atp25蛋白线粒体定位
将Atp25-myc菌株接种至5 mL液体培养基YES中,30 ℃、200 r/min培养过夜,再转接至500 mL新鲜的液体培养基YES中,调整OD=0.2,培养一段时间待菌液OD=1左右,离心收集菌后,提取线粒体,通过Western-blot检测Atp25蛋白的定位,其中Sla1蛋白、Hsp60蛋白分别为细胞核蛋白、线粒体基质蛋白.
1.2.7 Western-blot检测线粒体呼吸链蛋白表达水平
取两份等量的yHL6381、Δatp25菌株的线粒体加入5×Protein loading buffer,第一份线粒体45 ℃温浴 3 min 检测Cox1、Cox3、Cob1蛋白;第二份线粒体100 ℃处理10 min检测Hsp60、Cox2、Atp6蛋白;将样品加至10% SDS-PAGE胶槽;电泳:80 V 0.5 h,120 V 1 h;转膜(NC膜):300 mA,1.5 h;封闭液封闭1~2 h;TBST洗膜3次/5 min;一抗孵育2 h;TBST洗膜3次/5 min;二抗避光孵育1 h;TBST洗膜3次/5 min;Odessey Infrared Imaging仪器扫描结果.
1.2.8 qRT-PCR检测线粒体呼吸链蛋白的mRNA水平
分别活化菌株yHL6381、Δatp25菌株,接种至5 mL液体培养基YES中,30 ℃、200 r/min培养12 h,再转接至10 mL新鲜的液体培养基中,调整OD=0.2,培养一段时间待菌液OD=1左右,Yeast RNA Kit 试剂盒提取酵母细胞RNA,逆转录形成cDNA,以cDNA为模板进行qRT-PCR检测线粒体呼吸链蛋白mRNA水平.
2 结果与讨论
2.1 Atp25蛋白定位在线粒体

表1 Atp25蛋白线粒体定位序列(MTS)分析结果Table 1 MTS analysis results of Atp25 protein
2.1.1 生物信息学分析Atp25蛋白大小及线粒体定位
通过在线网站PomBase、Saccharomyces Genome Database(SGD),获得粟酒裂殖酵母Atp25蛋白和芽殖酵母Atp25蛋白的氨基酸序列. 裂殖酵母Atp25蛋白由核基因组编码,具有542个氨基酸,其分子量大小为62.62 kDa. 芽殖酵母Atp25蛋白具有612个氨基酸,分子量大小为70.43 kDa. Align X进行蛋白序列比对,结果显示芽殖酵母Atp25和裂殖酵母Atp25的相似性为27.6%(见图1). 在线网站MitoProt Ⅱ分析结果显示Atp25蛋白定位在线粒体的概率为60.36%(见表1).

图中加阴影及*的部分为完全相同序列图1 ScAtp25和SpAtp25相似性比对结果Fig.1 The similarity comparison results of ScAtp25 and SpAtp25
2.1.2 荧光显微镜观察Atp25蛋白线粒体定位
生物信息学分析结果预测Atp25蛋白定位在线粒体,为进一步验证Atp25蛋白的定位,本文构建了Atp25-GFP菌株(Atp25蛋白C端融合表达GFP标签),通过荧光显微镜Green通道观察Atp25蛋白在酵母细胞中的分布,然后利用Mito Tracker Red染料对Atp25-GFP菌株进行线粒体染色,线粒体在荧光显微镜Red通道下发出红色荧光,将两者进行Merge有非常高的黄色共定位,Atp25蛋白分布与线粒体分布相重合,表明Atp25蛋白定位在线粒体(见图2).

图2 荧光显微镜观察Atp25-GFP与线粒体的共定位Fig.2 Fluorescence microscope observation for the localization of Atp25-GFP and Mito Tracker labeled mitochondria
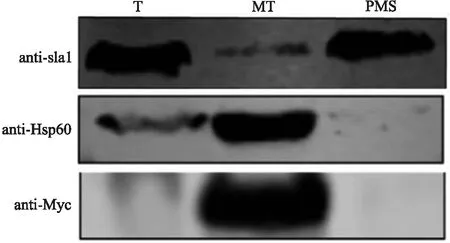
图3 Western-blot检测Atp25蛋白定位Fig.3 Western-blot detection of Atp25 protein localization
2.1.3 Western-blot检测Atp25蛋白线粒体定位
通过荧光显微镜可初步观察Atp25定位在线粒体. 为进一步验证,本文提取了Atp25-myc菌株的线粒体,在提取过程中保留T(全蛋白提取样品)、Mt(线粒体蛋白样品)和PMS(除线粒体外其他组分蛋白),以细胞核蛋白Sla1和线粒体基质蛋白Hsp60作为对照. 如图3所示,Western-blot结果显示在线粒体样品中检测到Atp25蛋白,表明Atp25蛋白定位在线粒体,并在线粒体中发挥功能.
2.2 Δatp25菌株存在生长及呼吸缺陷
2.2.1 菌株的构建
(1)Δatp25菌株的构建及验证
PCR获得atp25上下游同源臂(图4A和4B),上下游重组质粒酶切验证(图4C和4D),将含有同源臂以及KanMX6目的片段醋酸锂转化导入野生型菌株yHL6381中,挑取转化子进行验证,设计验证引物F1(上游引物的5′端)、R1(下游引物的3′端)、R2(KanMX6中间反向引物),使用引物F1+R1进行半长验证(图4E),使用F1+R2进行全长验证(图4F),结果显示菌株构建成功.
(2)全长回补菌株Atp25的构建及验证
PCR获得atp25回补片段(图4G);重组质粒的酶切验证(图4H);NruⅠ酶切重组回补质粒获得线性片段导入到Δatp25菌株中,挑取转化子验证.

M:核酸Marker;A-F为Δatp25菌株的构建:A-B分别为上游同源臂、下游同源臂;C为上游重组质粒酶切验证;D为下游重组质粒酶切验证;E-F为转化子PCR验证;G-H为回补菌株Atp25重组质粒的构建和验证.图4 菌种的构建与验证Fig.4 Construction and verification of strains
2.2.2 Δatp25为呼吸缺陷型菌株
上述结果显示Atp25蛋白定位在线粒体中. 为研究Atp25蛋白对线粒体功能的影响,将yHL6381、Δatp25、PJK148、Atp25菌株在YES、甘油培养基上点圈. 其中,YES为发酵型培养基,酵母细胞以无氧呼吸为主,不需要利用线粒体;3%甘油+0.1%葡萄糖为非发酵型培养基,酵母细胞进行有氧呼吸,完全依赖线粒体发挥功能. 通过表型实验,研究Atp25蛋白是否参与线粒体呼吸作用. 结果显示,YES培养基中这4株菌均正常生长;甘油培养基中,Δatp25、PJK148(对照菌)菌株生长缓慢,而全长回补菌株Atp25与yHL6381生长情况相同(图5),表明Atp25蛋白缺失影响了酵母细胞正常的呼吸作用,Δatp25为呼吸缺陷型菌株.
2.2.3 Δatp25菌株存活率降低
研究结果表明Δatp25菌株为呼吸缺陷型菌株,为进一步研究Δatp25菌株的生长情况,将yHL6381、Δatp25菌株分别在YES培养基中培养,每隔12 h进行平板菌落计数. 结果显示Δatp25菌株存活率显著下降(图6),表明Atp25蛋白缺失影响酵母细胞的正常生长,Δatp25菌株可能由于呼吸作用受损从而影响酵母菌的正常生长,因此Atp25蛋白对线粒体呼吸作用的正常发挥非常重要.
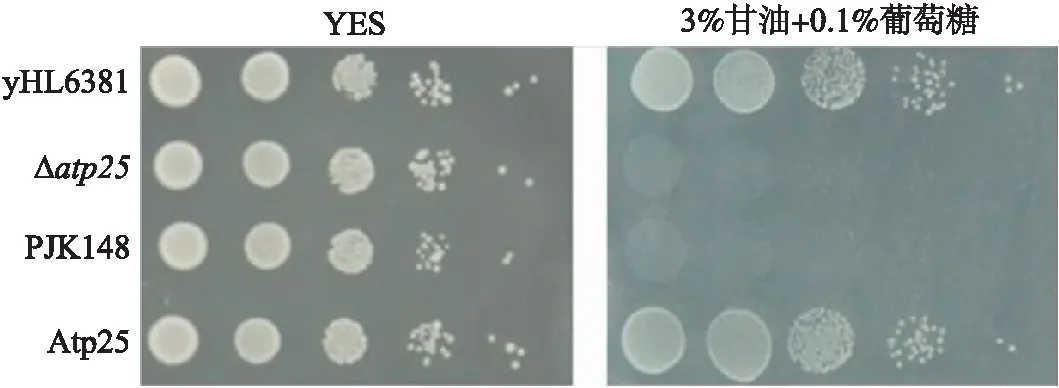
图5 Δatp25菌株的表型结果Fig.5 Phenotypic results of Δatp25 strain
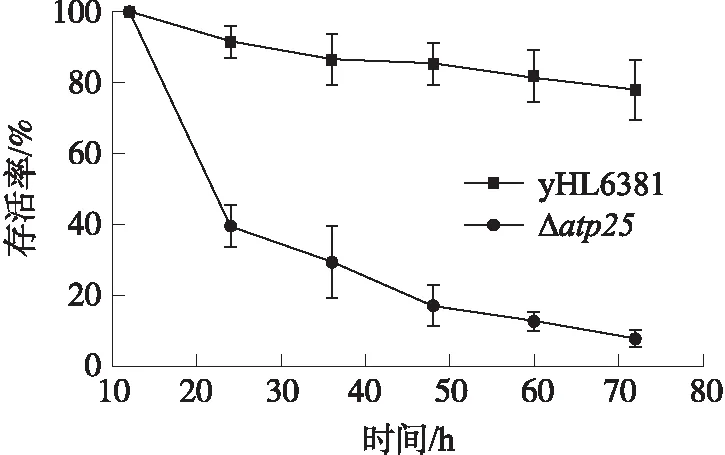
图6 存活率测定结果Fig.6 Results of survival rate determination
2.3 Atp25蛋白缺失影响线粒体呼吸链蛋白表达水平
2.3.1 Δatp25菌株线粒体呼吸链蛋白表达水平下调
线粒体是通过有氧呼吸产生能量的主要场所,上述研究结果显示Δatp25菌株不能在非发酵培养基上正常生长,表明Δatp25菌株为呼吸缺陷型菌株. 为进一步研究Atp25蛋白对线粒体呼吸作用的影响,本文利用Western-blot检测yHL6381、Δatp25菌株线粒体呼吸链蛋白的表达水平,这些蛋白分别为电子传递链复合体Ⅲ(Cob1)、Ⅳ(Cox1,Cox2,Cox3)、Ⅴ(Atp6)蛋白. Western-blot结果显示Δatp25菌株中Cox1、Cox2,Cox3、Cob1、Atp6蛋白表达量显著降低(见图7),表明Atp25蛋白缺失影响线粒体呼吸链蛋白表达水平,从而影响裂殖酵母细胞正常的呼吸作用.
2.3.2 Δatp25菌株线粒体呼吸链蛋白mRNA水平无变化
上述研究结果显示Δatp25菌株中线粒体呼吸链蛋白水平受到严重的影响. Atp25蛋白对线粒体呼吸作用非常重要,为进一步研究Atp25蛋白在转录水平对线粒体呼吸链蛋白的影响,本文通过qRT-PCR技术检测yHL6381、Δatp25菌株线粒体呼吸链蛋白的mRNA水平,结果显示Cox1、Cox2、Cox3、Cob1、Atp6的mRNA水平未受影响(见图8),说明Atp25蛋白在转录后水平调控线粒体呼吸链蛋白的表达,Atp25蛋白缺失导致线粒体呼吸链不能正常组装,从而影响酵母菌正常的呼吸作用.
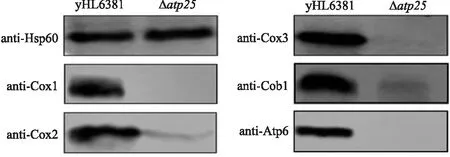
图7 Western blotting检测Δatp25菌株线粒体呼吸链蛋白表达量Fig.7 Western blotting for mitochondrial respiratory chain protein expression in Δatp25 strain

图8 qRT-PCR检测Δatp25菌株线粒体 呼吸链蛋白mRNA水平Fig.8 Detection of mitochondrial respiratory chain protein mRNA levels in Δatp25 strain by qRT-PCR
3 结论
裂殖酵母是一种单细胞生物,具有单倍体的优点,可以很容易地进行基因操作. 裂殖酵母在生长、应激反应、细胞形态和细胞生物化学等方面具有丰富的遗传表型多样性[16]. 与芽殖酵母相比,RNA的剪接机制更类似于高等真核生物,裂殖酵母被认为是一种独特的酵母,具有与哺乳动物细胞相似的特征,使裂殖酵母成为一个信息丰富和准确的真核分子生物学研究模型系统[17].
线粒体被称为“细胞的发动机”,通过氧化磷酸化合成大量ATP,是细胞生命活动的主要能量来源. ATP的合成由ATP合酶复合体催化完成. 研究表明芽殖酵母Atp4蛋白和Atp10蛋白参与编码ATP合酶F0亚基相关蛋白,参与线粒体的能量代谢过程并与线粒体ATP的产生密切相关. 以裂殖酵母Atp4和Atp10蛋白参与线粒体功能的研究为出发点,探索其与线粒体的内在联系,为进一步研究Atp4和Atp10蛋白如何参与ATP合酶的组装奠定基础[18-19]. 芽殖酵母Atp25蛋白也是组装ATP合酶的关键蛋白,Atp25蛋白由3个不同部分组成:N端MTS、与细菌Rsf相关的结构域和稳定ATP9mRNA的结构域(M结构域). 研究表明ATP25突变体中F0的功能性缺失与Atp9亚基的严重缺失有关,芽殖酵母ATP25对于ATP9的表达是必需的,Atp25蛋白参与ATP合酶的膜扇区F0的组装[20]. 通过序列比对和蛋白序列分析,粟酒裂殖酵母Atp25蛋白与芽殖酵母Atp25蛋白相似性达27.6%,且都含有RsfS、mRNA stabil结构域. 芽殖酵母Atp25蛋白对于线粒体功能相关研究较为透彻,粟酒裂殖酵母中Atp25蛋白参与线粒体功能的机制尚不清楚.
本文主要研究粟酒裂殖酵母Atp25蛋白的定位和参与线粒体功能的机制,为进一步研究Atp25蛋白是否参与ATP合酶组装提供理论基础. 首先通过荧光显微镜观察和免疫印迹技术研究Atp25蛋白线粒体定位,说明Atp25蛋白在线粒体中发挥功能. 通过表型实验研究Atp25蛋白与线粒体呼吸作用的关系,结果显示Δatp25菌株为呼吸缺陷型菌株,通过测定Δatp25菌株的存活率,表明Atp25蛋白缺失缩短了酵母菌的生长寿命,Δatp25菌株可能由于呼吸作用受损从而影响酵母菌的正常生长,因此Atp25蛋白对线粒体呼吸作用非常重要. 进一步研究发现Δatp25菌株中线粒体呼吸链复合体Ⅲ(Cob1)、Ⅳ(Cox1,Cox2,Cox3)、Ⅴ(Atp6)蛋白水平显著降低,线粒体呼吸链蛋白的mRNA水平未受影响,说明Atp25蛋白在转录后水平调控线粒体呼吸链蛋白的表达,Atp25蛋白缺失导致线粒体呼吸链不能正常组装,从而影响酵母菌正常的呼吸作用. 综上所述,裂殖酵母Atp25是核基因组编码蛋白质,在线粒体中发挥功能,对线粒体呼吸作用的正常发挥和酵母细胞的正常生长至关重要. 本文明确了粟酒裂殖酵母Atp25蛋白的定位以及对线粒体呼吸作用的重要性,为进一步研究Atp25蛋白提供理论基础.

