手性除草剂2甲4氯丙酸对映体在拟南芥中吸收转运及亚细胞分布的差异研究
常江海 郭 维 郑姚颖 张素芬 叶庆富
(浙江大学原子核农业科学研究所/农业部核农学重点实验室,浙江 杭州 310029)
除草剂在世界范围内的使用量已居于各大农用化学品的首位,其中约40%的品类具有手性结构[1]。手性除草剂虽然具有相同的理化性质,但其在生理代谢、毒理学及环境化学等方面都有可能表现出较大的对映体选择性差异[2-4]。具有手性的除草剂对映体在施用于靶标植物时,通常会被选择性地识别和互作,从而产生具有对映体选择性特征的吸收、分布、转运、代谢及作用机理上的差异[2,4-6]。
手性除草剂2 甲4 氯丙酸(mecoprop,以下简称MCPP)是一种常用的苯氧羧酸类激素型内吸性除草剂,具有一个手性中心,两个相应对映体构型(R/S)[7-8]。MCPP 多用于防治谷类作物苗后早期的双子叶杂草[8]。精2 甲4 氯丙酸(即mecoprop-P)与典型激素型除草剂2,4-D(2,4-dichlorophenoxyacetic acid)、2 甲 4 氯(2-methyl - 4-chlorophenoxy acetic acid,MCPA)等具有相同的作用模式。经双子叶植物内吸后,这一类型的除草剂通过“模仿”植物内源生长激素吲哚-3-乙酸(indole-3-aceticacid,IAA)的作用,在细胞核内产生相较于内源生长素更强且更持久的基因水平上的调控[4],引发与乙烯(ehtylene)、脱落酸(abscisic acid,ABA)合成相关的下游基因持续表达,产生过量的活性氧簇(reactive oxygen species,ROS)和氰化物(cyanide),破坏植物的激素平衡,紊乱正常生理代谢,加速衰老与死亡[9-13]。经证实,这些除草剂和IAA 一样,能引起相同类型的植物反应,但具有长效性和相对较高的活性,这是由于它们在植物中具有较高的稳定性,而内源植物激素,如IAA 在植物中可通过结合或降解等多重路径导致失活较快。属于非活性部分的S-MCPP,其除草活性强度远小于其R 型对映体[8],而目前对产生这种对映体除草活性显著差异的具体原因尚未明晰。MCPP 的2 个对映体在双子叶植物中的迁移规律和亚细胞水平分布上呈现对映体选择性,这是判断药效能否发挥的先决因素,也是综合评估二者除草活性差异的重要条件之一[14-17]。因此,本研究以双子叶模式植物拟南芥为试验对象,研究MCPP对映体在拟南芥中的吸收转运和在亚细胞水平分布的比率差异,为更全面地了解以MCPP 为代表的手性激素类除草剂对靶标双子叶植物毒性的对映体选择性行为与效应,研发新型高效、低毒副作用的环境友好型单一光学活性除草剂提供依据[18-19]。
1 材料与方法
1.1 试验材料
本试验受试植物采用野生哥伦比亚型拟南芥(Arabidopsis thaliana)。试验所用14C-MCPP[14C-2-(4-chloro-2-methylphenoxy)propanoic acid]2 个类型对映体购自上海启甄同位素标记合成中心,结构如图1所示,比活度为S 型:6.14×108Bq.mmol-1,R 型:5.64×108Bq.mmol-1,二者化学纯度、放射性纯度及对映体比率(enantiomeric ratio,Er)均高于99%,2 种供试药剂用添加助溶剂二甲基亚砜(dimethyl sulfoxide,DMSO)的10%丙酮-水溶液溶解,配置成40 mg.L-1母液。母液稀释成指定的试验浓度后,将2 种待测混合剂置于 Tricarb - 2910TR 液体闪烁计数器(PerkinElmer,USA)中测定放射性活度,确定施药的放射性活度总引入量Aa。
1.2 试验设计
将供试拟南芥种子4℃春化2 d 后,在黑土∶蛭石配比为1 ∶1(v ∶v)的无菌培养箱中短日照培养20 d(光照时间为10 h.d-1)。20 d 后,选取一批处于8 ~9 叶期,长势与重量相近的植株,进行施药试验。如图2 所示,拟南芥生长初期的莲座叶以顺时针或逆时针为序依次长出,相邻生长叶片之间的角度为100°~140°。规定编号4~6 的叶片为标记叶;编号1~3 的初生叶片及子叶和座薹茎为标记下位;编号7 ~9 的叶片及座薹茎上的少量初生叶为标记上位。分别用2 种14C-MCPP配制成3.0×10-5mol.L-1的浓度后对标记叶进行涂抹,每株标记叶片为编号4 ~6 三片,平均每片叶片均匀涂抹3.0 μL,共施药9.0 μL,平行重复3 次。
1.3 测定项目及方法

图1 14C-R-MCPP 与14C-S-MCPP 结构示意图Fig.1 Structure of 14C-R-MCPP and 14C-S-MCPP
图2 拟南芥9 叶期叶序俯视图(生长次序为1~9 逆时针轮生)Fig.2 Top view of phyllotaxis of Arabidopsis thaliana in 9 leaf stage
1.3.1 吸收转运 分别于施药后6、12、24、48、72、144 h 进行取样,每个时间段平行取样的样本数为8,取样前先用去离子水淋洗叶片,回收未被植株吸收的药物。将全植株分为标记叶位点、标记上位、标记下位、根部四部分,置于60℃烘箱杀青,在OX-600 生物氧化燃烧仪(Rj Harvey Instrument Co.NJ,美国)中燃烧4 min,燃烧产生的14CO2用15 mL 的闪烁液B 吸收,闪烁液 B配方:5g2,5-二苯基恶唑(2, 5-diphenyloxazole, PPO),0.5 g 1,4-[2-(5-苯基恶唑)][(1, 4-bis - 5-phenyloxazole - 2-yl)-benzene,POPOP],350 mL 乙二醇乙醚,650 mL 二甲苯,之后用液体闪烁计数器(Beckman Coulter Diagnostics, 美国)测量各样本中的放射性活度。按公式计算吸收率(Ra)和转运比率(Rt):

式中,Ap表示某时刻测得的植株中的总14C 放射性活度,Aa表示引入植株的14C 总放射性活度。

式中,Ai表示t时刻植株i组分的14C 活度,Apt表示同时刻植株的14C 总放射性活度,当i组分为标记叶时,该比率代表的是t时刻的标记叶残留率Rt。
1.3.2 亚细胞分布 亚细胞分布试验参照文献[20-22],采用分步差速离心法。将1.3.1 中各时段取样后的标记叶收集起来,遴选其中新鲜完整、颜色较深的叶片,用剪刀剪碎成适量大小,称取0.30 g,加入12 mL亚细胞提取液(0.25 mmol.L-1蔗糖,1 mmol.L-1二硫代赤藓醇,50 mmol.L-1Tris-HCl 缓冲液,pH 值7.5),在匀浆器内研磨均匀后,将匀浆倒入离心管中,于4℃条件下300 r.min-1离心30 s,沉淀为细胞壁部分,主要组分为细胞壁和细胞壁碎片。然后将上清液于1 500 r.min-1离心10 min,得到的沉淀物为细胞器部分(其中包括细胞核、叶绿体、有色体和白色体等),得到的上清液为胞浆组分。将上述步骤获得的细胞壁和细胞器分别冷冻干燥除去水分后,分别在生物氧化燃烧仪中燃烧4 min,产生的14CO2用闪烁液B 吸收后在液体闪烁计数器中测量样本中的放射性活度。胞浆组分用提取液稀释成一定比例后直接用液体闪烁计数器测其放射性活度。将拟南芥标记叶位的叶肉组织细胞分为细胞壁、胞浆、细胞器3 个组分。按公式计算其分布利率(Rd):

式中,Si表示t时刻i组分的14C 比活度,Ss表示该时刻所有组分的14C 比活度之和。
1.4 数据处理
采用Origin 2017 进行数据统计与绘图,采用SPSS Statics 22 进行显著性分析和方差分析。相同构型、不同时间与不同构型、相同时间的数据比较采用单因素方差分析Tukey LSD。
2 结果与分析
2.1 拟南芥对2 种14C-MCPP 对映体的吸收动态
在施药后的处理期间每天观察施药拟南芥的长势,发现2 种药物处理后的拟南芥长势并无明显差异,在标记叶叶片施药处均有一定的轻微灼烧症状,可能是2 种药物在施药位点局部浓度过高导致的药害。拟南芥对2 种构型的14C-MCPP 吸收情况如图3 所示。分析统计结果表明,施药后的药物持续时间与药物构型无显著交互作用(P>0.05),拟南芥对2 种构型的14C-MCPP吸收差异显著(P<0.05)。14C-R-MCPP 对应的吸收率在施药后6 ~24 h 随时间变化差异显著(P<0.05),在施药48 ~144 h 内则随时间变化差异不显著(P>0.05)。而14C-S-MCPP 构型在施药后6~12 h其吸收率随时间变化差异显著(P<0.05),施药12 h之后则随时间变化差异不显著(P>0.05)。表明拟南芥对14C-S-MCPP 吸收达到平衡的用时较14C-R-MCPP少,而稳定后总体的吸收率较14C-R-MCPP 低4.79 个百分点。总体而言,拟南芥对2 种构型的14C-MCPP 达到平衡后的吸收率差异显著(P<0.05),对14C-RMCPP 的吸收率更高。
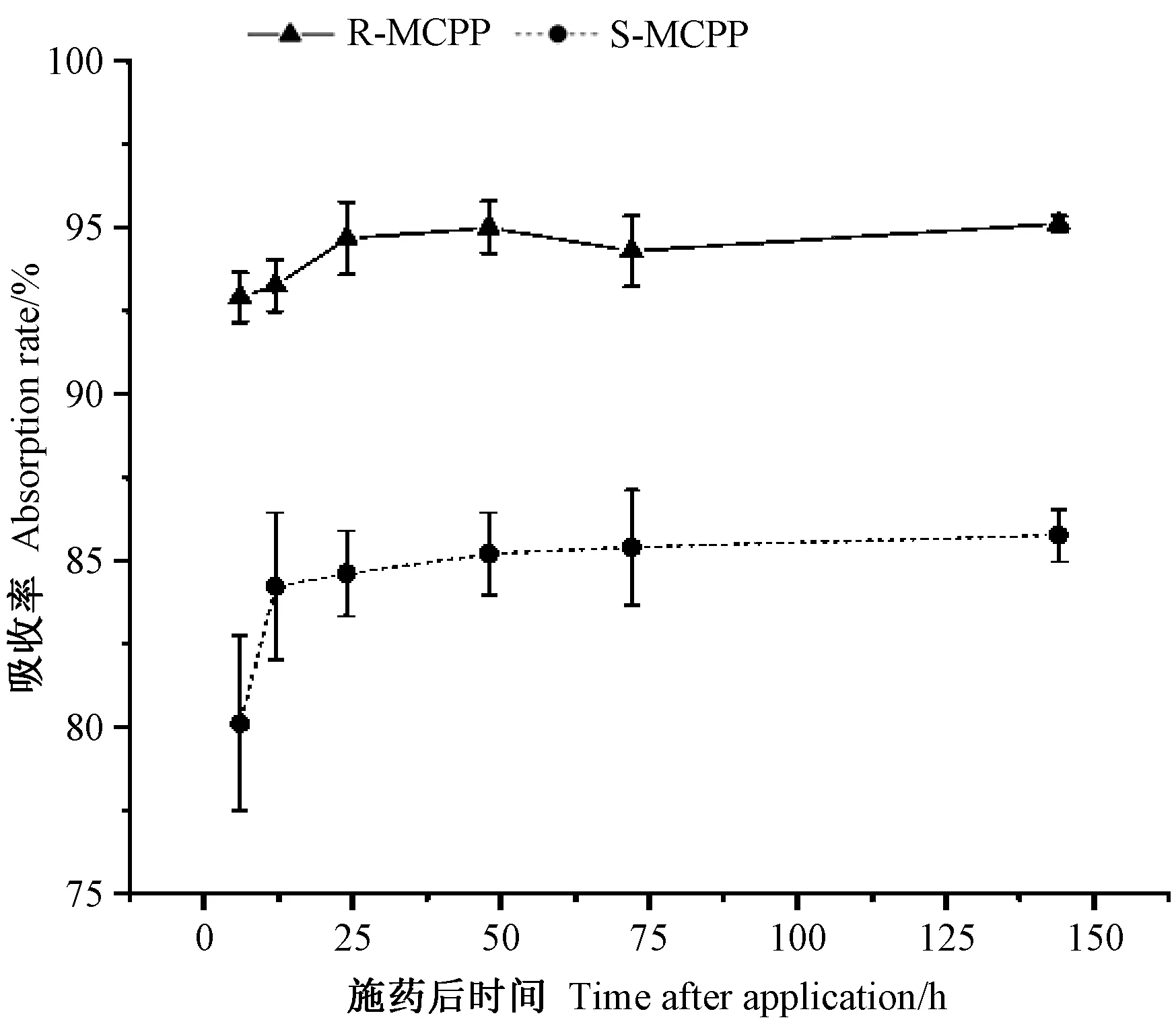
图3 14C-MCPP 吸收率Fig.3 14C-MCPP absorption rate
2.2 2 种14C-MCPP 对映体在拟南芥中的转运分布
2 种14C-MCPP 对映体在拟南芥标记叶位点、标记上位、标记下位(不包括根)及根部位点的转运分布数据如表1 及图4 ~6 所示。2 种构型的14C-MCPP 在标记叶上位的分布情况如图4 所示,14C-MCPP 对映体在标记上位的分布比率均随时间的推移表现为显著上升(P<0.05),除14C-S-MCPP 的分布比率在施药后144 h相较施药后72 h 的数值变化不显著(P>0.05),推测14C-S-MCPP 的分布比率为1.21%时达到了峰值,相较之下14C-R-MCPP 的分布比率在施药72 h 之后仍有缓慢上升的趋势。在施药后6 ~12 h,2 种14C-MCPP对映体在标记上位的分布水平相近,随后的24 ~128 h14CR-MCPP 的分布比率均较14C-S-MCPP 高。
2 种构型的14C-MCPP 在标记叶下位的分布如图5所示,施药后0 ~72 h,14C-R-MCPP 在标记下位的分布比率随时间的推移显著增加(P<0.05),施药后72 ~144 h,14C-R-MCPP 的分布比率升高并趋于稳定(P>0.05)。而14C-S-MCPP 在标记下位的分布比率在施药后12~24 h 和48 ~72 h 阶段随时间变化差异不显著(P>0.05),在施药后72 h,随时间推移增加的数值也较低,推测在施药12 h 后,14C-S-MCPP 在标记上位的分布比率已经稳定。比较同时段2 种对映体在标记上位的分布比率可知,14C-R-MCPP 与14C-S-MCPP 在施药后6~24 h 阶段差异不显著(P>0.05),在施药24 h之后,14C-R-MCPP 在标记上位的分布比率均较14C-SMCPP 显著提高(P<0.05)。
图6 显示了2 种14C-MCPP 对映体在拟南芥根部的分布情况。14C-R-MCPP 在拟南芥根部的分布比率随时间的推移显著升高(P<0.05),而14C-S-MCPP 在根部的分布比率则随时间的变化不显著(P>0.05)。在拟南芥体内转运的14C-MCPP 需先经过标记下位,才能到达根部,因而14C-MCPP 在根部的转运分布情况较为复杂,稳定后2 种14C-MCPP 对映体在根部的分布比率约维持在1.1%~1.5%,其中14C-R-MCPP 的分布比率约为14C-S-MCPP 的1.3 倍。
由表1 可知,施药后6 ~12 h,14C-R-MCPP 在标记叶位的残留比率与14C-S-MCPP 差异不显著(P>0.05),施药12 h 之后,14C-R-MCPP 在标记叶位的残留比率较14C-S-MCPP 显著降低(P<0.05)。标记叶位14C-S-MCPP 的残留比率在施药后144 h 与施药后72 h 差异不显著(P>0.05),说明标记叶位中的14C-SMCPP 在施药72 h 之后处于几乎不转运的状态;而标记叶位14C-R-MCPP 的残留比率在施药后144 h 与施药后72 h 差异显著(P<0.05),说明施药72 h 之后的14C-S-MCPP 在标记叶中尚未达到转运-残留平衡,而施药后144 h 残留的、未转运出的14C-R-MCPP 比率约为90.54%,低于14C-S-MCPP(95.41%)。
综合以上各部位中2 种14C-MCPP 对映体的分布数据,14C-R-MCPP 的分布比率达到平衡所需时间普遍比14C-S-MCPP 更长,其分布比例也更高,这一点在向标记下位运输时表现的更为明显。
2.3 2 种14 C-MCPP 对映体在拟南芥中的亚细胞分布比率
图7 为2 种构型的14C-MCPP 对映体引入拟南芥标记叶后在叶肉组织中亚细胞水平的分布比率。14CMCPP 的2 种构型在拟南芥标记叶位细胞中各组分的分布比率均为胞浆>细胞壁>细胞器。施药后6 h,14CR-MCPP 与14C-S-MCPP 在胞浆、细胞器中的分布比例差异不显著(P>0.05)。施药后144 h,14C-R-MCPP 在细胞壁的分布比率(28.74%)显著低于14C-S-MCPP 在细胞壁中的的分布比率(39.60%)(P<0.05),说明一定时间内拟南芥细胞壁对14C-S-MCPP 的固定能力较14C-R-MCPP 更强。相应地,施药后144 h,14C-R-MCPP在拟南芥细胞器中达到平衡时的分布比率(10.55%)较14C-S-MCPP(4.11%)高(P<0.05),约为后者的2.6倍,说明拟南芥标记叶位的细胞中细胞器对14C-RMCPP 的富集作用较14C-S-MCPP 强。
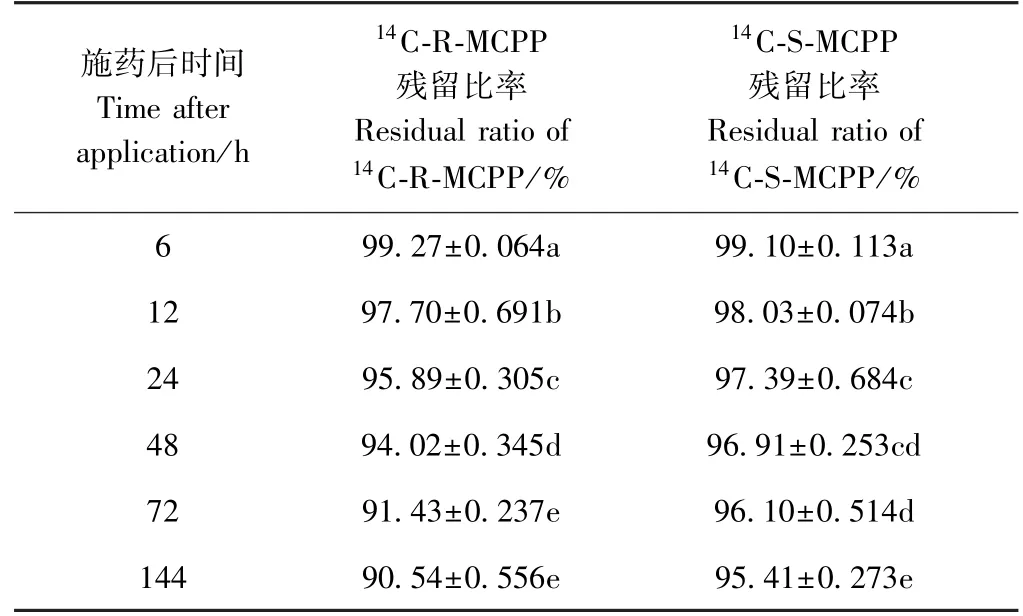
表1 14C-MCPP 在标记叶位置的残留比率Table 1 14C-MCPP residual ratio of labeled position

图4 14C-MCPP 标记上位分布比率Fig.4 14C-MCPP distribution ratio of upstream on the labeled position
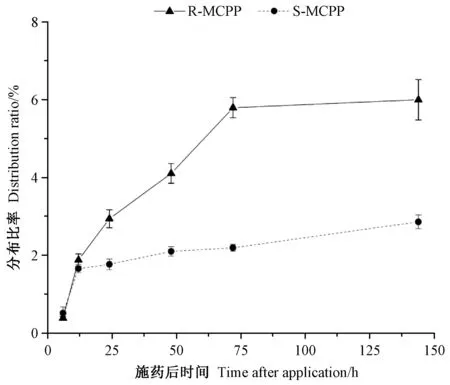
图5 14C-MCPP 标记下位分布比率Fig.5 14C-MCPP distribution ratio of downstream on the labeled position
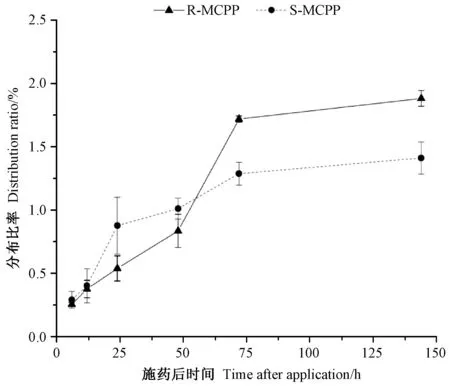
图6 14C-MCPP 根部分布比率Fig.6 14C-MCPP distribution ratio in root
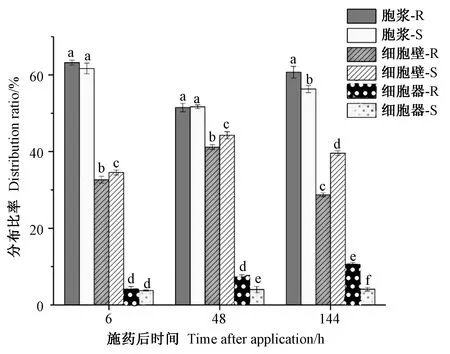
图7 14C-MCPP 在标记叶中的亚细胞分布比率Fig.7 Subcellular distribution ratio of 14C-MCPP in labeled leaves
3 讨论
植物可以通过共价结合、代谢降解等途径,将内源生长素的总体水平调控在一个稳定的层次,但外源激素类除草剂的引入通常会与内源生长素竞争结合,破坏激素水平的平衡,引发相关基因的超量响应和表达[4-5,11,23]。吸收比率更高,持效时间更长,与靶标受体结合能力更强的对映体构型显然更具除草活性方面的优势。手性除草剂MCPP 的2 个对映异构体中,RMCPP 的除草活性是S-MCPP 的5~6 倍[8]。已有研究证实,在几种典型双子叶阔叶杂草中,S-MCPP 的降解半减期普遍比R-MCPP 短,表明S-MCPP 可能更容易被双子叶阔叶植物降解,至于2 种构型在双子叶植物中的吸收和运转差异,尚不明确[24-25]。为更深入和全面地研究该现象产生的原因,本试验以拟南芥作为受试双子叶植物,探究MCPP 对映体在拟南芥中的吸收运转及亚细胞分布是否存在对映体选择性差异。综合分析可知,在吸收效率上的差异可能并不足以成为产生除草活性差异的主要原因,而从转运和分布角度来看,R-MCPP 自施用于标记叶并被吸收后,具有较高的转运比率,尤其是在标记下位的分布比率上,R-MCPP的数据体现出该对映体在拟南芥中具有更高比例的转运数值及更持久的转运能力[26-27]。在亚细胞层次的分布上,施药一定时间后,与14C-R-MCPP 相比,14C-SMCPP 在拟南芥叶肉细胞的细胞壁中占有较高的分布比率,且差异显著。而在原生质体内的细胞液和细胞器中14C-R-MCPP 的分布比率则较14C-S-MCPP 高。细胞壁和细胞膜对不同手性14C-MCPP 对映体的选择通透性差异以及2 种14C-MCPP 对映体在植物细胞中的移动能力差异可能是导致14C-MCPP 对映体在亚细胞水平分布差异的主要原因[28-29]。
本研究结果体现了拟南芥对引入的14C-R-MCPP 具有更强的吸收和运转能力,并且在叶细胞细胞器中,14CR-MCPP 具有相对较高的分布比率。激素型除草剂,包括以MCPP 为代表的苯氧羧酸类药物,主要作用于双子叶植物叶肉细胞的细胞器中(包括细胞核)与内源生长素IAA 竞争受体蛋白TIR1/AFBs 的结合位点[11-12],紊乱植物体内的激素调节,发挥除草功效。故2 种构型MCPP 与相关受体的结合能力和结合情况也是影响除草活性差异的关键,有待进一步研究探讨。
4 结论
本研究结果表明,14C-MCPP 对映体在双子叶模式植物拟南芥中的吸收、运转及亚细胞分布存在一定的差异。与14C-S-MCPP 相比,14C-R-MCPP 在拟南芥茎叶中的转运能力更强,其通过细胞壁的屏障,到达拟南芥中相应的生长激素类除草剂受体所在部位的比率也更高。结合之前已有研究报道的MCPP 对映体在双子叶阔叶杂草中的降解速率差异等相关内容,本研究从植物生理代谢角度多方面验证了R-MCPP 具有对于双子叶植物更强的除草活性,为探究不同手性苯氧羧酸类除草剂对映体除草活性的差异提供了数据支持。

