青海高原油菜蜜稳定同位素产地特征与环境响应机制研究
谭 阳 刘 志 韩 燕 崔明明 肖 明 耿贵工 孙小凤 袁玉伟
(1青海大学农林科学院/农业农村部农产品质量安全风险评估实验室,青海 西宁 810016;2 浙江省农业科学院农产品质量标准研究所/农业农村部农产品信息溯源重点实验室,浙江 杭州 310021)
蜂蜜是由蜜蜂采集植物的花蜜或蜜露,与其自身分泌物结合后,经充分酿造而成的天然甜味物质。蜂蜜被列入我国《药食同源食品目录及新资源食品名单》87 种药食同源目录中,常作为药品生产中较好的甜味剂、粘合剂、抗氧剂[1],被称为“天然抗生素”。我国是世界上蜂蜜出口量最大的国家之一,主要出口日本、美国和欧盟等国[2],这些国家对蜂蜜的进口检测指标多,且严格[3],导致一些名优产地标识蜂蜜更是供不应求,其中高原蜂蜜蜜质浓稠,活性高,营养丰富,深受消费者喜爱。研究发现,青海油菜蜜中葡萄糖和果糖等还原糖含量远高于国家要求的60%,而蔗糖含量仅为0.42%~1.96%,且淀粉酶值高,富含氨基酸、维生素和微量元素[4-5],受到了消费者的普遍青睐,具有较高的市场价格和竞争力。但近年来蜂蜜市场人为掺假及产地误标现象频发,对蜂蜜进行真实性及产地溯源技术研究变得更为迫切[6]。
蜂蜜的产地溯源与掺杂鉴别技术主要包括液相色谱-电化学检测(liquid chromatography-electrochemical detection,LC-ECD)[7]、稳定同位素分析(stable isotope analysis, SIR)[8]、近红外光谱分析(near-infrared spectral analysis, NIR)[9]、矿物元素分析(elemental analysis, EA)[10]等。其中,稳定同位素分析技术是当前国际上广泛认可的、较可靠的农产品产地溯源技术之一,已在葡萄酒[11-12]、橄榄油[13-14]、茶叶[15-16]、大米[17-18]、肉类[19-20]、奶粉[21-22]等中广泛应用。近年来,蜂蜜假冒技术不断变换,如不同植物糖浆掺杂[23]、花粉过滤和替换等,传统的依靠总体糖类或花粉稳定同位素分析的鉴别手段面临巨大挑战[24],亟需开发更为可靠、精准的蜂蜜产地溯源与鉴别策略。已有研究表明,蜂蜜内源蛋白质的稳定同位素特征值较蜂蜜总体值更稳定,且不易受人为干扰[25],如蜂蜜内源蛋白质的同位素组成不受掺杂植物糖的影响,能够较准确地反映蜂蜜的真实来源。蜂蜜中蛋白质由蜜源植物花粉颗粒和蜜蜂提供[26],是蜂蜜特有的内标物,其组成和含量与蜜源植物、季节、放蜂环境、地域等诸多因素有关[27]。Schellenberg 等[28]利用蜂蜜蛋白质稳定同位素分析技术,对欧洲20 个地区的正宗蜂蜜进行了产地溯源,对选定区域样品的分类正确率超过70%。Kropf等[29-30]利用蛋白质稳定同位素分析技术结合全反射X 荧光分析仪( total-reflection X-ray fluorescence spectroscopy,TXRF)实现了斯洛文尼亚不同自然区域(高山、地中海、迪纳拉山脉、潘诺尼亚)3 种蜂蜜的地理来源区分,其中椴树蜜的产地识别正确率达到100%,刺槐和栗树蜜识别正确率分别为98.2%和94.6%。
本研究拟采用元素分析-稳定同位素比率质谱(elementary analyzer-stable isotope ratio mass spectrometers,EA-IRMS)技术测定青海5 个不同产地(西宁市、海东市、海北州、海南州、海西州)油菜蜜内源蛋白质碳、氮、氢、氧稳定同位素比率(δ13C、δ15N、δ2H、δ18O),对比不同产地间油菜蜜内源蛋白质稳定同位素特征的差异及其随年际间气候因素(降雨)的变化规律,阐明蜂蜜内源蛋白质稳定同位素随产地环境因子变化的分馏机制及产地溯源的内在机理,以期为青海特色高原油菜蜜真实性鉴别研究提供理论依据与技术支撑,促进青海蜂蜜产业的健康发展。
1 材料与方法
1.1 材料与试剂
于2016—2018年每年的7—8月,分别从青海省西宁市、海东市、海北州、海南州、海西州5 个行政区域实地采集纯正油菜蜜样品共计71 份,每份样本至少采集500 g, 4℃冷藏密封保存。具体采样信息见表1。
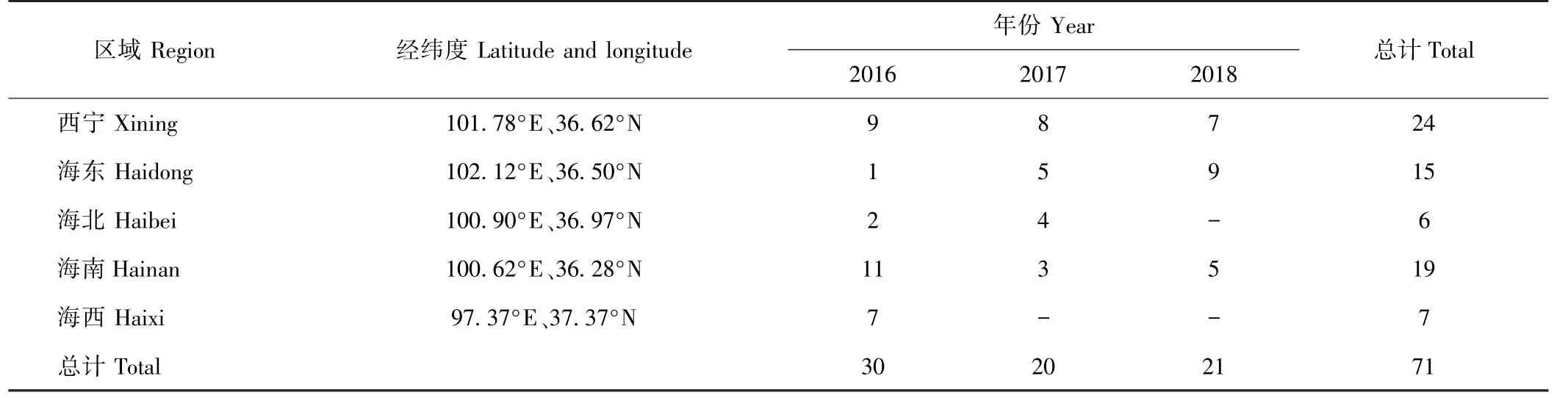
表1 油菜蜜采样区域及数量Table 1 Sampling area and quantity statistics of rapeseed honey
钨酸钠、硫酸,均为分析纯,国药集团化学试剂有限公司。国际原子能机构稳定同位素标准品:IAEACH-6(δ13C =-10.4‰);IAEA-CH-7(δ13C =-32.2‰,δ2H =-100.3‰);IAEA-600(δ13C =-27.8‰,δ15N =1.0‰);B2174(δ13C =-37.3‰,δ15N =-0.5‰);B2203(δ13C=-27.9‰,δ2H=-25.3‰,δ18O=21.0‰)。
1.2 仪器与设备
Elementarvario PYRO cube元素分析仪,德国Elementar 公司;Isoprime 100 稳定同位素比率质谱仪,英国Isoprime 公司;XP6 电子天平(精确度1 μg ~6.1 g),美国梅特勒-托利多仪器有限公司;FZG-20 冷冻干燥机,美国Labconco 公司;FW-100 万能粉碎机,天津市泰斯特仪器有限公司;FDY1001-UV-P 超纯水仪,青岛富勒姆科技有限公司;HH-M4 恒温水浴锅,上海锦屏仪器仪表有限公司;TDL-5-A 离心机,上海安亭科学仪器厂。
1.3 试验方法
1.3.1 样品处理 蜂蜜样品前处理:对于有结晶的样品,于40℃水浴中使其全部融化,搅拌均匀后冷却至室温;对于无结晶样品,直接搅拌均匀。然后准确称量1.5 mg 用于测定δ13C 值。
蜂蜜蛋白质提取:称取10 ~12 g 蜂蜜样品于50 mL离心管中,加入4 mL 纯水、2 mL 沉淀剂(10%钨酸钠溶液)和2 mL 0.335 mol.L-1硫酸溶液,混匀置于80℃水浴中加热不少于30 min,振荡观察是否有絮状物析出,含有絮状物样品以水注满离心管(若无絮状物析出则重新提取),混合后4 800 r.min-1离心5 min,弃上清液,用冷水反复洗涤沉淀物5 次,得到蜂蜜蛋白质,将蛋白质沉淀物在75℃烘箱中干燥3 h 以上,5 ~10℃密封冷藏,用于碳、氮、氢、氧稳定同位素测定。
1.3.2 碳、氮稳定同位素测定 为保证样品的IRMS检测信号响应值在2~10 nA 之内,初探试验确定了蜂蜜蛋白质粉末称样量为1.0 mg,蜂蜜称样量为1.5 mg,用锡箔杯包成方块状,一式3 份,压挤排出空气,通过120 位自动进样器进入元素分析仪中,经高温充分燃烧并充分氧化还原后,样品中碳、氮元素分别转化为纯净的CO2和N2,经稀释后进入同位素质谱仪检测。具体参数如下:元素分析仪的氧化炉和还原炉温度分别为 920 和 600℃,氦气吹扫流量为230 mL.min-1;同位素质谱检测时间设置为550 s,N2和CO2作为参考气。
1.3.3 氢、氧稳定同位素测定 称取1.0 mg 蜂蜜蛋白质粉末,用银杯包成方块,一式2 份,压挤排出空气,由自动进样器送入元素分析仪,经高温裂解,产生纯净的CO 和H2,稀释后进入同位素质谱仪进行检测。具体参数如下:氦气流量为125 mL.min-1,燃烧炉温度为1 450℃;同位素质谱检测时间设置为950 s,O2和H2作为参考气。
1.3.4 稳定同位素比率计算 由于元素重同位素自然丰度相对较低,仪器获取的重、轻同位素的比率值(R)极小。国际上通常采用将己知同位素比率的标准品作为参照,计算未知样本中稳定同位素比率的相对值。
稳定性同位素比率计算公式如下[31]:
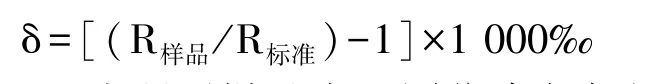
式中,R样品为所测样品中重同位素与轻同位素丰度比,即13C/12C、15N/14N、18O/16O、2H/1H;R标准为相应国际标准样品中重同位素与轻同位素丰度比,δ13C 的相对标准为V-PDB(维也纳-PeeDee 箭石标准),δ15N的相对标准为AIR(大气氮),δ18O 和δ2H 的相对标准为VSMOW(标准平均海洋水)。
1.4 数据处理
利用Microsoft Office Excel 2010 进行初步的数据整理及线性回归分析,利用SPSS 19.0 软件(IBM,USA)对测定数据进行单因素方差分析(ANOVA、LSD多重比较,显著水平设定为P<0.05)。
2 结果与分析
2.1 油菜蜜内源蛋白质中稳定同位素比率特征
71 份青海省油菜蜜样品δ13C 值范围为-27.7‰~-23.7‰,主要分布在-26.0‰~-24.0‰之间,而蜂蜜内源蛋白质的δ13C 值范围为-26.9‰~-23.2‰,主要分布在-25.0‰~-24.0‰之间(表2);这与李沈轶等[25]的研究结果一致。蜂蜜内源蛋白质的δ13C 值代表蜂蜜产地更为真实的碳循环环境,不易受蜂蜜中C4植物糖掺杂的影响,其特征值较蜂蜜中总δ13C 更稳定,更能作为产地的特征指标。此外,蜂蜜内源蛋白质δ15N 值范围为0‰~6.1‰,主要分布在0‰~2.0‰之间,δ2H 值范围为-136.8‰~-78.9‰,主要分布在-125.0‰~-95.0‰之间,δ18O值范围为9.2‰ ~17.1‰,主要分布在13.0‰~15.0‰之间。
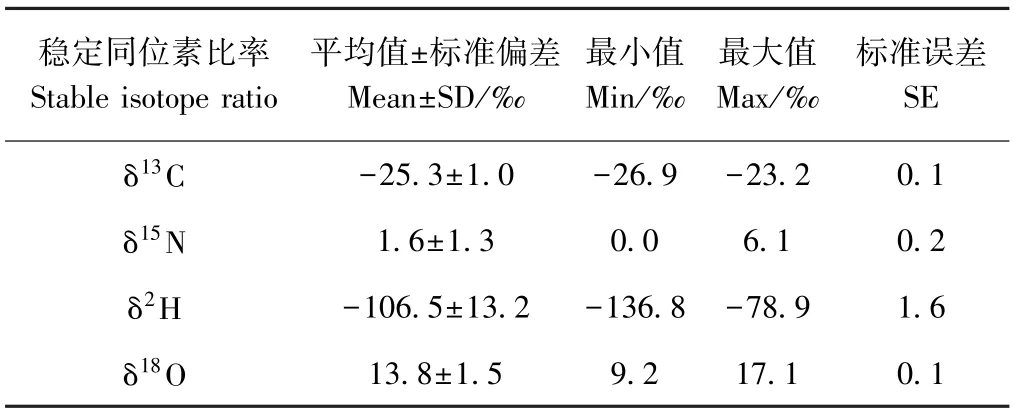
表2 青海省油菜蜜内源蛋白质中稳定同位素比值(n=71)Table 2 Stable isotope ratios of endogenous proteins in rapeseed in Qinghai province(n=71)
2.2 油菜蜜内源蛋白质稳定同位素特征年际变化
利用单因素方差分析(One-way ANOVA)方法对青海省2016—2018年油菜蜜内源蛋白质的稳定碳、氮、氢、氧同位素比率值进行年际间比较,结果如图1所示。年际间δ13C、δ15N、δ2H 值无显著差异(P>0.05),3年油菜蜜内源蛋白质的δ13C 平均值分别为-25.2‰、- 24.6‰、 - 25.1‰; δ15N平均值分别为0.9‰、1.7‰、1.2‰;δ2H 平均值分别为-107.6‰、-102.5‰、-108.6‰,且均无显著差异(P>0.05)。但其3年的δ18O 值之间存在极显著差异(P<0.01),平均值分别为14.8‰、13.8‰、12.4‰,不同年份间表现为2016年>2017年>2018年。蜂蜜内源蛋白质的δ18O值主要与蜜源植物产地环境的降水、灌溉水和地下水有关。Tomiyama 等[32]对来自不同区域的大米样品和其相应种植地块周围环境水的δ18O 进行了测定,发现二者之间存在显著相关性,证明氧同位素为产品的溯源提供了较好的地理信息。而由于不同区域的海拔、温度具有一定差异,导致环境水中氧同位素在蒸腾、冷凝及在蜜源植物利用过程中自然分馏,同位素比率发生相应变化。蜂蜜内源蛋白质中氧同位素相比于碳、氮同位素具有更大的地域差异,能够提供更为明确的地理差异特征。
2.3 油菜蜜内源蛋白质氢、氧稳定同位素特征与降雨的相关性
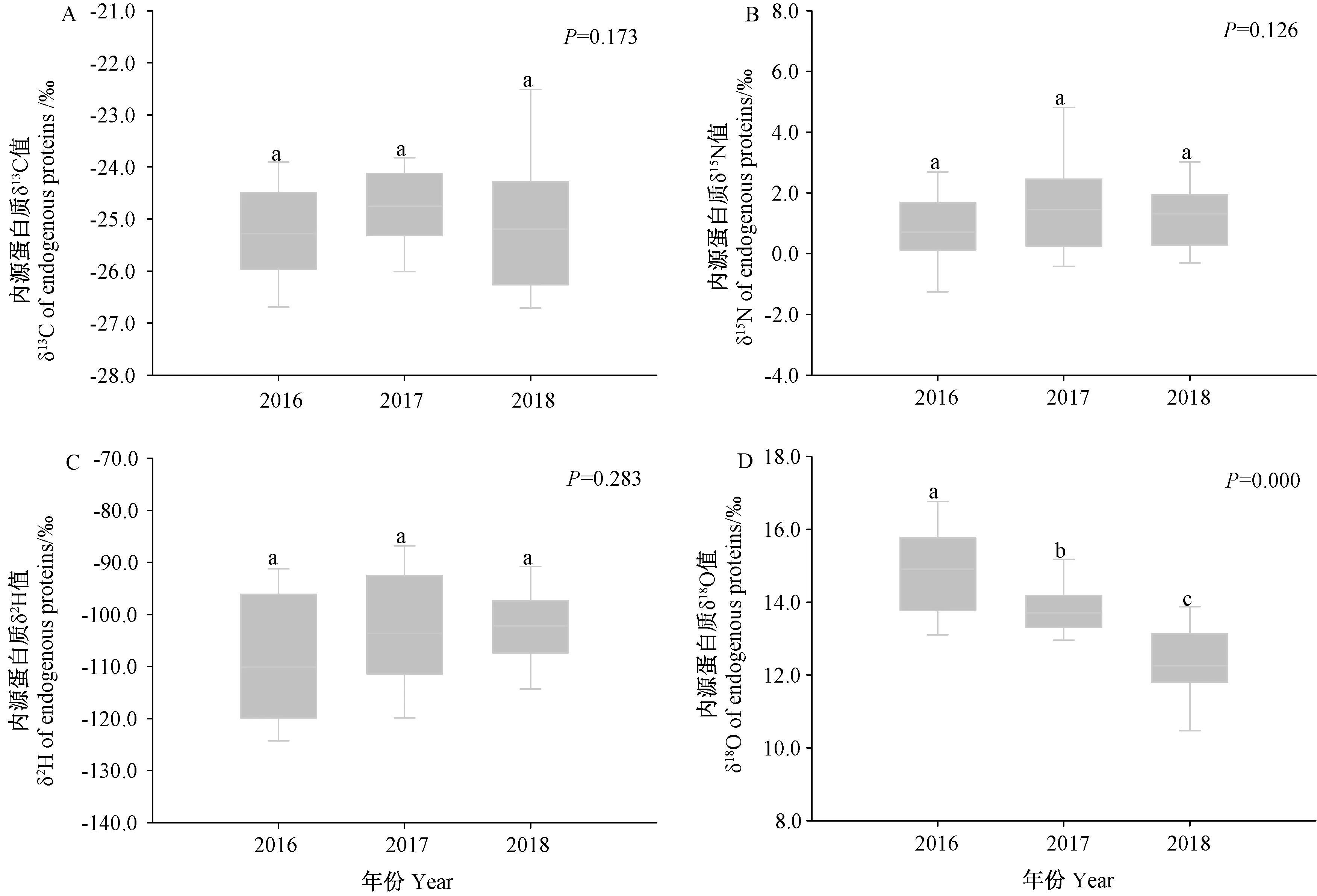
图1 青海省不同年份(2016—2018)油菜蜜内源蛋白质的碳、氮、氢、氧稳定同位素比值变化Fig.1 Variations of C、N、H、O stable isotope ratios in endogenous proteins of honey samples in Qinghai province from 2016 to 2018
蜂蜜内源蛋白质δ2H、δ18O 值和植物蜜腺中氢、氧稳定同位素密切相关,而后者往往受当地降雨情况的影响。2017年春季,受水汽环流影响,青海省出现气候异常,降雨量较往年偏多。全省主要降水过程达11次,降水量平均112.9 mm,较往年多30%[33]。2018年春季,受新疆冷空气影响,青海省降雨次数及数量大幅增加[34],大部分区域出现了长时间、大范围的降水过程。为研究蜂蜜内源蛋白质中δ18O 值与环境降水量变化的相关性,本研究从青海省农业墒情检测中心收集了2016—2018年青海省油菜蜜主要产区详细降水量数据,如图2-A 所示,2018年各区域降水量远高于往年,最高涨幅达97%,仅海北低于2017年。与2016年降水量相比,2017年海东、海南降水量较低,其他3个区域降水量均高于2016年。青海省年份间总降水量趋势为2018年>2017年>2016年,与蜂蜜内源蛋白质中δ18O 值(图1)的年际变化呈相反趋势。由图2-B、C、D 可知,各区域全年80%的降水都集中在5—9月,均在7—8月达到峰值,尤其从2016年海西的降水量曲线可以明确看出趋势,其8月降水量占当地全年降水量的45%。7—8月正是青海省油菜花盛开时节,也是采集油菜蜜的时期,因此本研究主要针对7—8月降水量数据与蜂蜜内源蛋白质δ18O 值进行相关分析。
结合2016—2018年青海省油菜蜜内源蛋白质δ18O值与降水量数据作相关性分析,纵坐标为3年油菜蜜内源蛋白质δ18O 的平均值,横坐标为3年主要采样区7—8月降水量的平均值,得到拟合方程y=-0.035 6x+17.182 0(R2=0.675 3)(图3)。经Person 相关性双变量分析,青海省油菜蜜内源蛋白质δ18O 值与降水量变化相关性为0.822,说明两者在双侧水平上显著负相关(P=0.045<0.05)。
2.4 油菜蜜内源蛋白质稳定同位素比率的地域差异
对青海省各主要产地(西宁、海南、海西、海东、海北)的蜂蜜内源蛋白质稳定同位素比值进行均值差异性分析(图4)。5 个产地样品的δ13C、δ15N 值之间无显著差异(P=0.142 和0.354,>0.05)。西宁和海东的δ13C值略高于其他区域,而δ15N 值略低于其他区域。δ13C值最低的是海南,δ15N 值最高的是海北。5 个产地样品的δ2H、δ18O 值之间存在极显著差异(P=0.001 和0.000,<0.01)。西宁样品的δ2H 值显著高于海南、海西,海西样品的δ2H 显著低于西宁、海东、海北。海西样品的δ18O 值显著高于其他4 个区域。
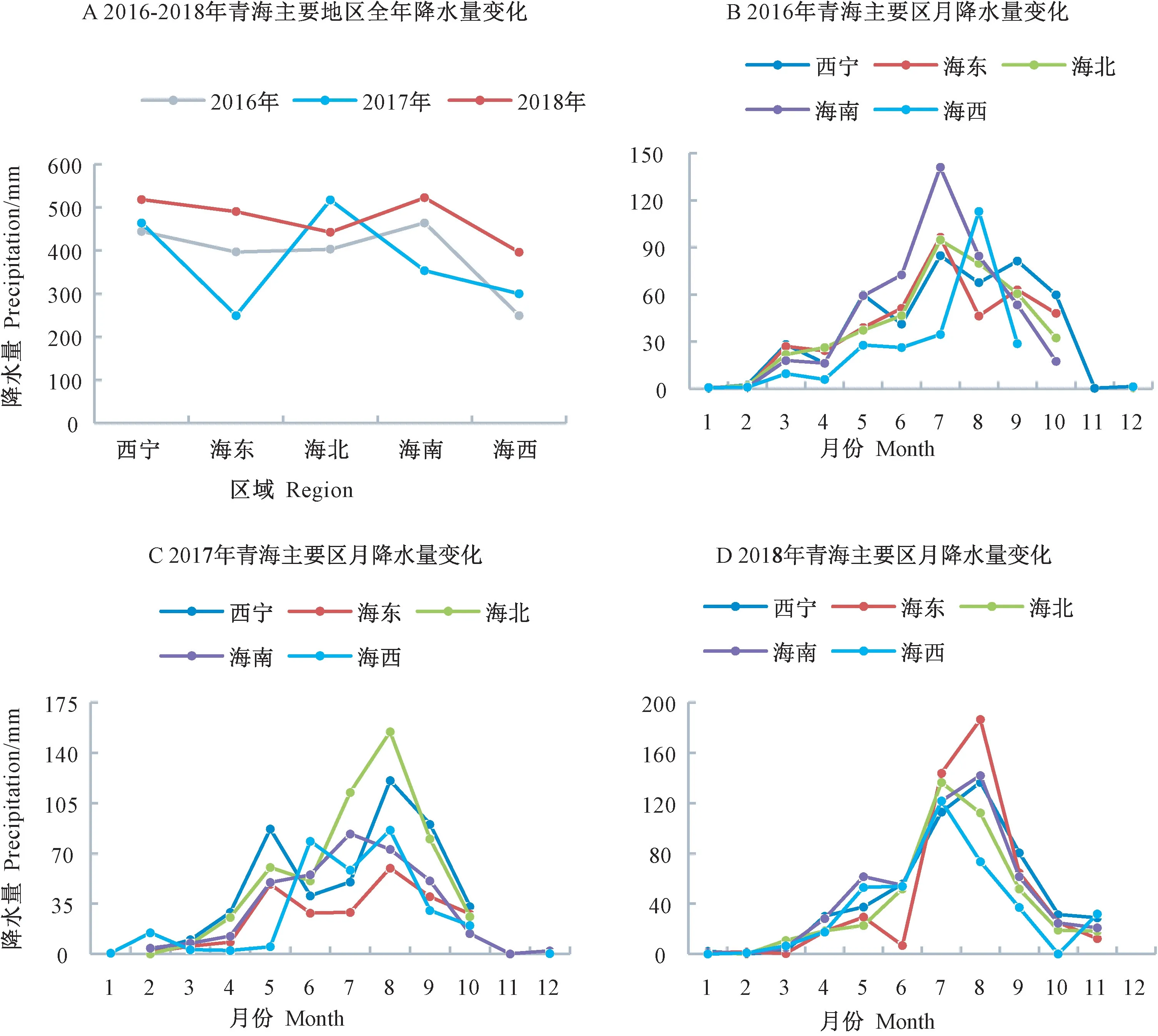
图2 2016-2018年青海省主要区域降水量变化Fig.2 Precipitation changes in major areas of Qinghai province from 2016 to 2018
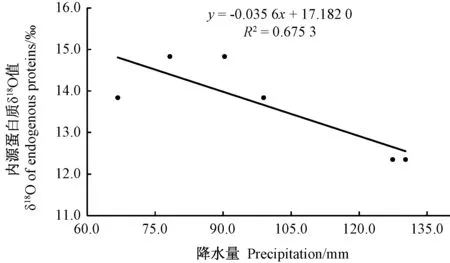
图3 青海省油菜蜜内源蛋白质δ18O值与降水量的相关性分析Fig.3 Correlation analysis between δ18O value and precipitation in Qinghai province
由图2-A 可知,2016年青海省西宁、海东、海北、海南、海西地区年降水量分别为444.1、396.7、402.8、464.2、248.9 mm,表现为海南>西宁>海北>海东>海西;2017年5 个区域年降水量分别为464.0、249.4、517.0、353.4、300.0 mm,表现为海北>西宁>海南>海西>海东;2018年5 个区域年降水量分别为518.3、490.3、442.6、522.3、396.3 mm,表现为海南>西宁>海东>海北>海西。3年间海西的年降水量均远低于5 个区域年降水量的平均值。从青海省3年降水量数据排序可知,海西降水量数据偏低,结合上文得出的油菜蜜内源蛋白质δ18O 值与降水量高度负相关的结论,降水量偏低正是造成海西蜂蜜内源蛋白质δ18O 值显著高于其他4 个区域样品的原因。
3 讨论
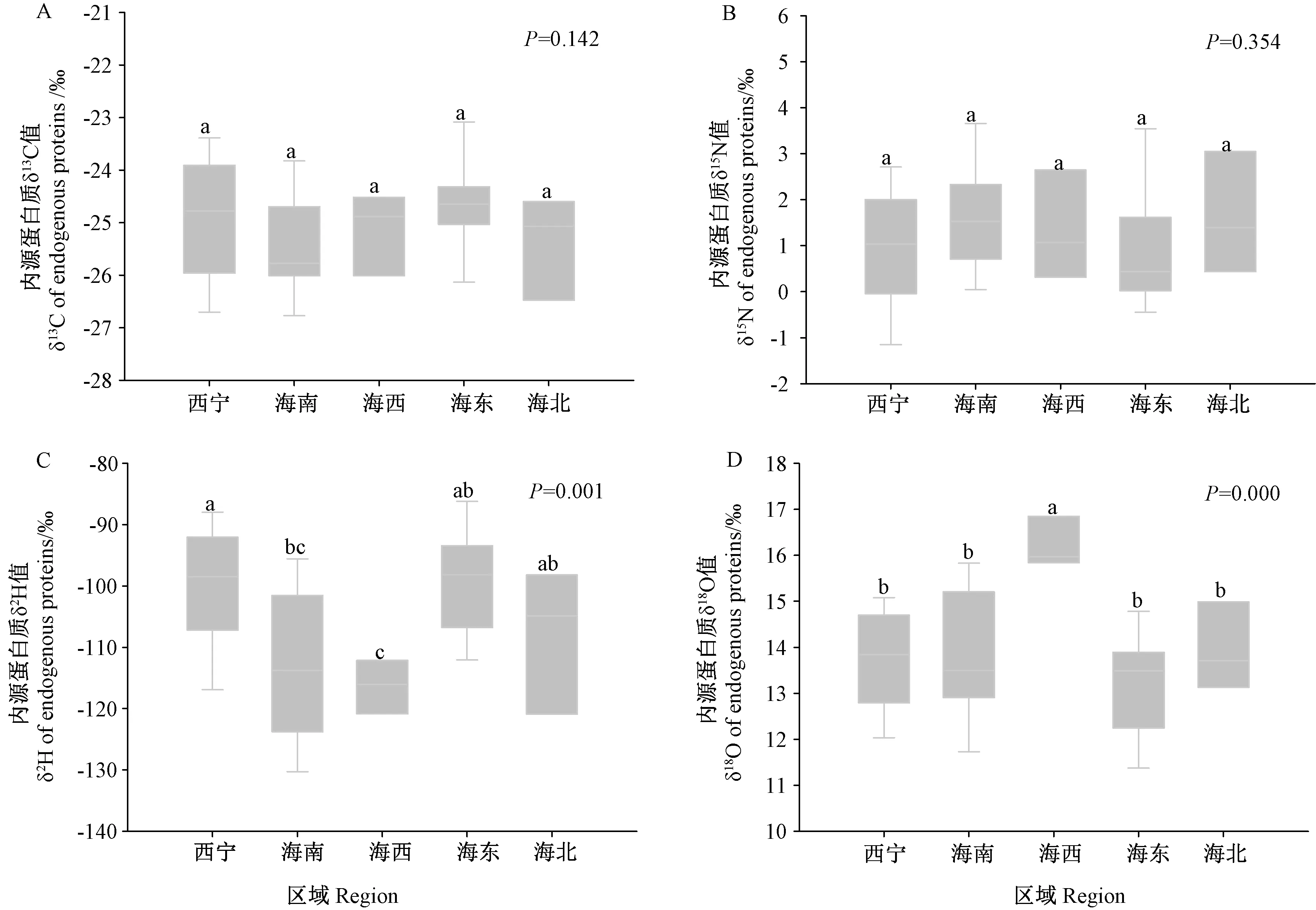
图4 青海省不同区域(西宁、海南、海西、海东、海北)油菜蜜内源蛋白质中稳定同位素比值差异Fig.4 Difference of stable isotope ratios of endogenous proteins of rape honey samples collected from different regions of Qinghai province
自然界植物组织中碳稳定同位素分馏过程受多种环境因子的共同作用,与产地气温、海拔、光照强度等息息相关。如,温度、光照通过调节植物叶片的气孔导度、光合作用酶活性等,改变胞间CO2浓度并影响光合作用代谢产物的δ13C 值[35]。此外,空气中CO2的浓度及其同位素比值也对植物及其次生代谢物的δ13C值有较大影响[36]。因此,不同产地蜜源植物碳同位素代谢的差异,能够反馈到蜂蜜中作为其产地溯源的天然指纹。本试验采集的油菜蜜样品均来自青海省内的不同产区,油菜蜜及其内源蛋白质δ13C 值的差异主要由不同区域间微气候环境差异造成。但青海省邻近的5 个区域的海拔、温度及光照强度等气候差异不足以引起蜂蜜及其内源蛋白质δ13C 值的显著差异。由此表明,青海省油菜蜜内源蛋白质的δ13C 值非常稳定,能作为其产地溯源和掺假鉴别的有效特征指标。
植物组织氮稳定同位素比值主要受农业生产过程中肥料使用情况的影响。豆科类植物在生物固氮过程中氮的同位素分馏效应较小,因此生物固定的氮与大气中δ15N 值相近。而化学合成氮肥过程中也没有发生显著的氮同位素分馏,因此合成氮肥中δ15N 值也与空气中δ15N 值接近[37]。前人研究发现,化肥中15N 的丰度波动范围小,98%的样品δ15N 值低于4‰,大多数在-2‰~2‰之间,其平均值仅为0.1‰;而有机肥制作,经过了堆沃、发酵、杀虫、灭菌等富集15N 的过程,其δ15N 值的范围波动较大,在0.2‰ ~36.2‰之间[38]。经调查,青海春油菜主产区土壤的本底有机质含量较高,施用化肥的户占比近80%[39]。根据土壤养分分级标准,土壤中全氮含量处于很丰富和丰富水平的占76%,全氮含量最低地区也属于中等水平,加之氮肥施用量逐年减少[40],青海省各产区油菜蜜内源蛋白质的氮稳定同位素比值变化范围减小,平均为1.6‰,但仍高于空气中的δ15N 值,且不同区域之间δ15N 值差异较小。因此,青海省油菜蜜内源蛋白质的δ15N 值可为其产地溯源提供真实的环境信息。
植物中的氢、氧稳定同位素比值不仅与当地降雨及农业灌溉水源的水同位素特征相关,还受植物蒸腾过程分馏作用的影响。因此,植物组织干物质及分泌物(如花蜜)中的氢、氧同位素除受水分来源的同位素比值影响外,还与蒸发、蒸腾及生物同化等过程的同位素分馏有关,分馏系数与环境因子密切相关[41]。本研究中油菜蜜内源蛋白质δ18O 值显示出了对青海不同产区蜂蜜较好的产地溯源与鉴别潜力,不同年际、不同产区的样品之间具有较大差异,且与降水量密切相关。油菜蜜内源蛋白质δ2H 值在年际间无显著差异,但在不同产区间出现了显著差异,推测油菜蜜内源蛋白质中氢的分馏在受到环境水影响的同时,还可能受到其他气候条件的交互影响,需要进一步深入研究。
4 结论
本研究采用EA-IRMS 方法测定油菜蜜总δ13C 值及其内源蛋白质δ13C、δ15N、δ2H、δ18O 值,并与油菜蜜产地、年份、降水量等因子进行相关分析。由于区域内微气候环境之间差异较小,油菜蜜内源蛋白δ13C、δ15N值在不同年份和产地间均无显著差异,油菜蜜内源蛋白δ18O 值与生产季节降水量相关性较高(R2=0.675 3), 且具有一定的地域指示性特征。但由于油菜蜜采集点较分散,空间上与降水量数据测量点存在错位,会影响研究结果的精确性。当前对植物-花蜜-动物-气候生态系统中氢、氧的内在分馏机制研究相当缺乏,因此,蜂蜜中内源蛋白质δ2H 值如何响应气候环境的变化及对产地溯源的影响还有待深入研究。

