基于发展“科学探究与创新意识”核心素养的教学设计
摘要:以“影响化学反应速率的因素”教学为例,通过重组调整硫代硫酸钠与硫酸反应的实验方案,开发CO2气体压强影响溴百里香酚蓝溶液变色快慢的创新实验,利用鲁米诺反应发出荧光增强H2O2的催化分解实验现象的效果,来探究温度与浓度、气体压强、催化剂诸因素对化学反应速率的影响。在教学中灵活处理教材,调整实验方案,开发创新实验,增强实验效果,促使学生的化学学科能力得到提升,核心素养得到发展。
关键词:创新实验;反应速率;溴百里香酚蓝;鲁米诺荧光反应
文章编号:1008-0546(2021)10-0056-04中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2021.10.013
*本文系浙江省2020年度教研规划课题“基于深度学习理念的高中化学微主题式教学的实践研究”阶段性成果,课题编号:G2020136。
一、问题的提出
苏教版选修教材《化学反应原理》采用碳酸氢钠与盐酸、酸性高锰酸钾氧化草酸、过氧化氢催化分解三个反应[1],来研究浓度、温度、催化剂对反应速率的影响,而压强对反应速率的影响只是给出理论解释,未施以实验进行探究。这些实验都是学生比较熟悉的反应,实验现象也是明显直观,但这也造成了实验本身的性质由探究性转化为了验证性,不利于学生探究意识与创新精神的培养。在教学中,我们倡导要“用教材教,而不是教教材”,要灵活应用教材实验,科学调整实验方案,合理开发实验资源,增强实验现象效果,提高学生学习化学的兴趣,提升学生化学的学科能力,侧重发展学生“科学探究与创新意识”的核心素养。
二、设计策略与流程
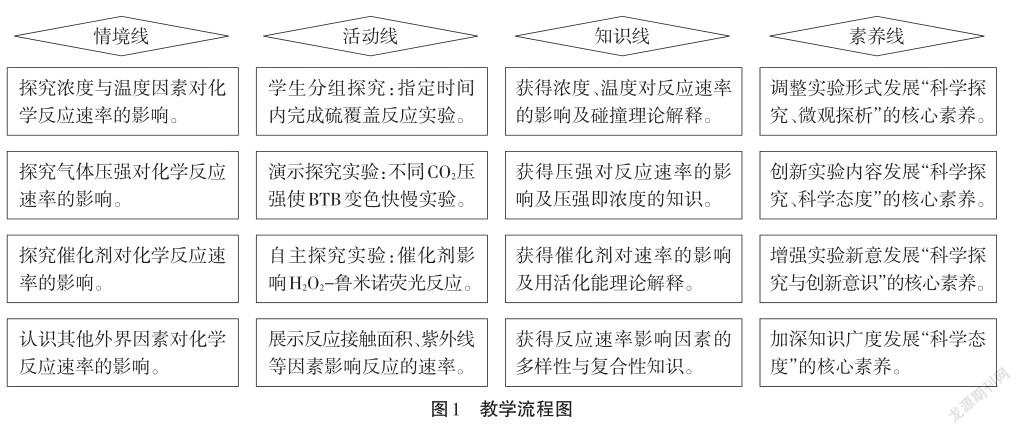
化学实验不仅是研究和学习物质变化的基本方法,同时也是探究化学规律和化学理论的重要手段。2017版《课程标准》也建议:“教学中应注重运用实验事实、数据等证据素材,帮助学生转变偏差认识”[2]。因此“影响化学反应速率的因素”一课的教学设计,立求在核心素养导向下,立足于在学生的最近发展区,以实验探究为项目主题,调整教材中的已有实验,结合新开发的创新实验,增强原实验的视觉效果,通过学生参与设计,主动操作,亲身体验,享受科学探究的过程,充分调动学生的思维,使其成为知识的主动建构者,设计融合“教、学、评一体化”的“情境线”“活动线”“知识线”和“素养线”的教学流程(见图1)。以项目学习为导向,让学生在多个实验的探究过程中汲取化学核心知识,体验和感悟科学研究的乐趣与艰辛,侧重促进学生的“科学探究与创新意识”核心素养发展,同时在“微观探析、科学态度”等核心素养方面也得到较好发展。
本教学设计通过重组调整硫代硫酸钠与硫酸反应的实验形式,开发CO2压强变化影响BTB(溴百里香酚蓝)试剂变色快慢的创新实验,利用鲁米诺荧光反应增强H2O2催化分解实验现象的效果,并辅以“碰撞理论”解释影响化学反应速率的各个因素。学生在实验过程中更好地认识这些化学规律和理论,获得认识上和思维上的双重发展。
三、教学过程与意图
1.项目一:重组实验、把控反应——浓度与温度的影响
【课前准备】
1个装有10mL 0.1mol·L-1的Na2S2O3溶液的50mL锥形瓶;
1个装入10mL 0.1mol·L-1的H2SO4溶液的中号试管;
1张正中间画有一个合适大小“田”字的16开白纸。
【演示实验】把锥形瓶置于白纸的“田”字上方,将试管中的溶液倒入到锥形瓶中,轻轻振荡后置于白纸上,观察实验过程中逐渐产生的淡黄色物质,记录完全覆盖“田”字所需的精确时间。
实验记录:202X年X月X日,本地室内温度X℃,本反应所需时间为X分X秒。
【讲解】同学们,这个实验是我们教材《实验化学》专题4中的一个实验,它是研究化学反应速率的一个实验。
【PPT展示】《实验化学》:专题4课题1硫代硫酸钠与酸反应速率的影响因素
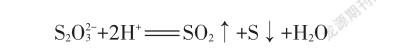
【讲解】我们知道,对于特定的反应,除了反应物的性质外,反应物的浓度,体系的温度、压强和催化剂等都会对化学反应速率有影响。下面大家通过分组,一起来个探究实验比赛。大家先根据刚才的演示实验,讨论设计本小组的实验方案,三个试剂的总量为20mL,列出欲用的反应物的用量(即浓度)与采用反应的温度,来尽量控制反应完全覆盖“田”字时间为2分钟,哪一组最接近2分钟就胜出。
【学生活动】小组内讨论,设计方案,并按设计方案准备实验。交流汇报各小组的具体方案,然后同时开始操作实验。各组记录如表1所示。
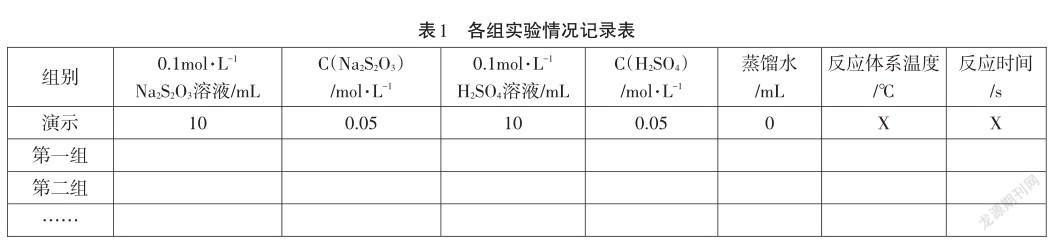
【小结】X小组采用XmL的0.1mol·L-1Na2S2O3溶液与XmL的0.1mol·L-1H2SO4溶液,调和XmL的蒸馏水,在X℃下进行反应,时间为X分X秒,最接近2分钟的一组。其他小组也来交流一下,没有接近2分钟的具体原因。
【学生活动】交流分析小组实验时间不为2分钟的原因。
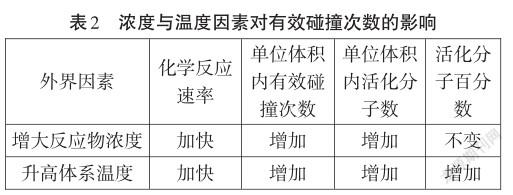
【讲解】经过大家的实验数据表明,反应物的浓度越大,反应体系的温度越高,反应所需的时间就越短,即反应的速率就越快。为什么增大反应物的浓度,升高反应体系的温度可以加快化學反应的速率呢,下面我们用“碰撞理论”从微观上来探析一下原因。
【学生活动】阅读并领会教材“碰撞理论”内容。
【小结】我们可以从单位体积内的“有效碰撞次数”和“活化分子数”两方面来解释浓度、温度影响反应速率的原因,同时还可以从“活化分子百分数”来解释两因素影响化学速率的不同点(如表2)。
设计意图:实验探究的创新不仅是设计新的实验,也可以是通过对原有教材实验方案的调整和重组。要求学生通过小组讨论、方案设计、实验探究、交流分析,把控反应在限定时间内完成,这样的教材实验方案重排,调动了学生自觉地应用和感悟化学理论,充分地认识浓度与温度这两个外界条件对反应速率的影响,内化了知识。辅以讨论“碰撞理论”来解释速率变化的本质原因,不仅发展了学生“科学探究”的核心素养,还发展了“微观探析”的核心素养。
2.项目二:创新实验、本质探究——压强的影响
【PPT展示】指示剂:溴百里香酚蓝
【实物展示】如图2。

【讲解】溴百里香酚蓝是生物学中研究微生物呼吸作用的指示剂,它的变色范围为pH值6.0~7.6,正好接近碳酸的酸度范围,它在碱性时呈蓝色,酸性时呈黄色,过渡态时呈绿色(见图2)。我们利用这个指示剂,间接显示不同的CO2压强下与水反应生成的碳酸含量(浓度)[3]。
【PPT展示】CO2(g)+H2O(l)H2CO3(aq)
【提问】我们可以通过什么来判断这个反应进行的快慢呢?
【作答】通过指示剂颜色从蓝色经过绿色变化到黄色所需的时间长短来判断反应的快慢,所需要时间越短,反应的速率越快。
【讲解】pH减小使指示剂变成黄色,说明溶液中的碳酸浓度上升到了一个特定的值,如果所需的时间越短,說明碳酸产生的速率越快。下面我们给出下列仪器,请同学们利用这个原理来设计CO2气体压强对反应速率的影响实验。
【PPT展示】实验仪器:烧瓶,注射器
实验药品:溴百里香酚蓝试剂,CO2气体
【交流并作答】将不同量的CO2气体注射到装有溴百里香酚蓝试剂的烧瓶中,观察颜色变化的快慢。
【讲解】不同量的CO2进入到同一容积的烧瓶中,产生的压强就会不同。我们控制合理的反应物的用量,来看一下不同CO2气体压强下的哪一个颜色会变化得更快一些。
【学生活动】操作实验,对比颜色变化快慢。
【讲解】经过大家的对比发现,CO2气体的压强越大,颜色变化就越快,即反应的速率就越快。为什么增大CO2气体压强可以加快化学反应的速率呢。
【学生活动】阅读教材内容,领会压强变化的本质原因。
【小结】我们发现其实压强变化实质是改变了单位体积内的分子数,其本质是改变了反应物的浓度。我们从“碰撞理论”角度上来探析一下压强与浓度变化的微观差异。我们再来探析一下如果是充入稀有气体使压强增大,会不会使反应速率加快。如表3。
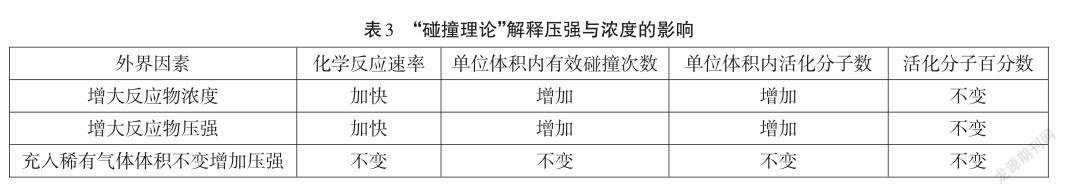
设计意图:创新课堂演示实验,弥补教材实验空缺,使得原来只有抽象理论的内容显现为直观的实验现象,这样的设计不仅增加了化学理论的说服力,而且还发展了学生“科学探究与创新意识”的核心素养。同时采用生物学研究中的微生物呼吸作用专用指示剂,实现了学科之间的知识互补,使学生跨学科研究的“科学态度”核心素养得到发展。
3.项目三:绚丽荧光、探求原理——催化剂的影响
【课前准备】配制鲁米诺试剂(取一个1L的烧杯,将4.0g的无水碳酸钠置于烧杯中,加入500mL蒸馏水用磁力搅拌器加速溶解,称取0.2g鲁米诺粉末于烧杯中,继续搅拌溶解,再称取24.0g碳酸氢钠,0.5g碳酸氢铵,20滴浓氨水,逐次加入到烧杯中,用磁力搅拌数分钟,待粉末全部溶解后加入蒸馏水稀释至1000mL,继续搅拌均匀,然后装入试剂瓶中备用[4]),配制1:40的H2O2稀释溶液。
【PPT展示】鲁米诺又名发光氨,在碱性条件下遇H2O2分解释放的氧气会发出蓝色荧光。
【演示实验】在锥形瓶中加入50毫升的鲁米诺试剂,再倒入50毫升的H2O2稀释液。
【学生活动】观察实验现象。
【讲解】没有看到强烈的荧光,是因为H2O2的分解反应是一个慢反应。我们加入一些硫酸铜溶液试试。
【演示实验】在锥形瓶中滴入几滴硫酸铜稀溶液,振荡摇匀锥形瓶立即产生强烈的蓝色荧光,持续数分钟左右(如图3)。

【提问】加入的硫酸铜起到了什么作用?
【作答】催化剂作用,加快H2O2分解产生氧气。
【讲解】催化剂可以加快化学反应速率,抑制剂可以减缓化学反应速率。下面我们从能量和微观的双重角度来探析一下使用催化剂是如何加快反应速率的。
【学生活动】阅读并交流“过渡态理论”“活化能”变化。
【讲解】加入催化剂使反应的“活化能”降低,我们再从“碰撞理论”来探析一下。板书见表4。

【提问】大家可能发现,从“碰撞理论”上来说,升高温度与加入催化剂有相似的地方,那它们的区别在哪儿呢?
【作答】升高温度是分子的能量增大,而加入催化剂是降低了“活化能”,并没有增大分子的能量。
【讲解】加入催化剂没有增加分子的能量,它只是通过改变反应途径(反应历程),到达“过渡态”,然后再反应,这样子就降低了成为“活化分子”的标准,使得更多的分子成为“活化分子”,从而增加了有效碰撞,加快了反应速率。
设计意图:应用鲁米诺试剂的荧光反应显示H2O2分解反应,拓展了化学知识广度,延伸了H2O2分解的应用,以此来代替原本的观察气泡速率,不仅增强了催化实验的视觉效果,增添了教材实验现象的直观性和趣味性,还使学生在实验过程中探索并领会实验所蕴含的化学原理,提升了化学学科能力和发展“科学探究与创新意识”的核心素养。
4.项目四:拓展广度、全面考量——其他因素的影响
【视频】电视剧《伪装者》面粉工厂爆炸
【讲解】化学反应速率除了受到内因——反应物本身的性质和常见外因——浓度、温度、压强、催化剂的影响外,还有一些其他的外界影响因素也能改变反应的速率,比如反应物间的接触面积。
上述视频中,由于细小的面粉颗粒与空气有了更大的接触面积,遇明火即发生了爆炸,所以面粉厂是严禁烟火的。我们在接触法制硫酸时,讲到黄铁矿要粉碎后进入沸腾炉里焚烧,以及吸收塔内要填充大量的瓷环,这也都是为了增大反应的接触面积。此外,某些反应还会受到光、电磁波、超声波等外界因素的影响。
在生产或生活中的反应,往往是多个因素复合起来对某个反应发挥影响作用。
设计意图:结合STS教育,拓展生活生产中的化学常识,全面考量反应速率的影响因素,体会反应速率影响因素的多样性与复合性,帮助学生构建更为科学、更为完善的知识体系,发展学生的“科学态度”的核心素养。
四、课后反思与感悟
实验探究是化学研究最重要的方法,它是学生感性认识抽象理论的最好途径,针对反应速率的影响因素内容,结合学生的认知水平,调整重排实验,开发创新实验,强化实验效果,激发学生的兴趣,让学生在探究中自主学习、在探究中获得知识、在探究中培养能力。
新一轮课程改革倡导“用教材教”,这就唤醒我们一线教师的教学活动要从“目标意识”转向“资源意识”,课堂教学的科学性重在“实”[5],教材中的实验素材并非唯一的教学资源,只是引导我们教学活动的一个线索,在实际的教学中,我们可以根据学生的具体学情,灵活地调整重排、开发创新、改进强化教学实验,从而达成教学目标,提升学科能力,发展核心素养。
参考文献
[1]王祖浩.化学反应原理(选修)[M].南京:江苏教育出版社,2014:35-38
[2]中华人民共和国教育部.普通高中化学课程标准[S].北京:人民教育出版社,2018:19
[3]顾仲良,周学工.压强对反应速率的影响实验探索——应用溴百里香酚蓝的色變[J].化学教与学,2020(4):93-95,72
[4]魏冰.介绍一种发光的氨喷泉实验[J].化学教育,1992(1):34-35
[5]张宁云.化学与艺术的跨科统整——“铁化合物的相互转化”STEAM设计[J].化学教与学,2019(12):22-25

