肺神经内分泌肿瘤的CT 与18F-FDG PET/CT显像特征的分析
樊建坤 王腾 杨瀚 唐光才 江国豪
1 四川省简阳市人民医院放射科 641400;2 西南医科大学附属医院放射科,四川省泸州市 646000;3 西南医科大学附属医院核医学科,四川省泸州市 646000
肺神经内分泌肿瘤(pulmonary neuroendocrine tumors,PNETs)约占原发性肺癌的25%,其在神经内分泌肿瘤中的发病率仅次于胃肠道内分泌肿瘤[1]。PNETs 起源于支气管黏膜的神经内分泌细胞,能够产生并分泌胺类和多肽激素[2]。2015 年,WHO 在肺肿瘤的新分类中,将PNETs 分为4 种亚型:典型类癌(typical carcinoid,TC)、不典型类癌(atypical carcinoid,AC)、大细胞神经内分泌癌(large cell neuroendocrine carcinoma,LCNEC)和小细胞肺癌(small cell lung carcinoma,SCLC)[3]。PNETs 亚型的治疗方法和预后各有不同,因此早期准确诊断尤为重要。相较于其他影像学检查方法,18F-FDG PET/CT 检测肿瘤及转移灶具有显著的优势,可以根据SUVmax对肿瘤的良恶性作出初步诊断,增强CT 与高分辨率CT(high resolution CT,HRCT)对肿瘤的内部细节、血液供应及周围组织侵犯等情况显示良好。以往的研究一般以单纯CT 或PET/CT 为主[4-5],将PET/CT 和CT(包括增强CT 和HRCT)同时纳入的研究较少,故本研究回顾性分析44 例经组织病理学检查证实的PNETs患者的临床资料和CT、PET/CT 影像学资料,探讨PNETs 的CT 与PET/CT 影像学特征,比较单纯PET/CT 与基于PET/CT 联合增强CT 及HRCT 的多模态显像的诊断准确率,旨在进一步提高临床医师对PNETs 的认知和诊断水平。
1 资料与方法
1.1 一般资料
回顾性分析2010 年1 月至2019 年5 月于西南医科大学附属医院就诊并经组织病理学检查确诊为PNETs 的44 例患者的临床资料和CT、PET/CT影像学资料。纳入标准:(1)经组织病理学检查确诊为PNETs;(2)初始诊断时未进行任何治疗,包括放化疗和手术;(3)CT 和PET/CT 影像学资料完整、图像清晰。排除标准:(1)有肺部手术史;(2)有其他恶性肿瘤病史。44 例PNETs 患者中,男性34 例、女性10 例,年龄14~78(57.3±10.0)岁,其中吸烟者30 例,均为男性。患者就诊时临床表现主要为咳嗽、咯血、呼吸困难、胸闷和胸痛等,其中5 例无症状,因体检或行其他系统疾病检查时偶然发现。根据组织病理学分型将PNETs 患者分组如下:TC 组(5 例)、AC 组(3 例)、LCNEC 组(15例)、SCLC 组(21 例),由于TC、AC 组病例数较少,因此将2 组归为类癌组进行分析。
所有患者在检查前均签署了知情同意书。本研究已获得西南医科大学附属医院伦理学委员会的批准(批准号:KY2021004)。
1.2 图像采集及处理
增强CT 使用荷兰Philips 公司的Brilliance 256层iCT,HRCT 使用美国GE 公司的64 排128 层螺旋CT,PET/CT 使用荷兰Philips 公司的GEMINI TF/16 PET/CT 显像仪。18F-FDG 由德国Siemens 公司 cclipsc HP/RD 型回旋加速器及自动合成模块合成(北京派特公司FDG-N 型),放射化学纯度>95%。PET/CT 扫描参数:管电压120 kV、管电流150 mA、矩阵512×512,患者检查前空腹6~8 h,血糖控制在7.0 mmol/L 以下,静脉注射18F-FDG,剂量为3.7~5.5 MBq/kg,注射后患者取仰卧位,扫描范围从肺尖至肺底。增强CT 和HRCT 的扫描参数:管电压120 kV、管电流150 mA、层厚1.0 mm、间隔1.0 mm,增强CT 扫描的对比剂采用碘伏醇,使用高压注射器经肘静脉注射,对比剂浓度300 mg/mL,剂量1.5 mL/kg,注射速度3~4 mL/s,患者分别于注入对比剂30、60 s 后行动脉期、静脉期CT 扫描,扫描时嘱其屏气。扫描结束后将1.0 mm 层厚图像传至工作站进行多平面重建,对病变及邻近结构的CT 征象进行分析。44 例患者均行PET/CT 及HRCT 检查;除3 例患者(类癌1 例、LCNEC 1 例、SCLC 1 例)外,余41 例患者均行增强CT 扫描。
1.3 图像分析
所有患者的图像均由2 名具有5 年以上工作经验的影像诊断医师共同阅片,意见有分歧时,由二人协商决定。测量、统计并分析CT 与PET/CT 表现,包括SUVmax、肿瘤部位、肿瘤最大径、密度、强化程度以及有无毛刺征、分叶征、支气管和(或)周围血管受侵、阻塞性肺炎和(或)肺不张、胸膜增厚、肺门和(或)纵隔淋巴结转移、远处转移等。以组织病理学检查结果为“金标准”,比较单纯PET/CT与基于PET/CT 联合增强CT 及HRCT 的多模态显像诊断的准确率。
1.4 统计学分析
应用SPSS 25.0 软件对数据进行统计学分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,两组间比较采用最小显著差异(LSD)法。计数资料用频数表示,组间比较采用χ2检验和Fisher 确切概率法。采用ROC 曲线分析SUVmax的诊断效能,计算AUC,确定诊断临界值。P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料的分析
由表1 可知,类癌组患者的发病年龄低于LCNEC组与SCLC 组患者,且差异有统计学意义(P=0.004);在性别、吸烟史等方面与LCNEC 组和SCLC 组患者的差异均无统计学意义(均P>0.05)。
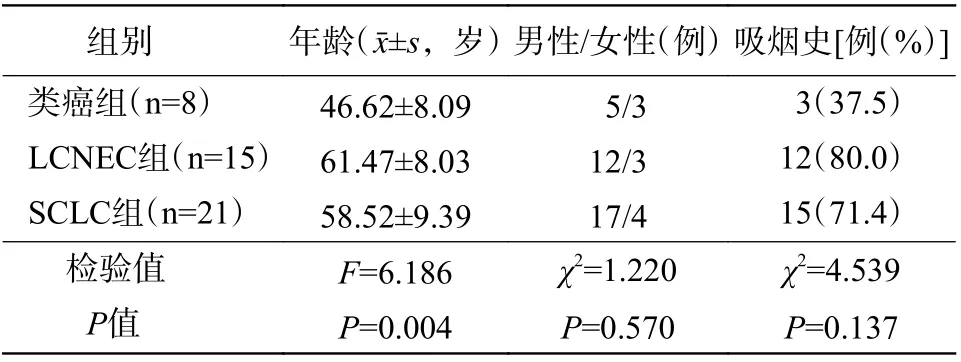
表1 44 例肺神经内分泌肿瘤患者临床资料的比较Table 1 Comparison of clinical data of 44 patients with pulmonary neuroendocrine tumor
2.2 不同组织病理学分型的PNETs 的影像学表现
2.2.1 肿瘤部位
LCNEC 组患者中有12 例为周围型,而类癌组患者和SCLC 组患者以中央型多见,分别为6 例和14 例,组间差异有统计学意义(χ2=9.662,P=0.010)。
2.2.2 形态及边缘特征
类癌组患者的病灶形态规则,多数(5/8)呈圆形和类圆形(图1);LCNEC 组和SCLC 组患者的病灶形态多不规则。LCNEC 组中11 例患者的病灶可见分叶征(图2),与类癌组和SCLC 组比较,差异有统计学意义(χ2=9.457,P=0.011)(表2)。

图1 中央型典型类癌患者(女性,14 岁)的CT 与18F-FDG PET/CT 显像图 A 为HRCT,示左肺上叶支气管开口处软组织密度结节(箭头所示),左肺体积缩小,左肺上叶不张;B 为增强CT,示肿块明显强化(箭头所示);C 为18F-FDG PET/CT,示18F-FDG 代谢轻度增高(箭头所示)。CT 为计算机体层摄影术;FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;HRCT 为高分辨率CTFigure 1 CT (A、B) and 18F-FDG PET/CT (C) images of patient with central typical carcinoid (female, 14 years old)
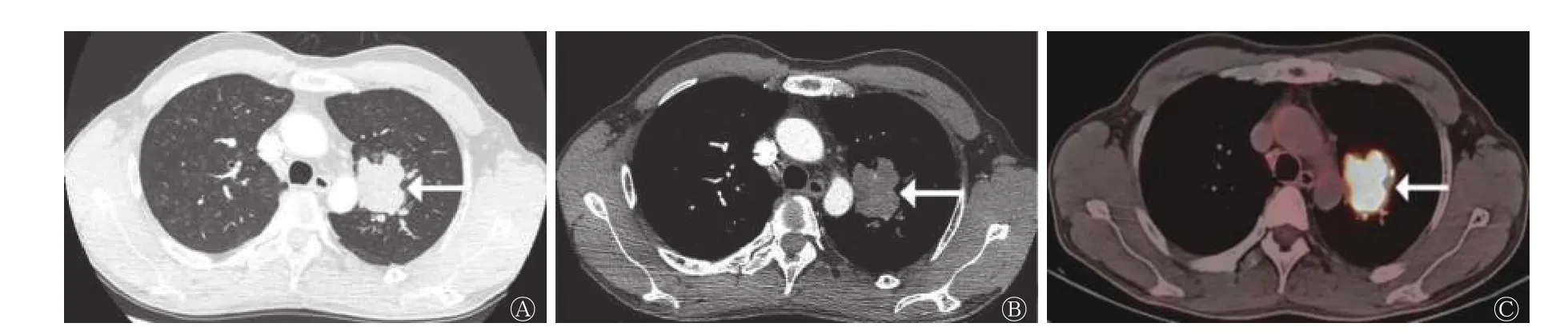
图2 周围型大细胞神经内分泌癌患者(男性,64 岁)的CT 与18F-FDG PET/CT 显像图 A 为HRCT,示左肺上叶分叶状肿块(箭头所示),边界清晰,边缘光滑;B 为增强CT,示肿块轻度强化(箭头所示);C 为18F-FDG PET/CT,示18F-FDG 代谢明显增高(箭头所示)。CT 为计算机体层摄影术;FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;HRCT 为高分辨率CTFigure 2 CT (A、B) and 18F-FDG PET/CT (C) images of patient with peripheral large cell neuroendocrine carcinoma (male, 64 years old)
2.2.3 内部特征
由表2 可知,类癌组患者的病灶密度较均匀,3 例患者的病灶伴有坏死、囊变,1 例患者的病灶内出现少许点状钙化灶。LCNEC 组与SCLC 组患者的病灶密度多不均匀,6 例患者的病灶内出现斑点状钙化灶(LCNEC 组2 例、SCLC 组4 例),LCNEC 组和SCLC 组有26 例患者的病灶内出现坏死、囊变区。3 组间患者病灶内的钙化和坏死率的差异均无统计学意义(均P>0.05)。41 例行增强CT 扫描的患者中,4 例类癌患者明显强化、3 例类癌患者中度强化,11 例LCNEC 患者轻-中度强化、3 例LCNEC 患者明显强化,13 例SCLC 患者明显强化、7 例SCLC 患者轻-中度强化,3 组间强化程度的差异无统计学意义(P=0.065)(表2)。
2.2.4 阻塞征象
类癌组和SCLC 组中合并阻塞性肺炎和(或)肺不张的患者分别为7 例和11 例,而LCNEC 组中仅3 例,3 组间的差异有统计学意义(χ2=9.877,P=0.006)(表2)。
2.2.5 血管侵犯
行增强CT 扫描的41 例患者中,CT 图像显示周围血管侵犯19 例,其中SCLC 组13 例(图3)、LCNEC 组6 例,类癌组患者无周围血管侵犯,3组间差异有统计学意义(χ2=8.913,P=0.009)(表2)。
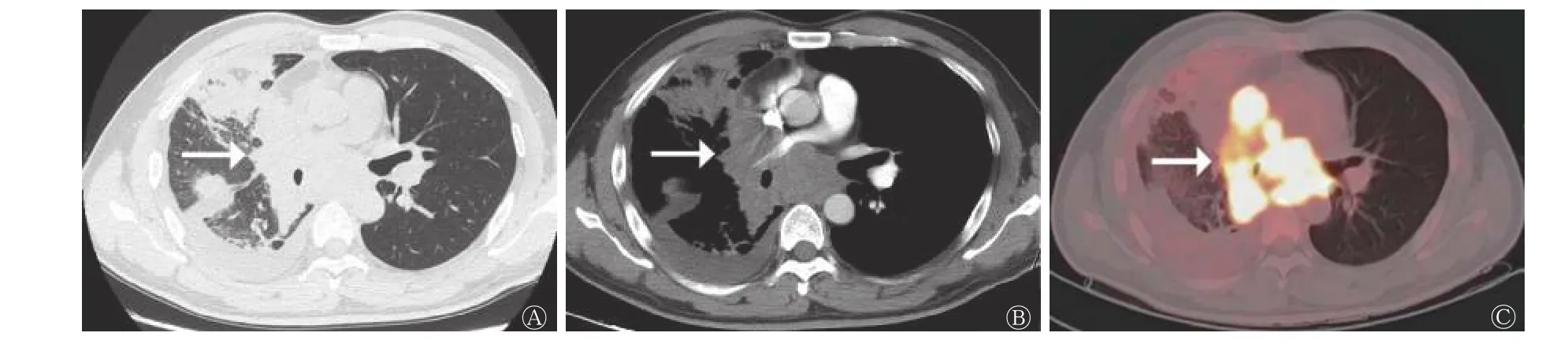
图3 中央型小细胞肺癌患者(男性,41 岁)的CT 与18F-FDG PET/CT 显像图 A 为HRCT,示右肺门不规则肿块伴右肺阻塞性肺炎(箭头所示);B 为增强CT,示肿块不均匀强化,右肺动脉、上腔静脉受侵(箭头所示);C 为18F-FDG PET/CT 的肺窗图,示肿块与纵隔和肺门肿大淋巴结分界不清,18F-FDG 代谢显著增高(箭头所示)。CT 为计算机体层摄影术;FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;HRCT 为高分辨率CTFigure 3 CT (A、B) and 18F-FDG PET/CT (C) images of patient with central small cell lung carcinoma (male, 41 years old)
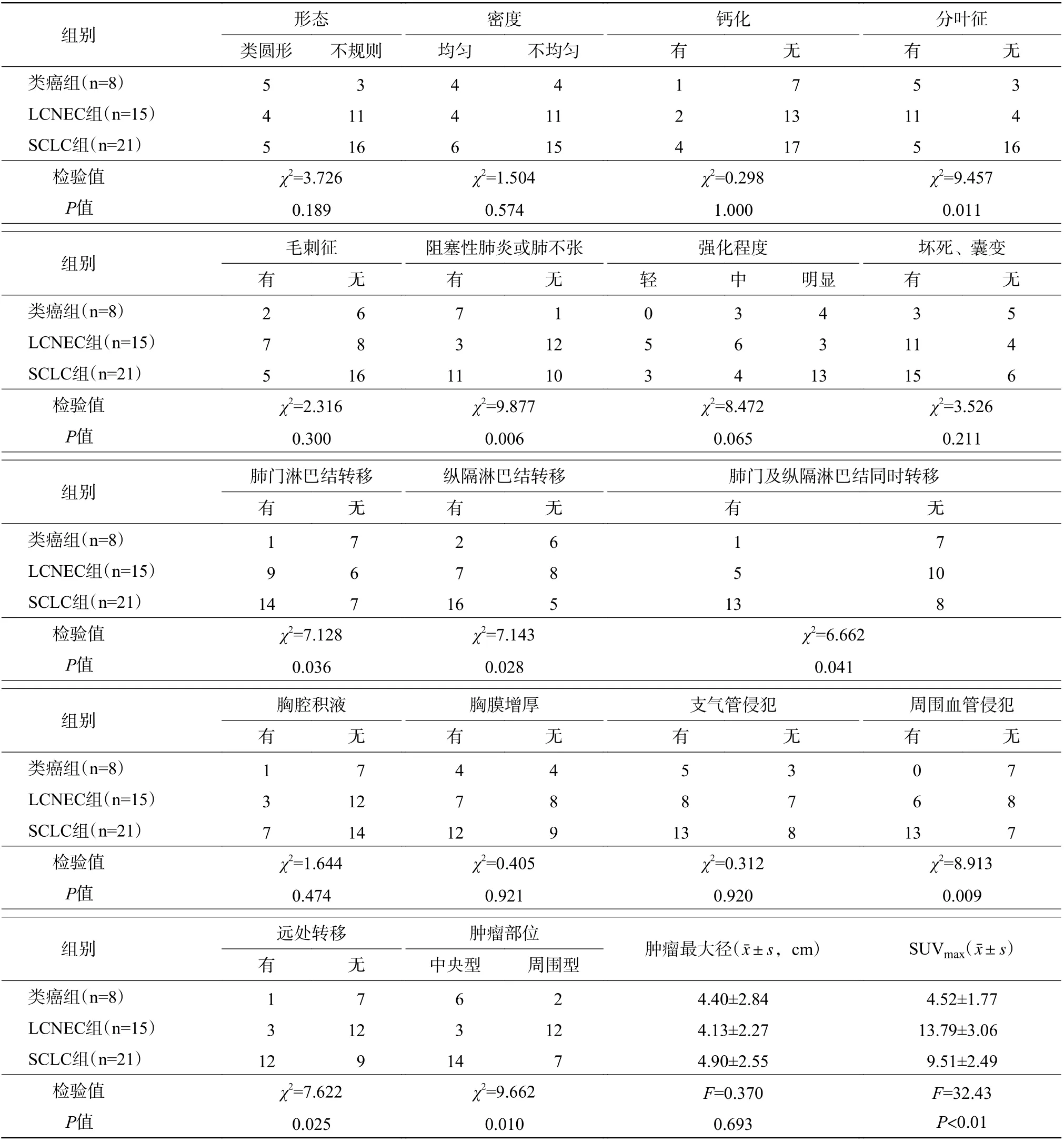
表2 44 例肺神经内分泌肿瘤患者CT 与18F-FDG PET/CT 的显像特征(例)Table 2 Imaging features of CT and 18F-FDG PET/CT in 44 patients with pulmonary neuroendocrine tumor (case)
2.2.6 转移征象
由表2 可知,出现肺门淋巴结转移、纵隔淋巴结转移、肺门及纵隔淋巴结同时转移的患者分别为24 例、25 例和19 例,且类癌组、LCNEC 组和SCLC 组3 组间的差异均有统计学意义(均P<0.05)。对类癌组、LCNEC 组和SCLC 组患者分别在肺门淋巴结转移、纵隔淋巴结转移、肺门及纵隔淋巴结同时转移方面进行两两比较,结果显示,仅SCLC组与类癌组的差异有统计学意义(χ2=6.807、6.448、5.663,均P<0.05),而LCNEC 组与SCLC、类癌组的差异均无统计学意义(χ2=0.167~3.306,均P>0.05)。远处转移患者共16 例,3 组间的差异有统计学意义(P=0.025)(表2)。对远处转移情况进行两两比较,结果显示,SCLC 组与类癌组、LCNEC组的差异均有统计学意义(χ2=4.668、4.967,均P<0.05)(表2)。
2.2.7 其他征象
由表2 可知,3 组患者在肿瘤最大径、密度、强化程度、有无毛刺征、支气管侵犯、胸膜增厚和胸腔积液等方面的差异均无统计学意义(均P>0.05)。
2.2.8 SUVmax
PET/CT 图像分析结果显示,LCNEC 组的SUVmax(13.79±3.06)和SCLC 组的SUVmax(9.51±2.49)明显高于类癌组的SUVmax(4.52±1.77),且差异有统计学意义(F=32.43,P<0.01)。采用ROC 曲线分析SUVmax鉴别LCNEC 与SCLC 的临界值为12.25,AUC 为0.860(95%CI:0.729~0.991,P<0.01),灵敏度为80.00%,特异度为81.00%(图4)。
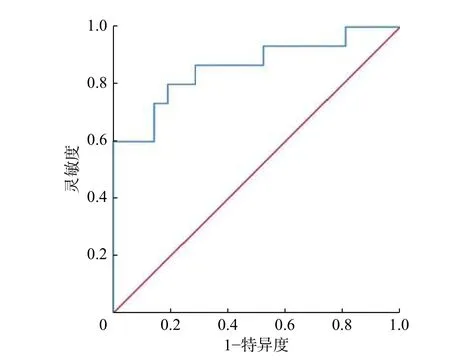
图4 最大标准化摄取值鉴别大细胞神经内分泌癌与小细胞肺癌的受试者工作特征曲线 曲线下面积为0.860(95%CI:0.729~0.991)Figure 4 Receiver operator characteristic curves of maximum standardized uptake value in differentiating large cell neuroendocrine carcinoma from small cell lung carcinoma
2.3 诊断准确率的比较
单纯PET/CT 与基于PET/CT 联合增强CT 及HRCT 的多模态显像诊断PNETs 的准确率分别为65.91%(29/44)和87.80%(36/41),且差异有统计学意义(χ2=5.655,P=0.017)。
3 讨论
肺类癌占所有类癌的25%以上,占原发性肺癌的2%~3%,其中TC 约占80%[6]。类癌属于较低级别的PNETs,恶性程度低,发病年龄较年轻,与吸烟无明确相关性,尤其是TC。Fink 等[7]对纳入的142 例类癌患者进行研究发现,患者的发病年龄为(52±16)岁。本研究中的类癌患者与LCNEC、SCLC 患者相比,发病年龄小,与文献报道[7]相符。类癌患者的临床表现为咳嗽、咳痰、咯血等,很少伴有类癌综合征,也可无任何阳性症状[6-7]。超半数类癌患者通过纤维支气管镜检查确诊,临床治疗以手术切除为主,5 年生存率>87%[2,7]。类癌多生长于支气管腔且多呈形态规则、边缘光滑的圆形或类圆形,密度均匀;也可同时向腔内、腔外生长,表现为“冰山征”,此征象多见于AC[8-9]。类癌好发于较大的支气管,常伴有阻塞性肺炎或肺不张,转移征象少见,但AC 具有潜在的侵袭性。曾亮等[8]研究结果发现,在13 例类癌患者中有6 例伴有阻塞征象,7 例TC 患者均无转移征象,6 例AC 患者中有2 例出现肺门及纵隔淋巴结转移,1 例合并远处转移。本研究中的8 例类癌患者合并阻塞性肺炎或肺不张的有7 例,有1 例AC 发生转移,与上述文献报道相符。类癌由支气管动脉供血,血供丰富,增强CT 扫描多呈明显强化[8-10]。
LCNEC 占原发性肺癌的3%,好发于中老年男性,且多有长期吸烟史[6]。Baine 和Rekhtman[11]的研究结果表明,60%以上的LCNEC 患者均为长期大量吸烟的老年男性,中位年龄65 岁。本研究共纳入LCNEC 患者15 例,年龄(61.47±8.03)岁,其中男性患者12 例,均有长期吸烟史,与上述文献报道[11]一致。LCNEC 患者以咳嗽、咳痰、胸闷、气促等临床症状常见,内分泌紊乱症状少见[12]。本研究结果显示,LCNEC 多表现为周围型、形态不规则的软组织肿块,分叶征常见(11/15),LCNEC的毛刺征(7/15)较其他类型的周围型肺癌少见,这可能与LCNEC 引起周围结缔组织反应性增生较少有关;增强CT 扫描多呈轻-中度强化。LCNEC 分化程度低、恶性程度高,预后常比其他类型的非小细胞肺癌差,即使在早期,患者5 年总生存率也仅为21%[13]。本研究中的15 例LCNEC 患者转移征象并不少见,其中纵隔淋巴结转移占46.7%(7/15)、肺门淋巴结转移占60.0%(9/15)、远处转移占20.0%(3/15),提示其预后较差,与文献报道[14]相符。
SCLC 是PNETs 中最常见的亚型,约占原发性肺癌的20%,也与吸烟密切相关[2,6]。SCLC 分化程度低,恶性程度极高,其侵袭性强、预后很差,患者多在临床确诊时已失去根治性手术的机会,5 年生存率<5%,且对放化疗敏感[2,15]。SCLC常见的临床症状包括咳嗽、咳痰、痰中带血、呼吸困难、异位激素产生和副肿瘤综合征等。SCLC 以中央型多见,CT 多表现为形态不规则的肺门区肿块,病灶压迫或侵犯邻近气管、支气管,导致阻塞性肺炎和(或)肺不张。SCLC 侵袭能力强,易压迫、包绕和侵犯周围血管,肺动静脉、上下腔静脉甚至左心房均可受累,侵犯或压迫上腔静脉时可出现上腔静脉综合征[16]。贺锋等[17]的研究纳入了40例SCLC 患者,其中20 例肺动脉侵犯、7 例上腔静脉侵犯、1 例主动脉侵犯。本研究21 例SCLC患者中13 例出现周围血管侵犯,与以上文献报道相符。本研究中,周围型SCLC 多表现为边缘光滑(4/7,57.1%)、浅分叶状(5/7,71.4%)的肿块或结节,边缘有毛刺征(3/7,42.9%)、胸膜凹陷(2/7,28.6%)、血管集束征(2/7,28.6%)较少见。以上研究结果的原因可能为周围型SCLC 边缘光滑,可能是由于肿瘤的快速生长推挤邻近肺组织,使得肿块边缘清晰锐利。SCLC 早期即可出现肺门、纵隔淋巴结转移及远处转移,中央型SCLC 可与肿大淋巴结相互融合,导致“冰冻纵隔”征象[17]。本研究21 例SCLC 患者中14 例(66.7%)出现肺门淋巴结转移,16 例(76.2%)出现纵隔淋巴结转移,12 例(57.1%)出现远处转移。Saber 等[2]认为SCLC 的脑转移倾向是其特征之一,有50%~80%的患者发生脑转移。在本研究中SCLC 脑转移患者仅4 例(4/21),这可能与样本量较少有关。
本研究中的LCNEC 和SCLC 患者肿瘤病灶对18F-FDG 呈现明显的高摄取,显著高于类癌患者,这提示肿瘤细胞恶性程度高、分化程度低、增殖指数高、代谢水平高。Kaira 等[18]发现,PNETs 细胞过度表达葡萄糖转运体1 与肿瘤对18F-FDG 的摄取密切相关。该研究通过对34 例PNETs 患者的PET/CT 图像和免疫组化进行分析,结果发现,葡萄糖转运体1 在SCLC 和LCNEC 患者中的阳性表达率分别为91.6%和87.5%,而在类癌患者中的阳性表达率仅为16.6%。赵承勇等[19]通过对16 例肺类癌患者的18F-FDG PET/CT 图像分析发现,肺类癌病灶对18F-FDG 的摄取轻度增高,SUVmax为4.00±1.64。何巍和穆晓东[20]发现,当SUVmax=7.1 作为鉴别类癌与LCNEC 的临界值时,其灵敏度和特异度均较高。柳卫等[21]发现,当SUVmax=11.9 作为鉴别LCNEC 有无淋巴结转移的临界值时,AUC 为0.858。本研究结果显示,LCNEC 和SCLC 病灶的18F-FDG 摄取明显高于类癌,鉴别LCNEC 与SCLC的SUVmax临界值为12.25,这既证实了SUVmax能有效鉴别PNETs 亚型,也对现有研究的不足作出了一定补充。
本研究中的TC、AC 病例数较少,故将二者合并为类癌组进行分析,但二者的发病年龄、恶性程度、影像学特点及侵袭能力等均存在不同程度的差异,这可能使研究结果产生一定偏倚。本研究中患者的CT 或PET/CT 检查与组织病理学检查间隔一定时间,这可能对其CT 与PET/CT 影像学特征的分析造成一定影响。
总之,类癌患者发病年龄较小,多为支气管腔内形态规则的类圆形结节,增强CT 扫描可见明显强化,尤其是TC;LCNEC 多为周围型、分叶状肿块,毛刺等征象较少见,增强CT 扫描呈轻-中度强化;SCLC 以中央型多见,易侵犯周围血管,早期易发生淋巴结、远处转移。LCNEC 和SCLC的SUVmax明显高于类癌,SUVmax=12.25 作为鉴别LCNEC 与SCLC 的临界值,其灵敏度、特异度均较高。PNETs 的CT 与PET/CT 表现有一定特征,PET/CT 联合增强CT 及HRCT 多模态显像可提高对该病的诊断准确率。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 樊建坤负责数据的统计分析、论文的撰写;王腾、杨瀚负责图像的分析;唐光才负责研究命题的提出与设计、论文的修订与审阅;江国豪负责图像的采集与处理。

