机械应力下成骨细胞-破骨细胞通讯研究进展
朱琛煜 陈熙 黄媚 刘莉菲 仝晓阳 邹军
1 上海体育学院运动科学学院(上海200438)
2 温州医科大学体育科学学院(温州325035)
骨骼是一种高度组织化的人体承重器官,并通过骨重塑来使其结构特性变化,从而适应机械应力和承重的需求[1]。骨重塑是维持骨密度和骨完整性的关键生物学过程,它取决于遗传、代谢、机械应力等多种因素[2]。越来越多的证据表明,机械刺激在骨生物功能中发挥着重要作用,如维持骨组织结构完整性以及促进骨骼成熟等[3]。骨组织对机械应力反应主要受成骨细胞(osteoblast,OB)和破骨细胞(osteoclast,OC)耦合活动调控,OB 的骨形成作用和OC 的骨吸收作用共同维持骨代谢平衡。这些细胞的功能失调会导致骨组织生理活动失调,引起诸多骨代谢疾病,如骨质疏松、骨硬化症等[4]。在以往的报道中,研究主要集中在OB 和OC对机械应力的应激反应上,然而关于机械应力加载过程中OB-OC 间通讯的相关报道则较为少见。本文总结近些年来的相关文献,探讨机械应力下OB 与OC之间的相互作用及可能的通讯机制,从而为机械应力调控骨重塑及骨代谢疾病的防治提供理论依据。
1 OB-OC通讯
OB 来源于骨髓间充质干细胞(bone marrow stro⁃mal cell,BMSC)[5],而OC是一种源自于造血干细胞的组织特异性巨噬细胞,在巨噬细胞集落刺激因子(mac⁃rophage colony stimulating factor,M-CSF)的作用下,造血干细胞分化为OC 前体细胞(osteoclast precursor cell,OPC)。核因子-κB 受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)/核因子-κB受体活化因子(receptor activator for nuclear fac⁃tor-κB,RANK)信号被激活后,OPC进一步分化为单核OC,随后融合为多核OC。多核OC在与OB发生同源相互作用后完全成熟,成为具有骨吸收活性的OC[6-8]。
研究表明,OB 与OC 间有多种通讯模式[9]:(1)OB与OC直接接触,从而使膜结合的配体和受体相互作用并激活细胞内的信号转导过程,如Eph 受体相互作用蛋白B2(EphrinB2)/促红细胞生成素肝细胞激酶B4(EphB4)、FAS 配体(FAS Ligand,FASL)-FAS 等[10]。(2)OB与OC之间形成间隙连接,允许水溶性小分子在两种细胞之间通过,从而传递一系列信号反应。(3)OB与OC之间的交流还能通过可扩散的旁分泌因子发生,如OB通过其分泌的M-CSF、RANKL、OPG、Wnt5A等因子作用于OC,从而调节OC 的分化与形成;而OC 通过释放1-磷酸鞘氨醇(sphingosine 1 phosphate,S1P)、信号素4D(semaphorin 4D,SEMA4D)、补体C3(com⁃plement component c,C3)等可溶性因子来调节OB的活性[11]。OB 和OC 之间细胞通讯的分子机制是骨细胞生物学的核心问题,这种调控机制受到遗传、代谢、全身激素水平、外界应力等多种因素的影响[12]。其中机械应力在OB与OC的细胞交流中发挥着至关重要的作用,近些年来也有相关文献对这方面进行了报道。
2 机械应力作用下OB对OC的调控
OB 和OC 都对机械应力具有一定的敏感性,在接受外界应力刺激后,这些细胞通过分子运输释放信号分子,在细胞间进行相互调控。大量研究证实了机械应力刺激可以调控OB 表达并分泌细胞因子,如MCSF、骨保护素(osteoprotegerin,OPG)、RANKL 等,主要通过旁分泌方式对OC 的成熟和分化进行调控。且多项研究还发现在不同形式或强度的应力刺激下OB分泌这些因子的能力也有所不同,对OC的成熟以及骨吸收能力也发挥着不同的调控作用。表1归纳总结了不同机械应力模式和强度下OB对OC的调控。
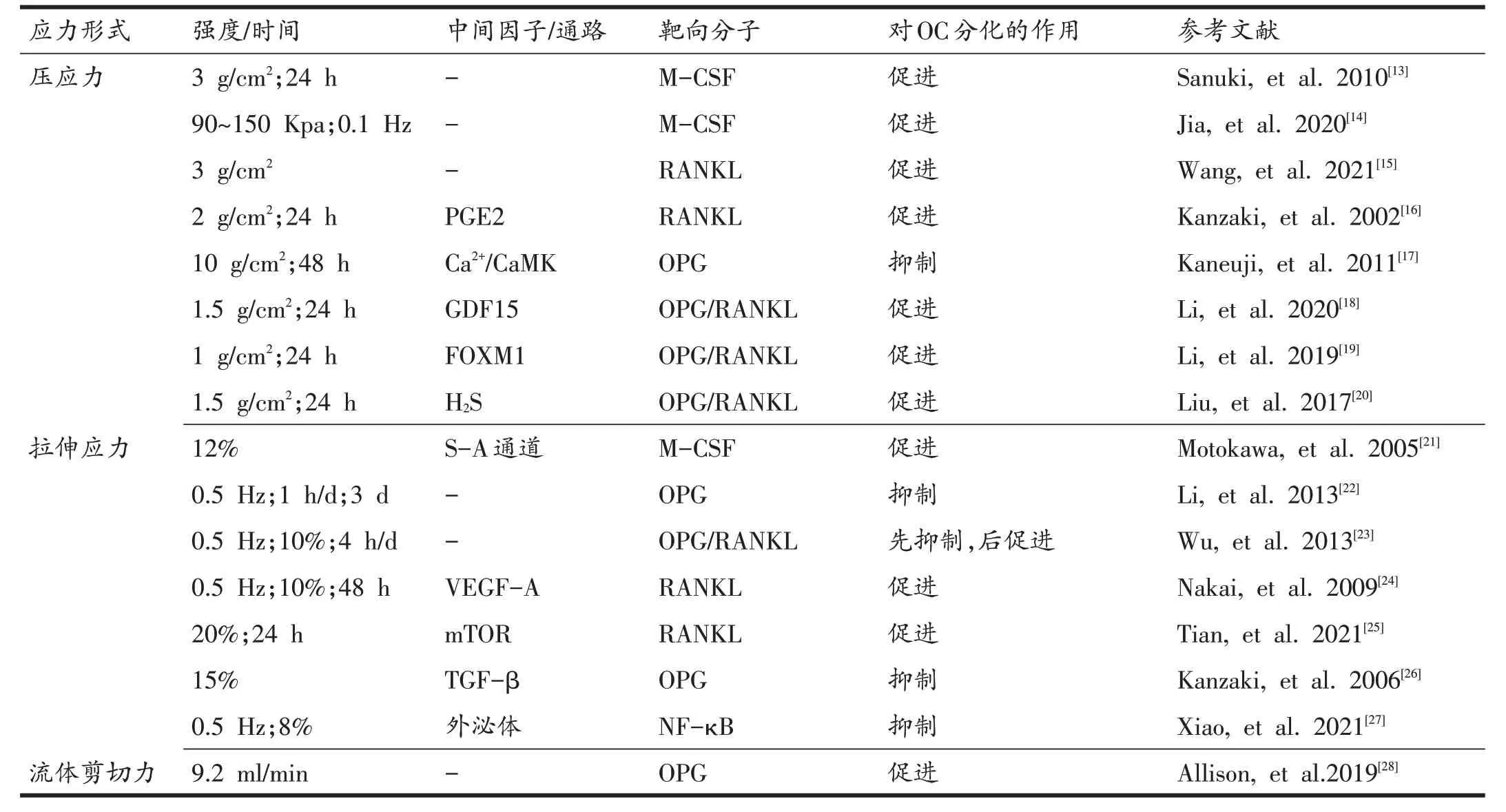
表1 机械应力下OB对OC的影响及其作用靶点
2.1 M-CSF
M-CSF 由OB、间充质细胞等产生,是促进OC 增殖、分化的重要细胞因子之一[29]。M-CSF 结合OPC 上的巨噬细胞集落刺激因子受体(c-Fms),活化由磷酸化DNAX 激活蛋白12(phosphorylated DNAX-activating protein 12,DAP12)和非受体酪氨酸激酶(non-recep⁃tor tyrosinekinase,Syk)组成的信号复合物,从而激活细胞外信号调节激酶(extracellular regulated protein kinases,ERK)/生长因子受体结合蛋白2(growth-fac⁃tor-receptor-bound protein 2,Grb-2)和磷脂酰肌3 激酶-蛋白激酶B(phosphoinosit-ide 3-kinase-protein ki⁃nase B,PI3K-Akt)信号通路来调节OPC的增殖、分化和存活[30]。此外,M-CSF 还能促进OPC 表达RANK,增加RANK与RANKL的结合,从而诱导OC的分化[31]。
研究发现,机械应力通过直接调节OB分泌M-CSF或间接调控其他通路来诱导OB 分泌M-CSF,参与OC的分化过程。Sanuki 等[13]对成骨细胞系MC3T3-E1 施加1.0或3.0 g / cm2的压应力后发现,M-CSF的mRNA水平随着压应力幅度和时间的增加而升高,并于24 h后达到显著水平;使用MC3T3-E1 加压后的条件性培养基干预OC的分化,抗酒石酸酸性磷酸酶(tartrate re⁃sistant acid phosphatase,TRAP)阳性OC 的数量显著增多并与压应力的强度呈正比。Jia等[14]对人牙周膜细胞(human periodontal ligament cells,hPDL)分别施加0、0~50、0~90 和0~150 kpa,0.1 Hz 的循环静水压后发现,低于90 kpa 的静水压可促进hPDL 的成骨分化;而150 kpa的静水压则会显著促进hPDL分泌促破骨因子M-CSF、RANKL、组织蛋白酶-K(cathepsin-K,CTSK)等,降低OB相关基因的表达,从而具有调控OC骨吸收活性的可能性。
S-A 通道是拉伸应力激活的离子膜通道,最先在成骨样细胞中被发现[32]。Naruse等[33]研究表明,拉伸细胞膜会增加人脐带内皮细胞内的Ca2+浓度,而添加S-A通道抑制剂Gd3+后,细胞对拉伸应力产生的Ca2+反应受到抑制,这表明细胞的拉伸反应是由位于细胞膜上的Ca2+可透性S-A通道介导的。Motokawa等[21]对MC3T3-E1 施加12%强度的拉伸应力后,M-CSF 的mRNA 水平以时间依赖的方式增加,加入S-A 通道抑制剂Gd3+后则降低了M-CSF 的表达水平;而无拉伸应力组则不受Gd3+的影响。这表明循环拉伸应力通过激活S-A 通道增加了MC3T3-E1 中M-CSF 的水平,从而促进OC 分化。以上研究表明,不同形式的机械应力对OB 分泌M-CSF的调控方式不同,不同强度的机械刺激对OB的促破骨作用也存在一定的差异。
2.2 OPG/RANKL/RANK信号通路
OPG/RANKL/RANK 信号通路是骨重塑过程中的关键信号轴,在OB 调节OC 形成中起着重要作用[34,35]。RANKL 是一种Ⅱ型跨膜蛋白,以蛋白水解释放的可溶性形式存在于表达细胞的表面,RANK 与RANKL结合后触发了一系列复杂的信号级联调控OC 的分化与形成[36]。该过程中,TNF受体相关因子6(TNF recep⁃tor associated factor,TRAF6)、转化生长因子b激活激酶1(transforming growth factor-β-activated kinase 1,TAK1)、TAK1 结合蛋白2(TAK1 binding protein 2,TAB2)等形成的蛋白质复合物激活了NF-κB以及氨基末 端 激 酶(phosphorylated Jun N-terminal kinase,JNK)、ERK、p38 等3 条MAPK 信号通路,从而促进OC的分化[37-39]。OPG是TNFR家族的非典型成员,是由OB产生的可溶性RANKL 诱饵受体,其结合RANKL 的能力远高于RANK,故OPG 可抑制RANKL 与RANK 的结合,从而阻断RANKL 介导的一系列下游信号通路,抑制OC 的生成[40]。因此,OPG/RANKL 比率影响着OC 的活性:若比率增大,OPG 竞争性结合RANKL 的能力处于绝对优势地位,导致RANK不能与RANKL有效结合产生转录信息,从而抑制OC分化;若比率减小,OPG无法阻断RANK与RANKL的结合,从而促进OC的生成,故保持适当的OPG/RANKL比率对维持正常的OC分化和骨代谢平衡具有重要作用。
研究表明,细胞膜上的各种机械传感蛋白和细胞内的机械信号蛋白通过调控可溶性因子(如硬化蛋白、Wnt、RANKL 等)在OB、OC 的功能中起着至关重要的作用[41]。其中,机械应力主要通过调节RANKL/OPG 的比值来实现OB 对OC 的调控作用,部分研究提示机械应力可直接调控RANKL/OPG 比值参与OC 分化,也有研究进一步表明机械应力可通过调节OB 中的细胞因子或信号通路间接调控OPG/RANKL/RANK信号通路。
2.2.1 机械应力直接调控OB中RANKL/OPG表达
适宜的压应力能够通过促进BMSC 向成骨分化并分泌RANKL,进而有利于BMMs 向OC 分化[15]。Wu 等[23]对BMSC 施加0.5 Hz、10%、4 h/d 的周期性机械牵拉,发现牵拉刺激诱导了RANKL 和OPG 的变化,在应力加载的第5天显著上调了RANKL/OPG 比值,而在第7 天下调其比值。这表明在机械牵拉诱导的BMSC 向OB分化过程中,OC相关的细胞因子表达上调,导致OC激活的开始。然而通过适当的机械刺激,BMSC 的OB分化不断增强,OC 相关的细胞因子被下调,导致骨吸收能力下降。Allison 等[28]发现,在雌激素缺乏期间,对MC3T3-E1 施加9.2 ml/min 的流体剪切力后与RAW264.7共培养,应力通过抑制MC3T3-E1中OPG的分泌,促进了OC 中活化T 细胞核因子(nuclear factor of activated T cell 1,NFATc1)、CTSK 和TRAP 的表达,增加了足小体带的形成,从而加剧了雌激素缺乏引起的骨质疏松。而Li 等[22]将MC3T3-E1 与RAW264.7共培养,并使用四点弯曲装置对MC3T3-E1 施加0.5 Hz、1 h/d、持续3 d的应力,培养基中OPG 的分泌显著增加而RANKL 水平无变化,进而下调了OC 中基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)和CTSK的表达水平,抑制了其骨吸收能力。
2.2.2 机械应力间接调控OB中RANKL/OPG表达
机械应力可通过调节OB 中某些因子的表达间接作用于RANKL或OPG,从而调控OC的分化。Nakai等[24]对MC3T3-E1 施加0.5 Hz、10%的机械牵拉,检测到细胞中血管内皮生长因子-A(vascular endothelial growth factor receptor-A,VEGF-A)、血管内皮生长因子受体(vascular endothelial growth factor receptor-1,VEGFR-1)和RANKL的mRNA水平随着牵拉时间的增加而提高;而VEGF 的中和抗体则完全逆转了上述变化,表明机械牵拉下OB 可能通过VEGF-A 来增加RANKL的表达。而Liu等[42]发现OB分泌的VEGF通过旁分泌机制刺激单核细胞分化为OC。同时VEGF-A可作为M-CSF 的替代品,通过VEGFR 增强OC 的骨吸收功能[43]。PGs 是OC 生成的潜在调节剂,研究表明环氧合酶-2(cyclooxygenase-2,COX-2)诱导了OPC 中PGE2 的自分泌作用,促进OC 的分化[44,45]。Kanzaki 等[16]发现,在PDL 和外周血单核细胞(peripheral blood mononuclear cells,PBMCs)共培养体系中,2.0 g/cm2、24 h的压应力能最大化地诱导并促进PDL调控PBMCs向OC 分化。加入外源性PGE2 后,增加了RANKL mRNA 表达;而加入PG 合成抑制剂吲哚美辛后,显著抑制了压应力刺激的COX-2 和RANKL 表达。这表明静态压应力通过诱导COX-2促进PDL细胞中PGE2的产生,进而上调RANKL 表达,促进PBMC 向OC 分化。但也有实验表明,压应力通过COX-2/PGE2 途径降低成骨细胞中OPG 的产生,诱导OC 分化[13]。Tian 等[25]施加20%、24 h 的超负荷拉伸应力于BMSC,拉伸负荷显著增加了BMSC中RANKL的表达和雷帕霉素(mamma⁃lian target of Rapamycin,mTOR)的磷酸化水平,并且BMSC 的培养上清液也促进了BMMs 向OC 分化。在BMSC 中加入mTOR 抑制剂后进一步证明了超负荷拉伸应力通过激活OB 中的mTOR 来上调RANKL 水平,促进OC 分化。Kanzaki 等[26]采用15%的循环拉伸应力作用于PDL 后发现,条件性培养基中的OPG 和TGF-β表达升高,将条件性培养基用于PBMC的培养则抑制了其向OC分化。研究发现,抗TGF-β抗体抑制了拉伸力诱导的OPG 产生,这表明循环拉伸应力通过上调PDL中TGF-β的表达来刺激OPG的分泌,抑制PBMC向OC分化。Kaneuji 等[17]也通过Ca2+/CaMK 抑制剂实验发现压应力激活了非经典Wnt /Ca2+中的Ca2+/CaMK途径,进而增强了MC3T3-E1中OPG的表达,抑制OC的分化。
上述研究表明,机械应力通过VEGF-A、PGE2、mTOR等因子促进OB分泌RANKL,有利于OC的分化;通过TGF-β和Ca2+/CaMK 通路促进OB 中OPG 的表达,抑制OC分化。然而还有一部分报道显示,机械应力通过调节OB 中生长分化因子(growth differentiation fac⁃tor 15,GDF15)、叉头盆蛋白质M1(Forkhead box pro⁃tein M1,FOXM1)等因子的表达,整体提高RANKL/OPG的比值来促进OC分化。GDF15具有促破骨作用,研究发现低氧条件诱导了GDF15 表达,促进了NF-κB的 活化,进而诱导OC的形成[46]。Westhrin 等[47]发现GDF15增强PBMC 向OC分化,但降低人间充质干细胞的成骨分化潜能。Li等[18]将PDL暴露于1.5 g/cm2的压应力下24 h,发现GDF15 表达明显增加,其上清液促使RAW264.7分化为更多的TRAP阳性多核细胞。PDL中GDF15 的敲除和过表达实验表明压应力通过上调PDL中GDF15的表达来提高RANKL/OPG的比值,促进OC分化。FOXM1是一种多功能增殖性转录因子,对细胞功能的维持具有重要作用[48]。Li 等[19]将PDL 与RAW264.7 细胞共培养,并对PDL 施加1 g/cm2的压应力24 h 后发现力诱导的PDL 中FOXM1 的下调可提高RANKL/OPG 比值,从而有助于OC 的分化。硫化氢(hydrogen sulfide,H2S)是哺乳动物细胞中多种信号转导途径中的一种新型气体递质,在OB、OC分化过程中具有重要作用[49]。Liu 等[20]发现1.5 g/cm2、24 h 的静态压缩力通过诱导PDL 中内源性H2S 的产生上调RANKL/OPG 比值,促进共培养系统中的PBMC 向OC分化,而压应力条件下的H2S激动剂和抑制剂实验也进一步证明了该结果。
机械应力下OB 对OC 的调控主要还是通过调节M-CSF、RANKL、OPG这几个最经典的调节因子来实现的。然而不同形式和强度的机械应力下,这些因子的上游作用靶点也存在很大差异,这表明机械应力是通过多靶点作用来调控OB 中M-CSF、RANKL 和OPG 的分泌,从而影响OC的分化。目前的研究主要集中于压应力和拉伸应力,其他应力如流体剪切力、微重力、离心力下,OB 是否通过这些靶点或因子来调控OC 分化值得进一步探索。此外,最新研究发现,应力下OB 还可通过产生外泌体来调节OC的形成。Xiao 等[27]发现,BMMs 能够内化经循环拉伸应力作用后的BMSC 衍生的外泌体,同时外泌体通过抑制NF-κB 信号通路来阻断F-肌动蛋白环的形成和OC 生成,从而改善后肢卸载小鼠模型中机械卸载引起的骨质疏松。
3 机械应力下OC对OB的调控
OC 主要是以旁分泌可溶性因子和细胞外囊泡的方式调控OB分化与活性。然而关于机械应力下OC调控OB 分化的相关报道目前较为少见。有研究发现,OC 特异性miR-214 转基因小鼠的OB 活性受到抑制;OC 产生富含miRNA 的外泌体,同时通过外泌体将miR-214转移到OB 中,并通过ephrinA2/EphA2信号轴识别OB,从而抑制其活性与骨形成能力[50]。另外,Li等[51]发现,在成熟的OC及其外泌体中检测到丰富的miR-214-3p,而在成熟的OB中miR-214-3p表达则很低;同时OC 产生的外泌体miR-214-3p 抑制OB 的骨形成。机械负荷能够诱导OB 中miRNA 表达的变化,Yuan 等[52]发现运动后的C57BL/6 小鼠胫骨和体外机械应变后的OB 中,miR-214 表达均被下调;机械应力增强了ALP活性并上调ATF4、Osterix、ALP和β-catenin等成骨因子的表达,而miR-214 的过表达不仅抑制了这些成骨基因的表达,还减弱了OB中机械应变增强的成骨作用,这表明miR-214可以减弱机械负荷对OB的成骨作用。综合上述,机械应力有可能通过影响OC中外泌体miR-214 的分泌,进而调节进入到OB 中外泌体miR-214的含量,从而影响OB的活性。
此外,囊泡RANK 被认为是OC-OB 交流的重要耦合因子,成熟OC 分泌的细胞外囊泡中的RANK 与OB中的RANKL 结合,并通过激活反向RANKL 信号促进Runt 相关转录因子2(Runx2)的表达,从而有利于OB分化与骨形成[53]。有研究发现,压应力可通过诱导RANK表达增加促进DC-STAMP和OC-STAMP的表达以及NFATc1 核易位,从而诱导RAW264.7 细胞向TRAP 阳性多核OC 分化[54]。这表明压应力可以调节OC中RANK 的表达,故由此可以推测机械应力通过调节OC中RANK表达,进而影响OB中的RANKL反向信号。
Ephrin B2-EphB4 是OC 与OB 之间双向通讯的重要信号转导通路,Ephrin B2 在OC 表面表达,与OB 表面分子EpHB4结合从而促进OB分化并抑制其凋亡;而EpHB4 介导了Ephrin B2 激活启动,并通过阻断OC 中c-fos/NFATc1 的一系列反应来抑制OC 分化[55,56]。Di⁃ercke 等[57]发现在正畸牙移动过程中,拉伸应力下牙周膜成纤维细胞通过FAK、Ras、ERK1/2 和SP1 途径诱导了EphrinB2 的表达,并与牙槽骨OB 中EphB4 受体结合,增加了成骨基因的表达,从而有助于正畸牙齿移动过程中张力部位的骨形成。目前尚未见研究报道机械应力下OC 通过Ephrin B2-EphB4 通路调控OB 的分化,值得进一步探索。
4 总结与展望
机械应力是维持骨稳态的重要因素,通过调节OC骨吸收和OB 骨形成之间的平衡来实现;同时,OB 与OC 之间的细胞交流也是维持骨代谢平衡的重要因素。在机械应力与OB-OC通讯的调节网络中,任何一个环节的失调都会导致骨代谢失衡,从而引起一系列骨代谢疾病。本文通过总结相关文献并归纳机械应力下OB 与OC 间的相互调节方式(见图1),可见应力下OB 主要通过M-CSF、RANKL、OPG 这些可溶性因子调节OC的分化,然而不同形式和强度的力学刺激对这些因子的信号转导存在不同的调节方式,进而也影响了其对OC的调控。此外,机械应力下OB调控OC的研究形式主要为体外给予OB单一的力学刺激,并在此条件下将OB 与OC 共培养或是用OB 的条件性培养基干预OC的分化,这种形式是否符合人体真实的力学情况以及体内OB 与OC 的相互作用方式,值得进一步探索。探索机械刺激维持正常骨重塑周期的机制以及准确把握机体对机械应力形式、时间和强度的需求对于促进骨代谢和维持骨骼健康具有重要意义。另外,机械应力下OC 对OB 调控的相关文献十分少见,从当前研究中推测机械应力最有可能通过影响OC中外泌体miR-214以及囊泡RANK的分泌调节OB的分化。未来的研究应更多集中于机械应力下OC 调控OB 的分子机制,同时介导这两种细胞之间通讯的新型分子如细胞外囊泡也需要进一步研究,这对于新型抗骨代谢疾病药物的研发十分重要。
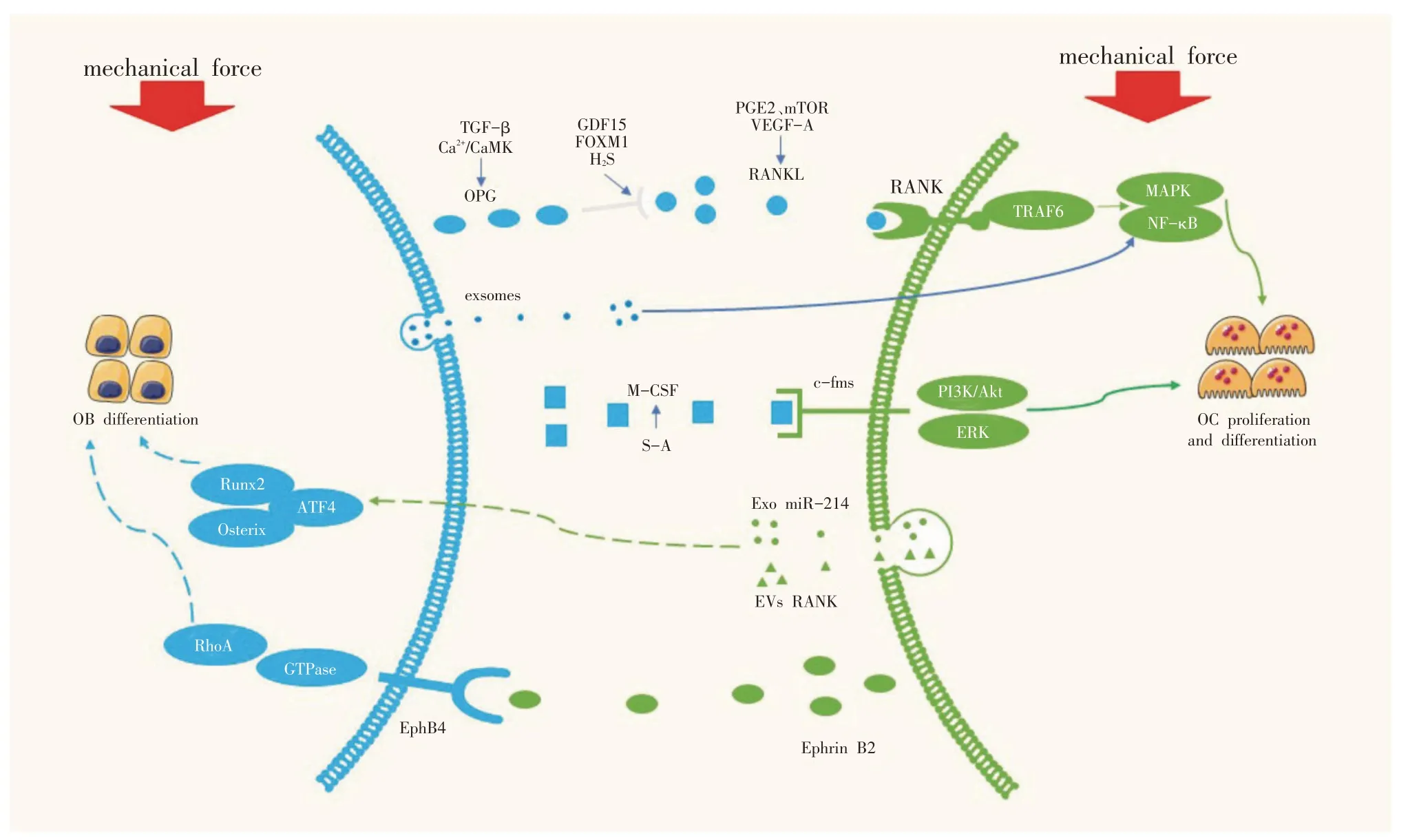
图1 机械应力下OB与OC之间的通讯机制

