玻璃酸钠上调miR-92a-3p表达保护IL-1β诱导的软骨细胞损伤
颜逸鹏 林树峰 张泽锋 叶晖
福建医科大学附属第二医院骨科(福建泉州362000)
骨关节炎(osteoarthritis,OA)是一种常见的慢性退行性疾病,主要发生在50 岁以上的中老年人群,女性患者多于男性。其主要病灶范围有滑膜组织、软骨组织、关节周围肌肉组织及软骨下骨。其病变特征为关节软骨退行性病变、关节骨质边缘及关节软骨下骨出现增生、关节变性,严重者可致残,严重影响患者的生活质量[1-3]。在OA 发生的初期,关节软骨会出现异常,表面光泽逐渐消失,颜色由透明的乳白色变为淡黄色。此时,其表面会出现裂缝,软骨组织开始出现软化,胶原纤维发生变性。当患者病情加重后,软骨表面裂缝会逐渐加深,最终影响深层的软骨组织[4-6]。OA的恶化会增加细胞外基质(extracellular matrix,ECM)的降解及细胞中基质金属蛋白酶(matrix metalloprotein⁃ases,MMPs)家族蛋白的表达,最终导致软骨细胞发生凋亡[7]。已有研究证明,在正常软骨组织中,发生凋亡的软骨细胞占5%,而OA 软骨组织中发生凋亡的软骨细胞高达22%[8]。
在正常情况下,软骨组织中软骨细胞的增殖与凋亡、ECM 的生成与降解都应保持在一个相对平衡的状态,以此来保证关节软骨的正常功能。而在这过程中,炎症因子也发挥了重要的作用。细胞白介素-1(inter⁃leukin-1,IL-1)是一种由软骨细胞分泌的促炎细胞因子,其在正常的软骨组织中含量较低,主要以IL-1β的形式存在[9-11]。Zhou 等研究发现,IL-1β的表达水平在OA患者中显著增加,且其表达水平与软骨细胞的损伤程度成正比[12]。另也有研究发现,IL-1β能降低ECM中蛋白聚糖的合成,增加MMP-3及MMP-13的表达[13]。
微小RNA(microRNA,miRNA)是一类大约由18~25个碱基核苷酸构成的单链非编码小RNA,已有研究证明miRNA参与了软骨形成及重塑的过程[14]。Dimitri⁃os 等发现,miR-22 可通过调节骨形成蛋白-7(bone morphogenetic protein,BMP-7)及过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor al⁃pha,PPARA)的表达,使软骨细胞中ECM 发生降解[15]。Tuddenham等则发现,miR-140在软骨细胞中特异性表达,与软骨的形成密切相关[16]。miR-92a-3p 被证明是一种新型的敏感且可靠的生物标志物,已被证明可用于多种恶性肿瘤和炎症疾病的诊断及预后评估[17-19]。张明焕等研究表明,与正常软骨细胞相比,miR-92a-3p在IL-1β诱导的软骨细胞中表达显著降低[20]。Mao等发现,人骨髓间充质干细胞分泌包裹miR-92a-3p的外泌体,可通过靶向WNT5A抑制软骨降解[21]。
玻璃酸钠(hyaluronic acid sodium,HA)又称透明质酸钠,是构成关节软骨和滑液的主要成分,是一种主要由葡萄糖醛酸和乙酰氨基己糖聚合而成的黏多糖物质,在关节腔内起润滑、覆盖屏障及缓冲应力的作用,已成为治疗骨关节炎的药物之一[22]。已有研究证明,外源性HA注射可以显著抑制OA患者关节液中IL-1β的含量,以达到治疗OA 的目的,但其具体的调控机制尚不清楚[23]。鉴于此,本研究拟探讨HA是否通过调节miR-92a-3p对IL-1β诱导的软骨细胞损伤的作用机制产生影响,以期为OA的治疗提供理论依据。
1 材料和方法
1.1 材料
1.1.1 细胞
人软骨细胞(CHON-001细胞)购于美国ATCC(美国马萨诸塞州弗吉尼亚州)。
1.1.2 实验主要仪器与试剂
Dulbecco’s 改良培养基(上海赛默飞世尔科技公司);real-time PCR 试剂(北京天根生化科技公司);Trizol 试剂、Lipofectamine 2000 转染试剂(美国Invitro⁃gen 公司);SYBR Green PCR Master Mix(美国Life Technologies公司);Annexin-V/PI细胞凋亡检测试剂盒(上海生工);PIPA裂解缓冲液(碧云天生物技术公司);miR-92a-3p 抑制剂(miR-92a-3p inhibitor)、miR-92a-3p 模拟物(miR-92a-3p mimics)和相应对照(in⁃hibitor-NC、mimics-NC)(上海吉玛制药技术有限公司);COL2A1 抗体、MMP-3 抗体、MMP-13 抗体、β-ac⁃tin抗体、HRP 标记的二抗(美国Abcam 公司);全自动酶标仪、流式细胞仪(美国BD公司)。
1.2 实验方法
1.2.1 细胞培养
CHON-001 细胞在含10%胎牛血清的Dulbecco’s改良培养基中,37℃、5%CO2的条件下培养。稳定传代3代,取第3代对数生长期的细胞进行后续试验。
1.2.2 细胞转染及分组
取对数生长期的CHON-001细胞接种于6孔板中,用含10%胎牛血清的Dulbecco’s改良培养基培养细胞至70%~80%融合时,按Lipofectamine 2000 转染试剂说明书配置miR-92a-3p inhibitor、inhibitor-NC、miR-92a-3p mimics 和mimics-NC 的转染复合物悬液,并将其加入到对应的6孔板中,每孔加入1×Opti-MEM培养基调整体积至2 ml,置于37℃、5%CO2的条件下继续培养48 h。将CHON-001 细胞按下述处理方式进行分组:①Control 组:用PBS处理未经转染的CHON-001细胞24 h;②IL-1β组:用0.1 μL 提前配置好的10 ng/ml的IL-1β诱导未经转染的CHON-001 细胞24 h;③IL-1β mimics-NC 组和IL-1β miR-92a-3p mimics 组:用0.1 μL 提前配置好的10 ng/ml 的IL-1β分别诱导经mimics-NC、miR-92a-3p mimics 转染的CHON-001 细胞24 h;④IL-1β+HA 组:用0.1 μL 提前配置好的10 ng/ml的IL-1β诱导未经转染的CHON-001细胞24 h后加入0.1 μL 100 μg/ml HA 培养24 h;⑤IL-1β+HA inhibitor-NC组、IL-1β+HA miR-92a-3pinhibitor组:用0.1 μL提前配置好的10 ng/ml的IL-1β分别诱导经in⁃hibitor-NC、miR-92a-3p inhibitor转染的CHON-001细胞24 h后分别加入0.1 μL 100 μg/ml HA培养24 h。
1.2.3 qRT-PCR检测
转染48 h 后,用qRT-PCR 法测定细胞中miR-92a-3p 表达变化。按照Trizol 说明书提取各组细胞中的总RNA,之后取1 μg 总RNA,按照反转录试剂盒说明书合成cDNA。PCR 体系(10 μL):SYBR Premix Ex Taq 5 μL、cDNA 样本1 μL、上游引物0.4 μL、下游引物0.4 μL、ROX Reference Dye II(50×)0.2 μL,加ddH2O 至10 μL。PCR 扩增反应条件为:95 ℃预变性30 s;95 ℃变性5 s,40 个循环;60 ℃退火和延伸35 s,用2-△△Ct法计算基因表达的相对倍数。引物信息:miR-92a-3p(上游引物:5’-CACTTGTCCCGGCCT⁃GTAAA-3’,下游引物:5’-TATTGCACTTGTCCCG⁃GCCTG-3’)。
1.2.4 MTT法检测细胞活力
将各组细胞悬液密度调整至4×103个/ml后接种于96 孔板(200 μl/孔),继续培养48 h 后,加入20 μL 四甲基偶氮唑盐(MTT)孵育4 h,弃去上清后,加入二甲基亚砜振荡反应15 min。用多功能酶标仪检测450 nm处各组细胞的OD值,实验重复三次。各组OD值取平均值后,根据下述公式计算细胞活力:细胞活力%=(OD实验/OD对照)×100%。
1.2.5 流式细胞仪检测细胞凋亡
将各组细胞消化制成单个细胞悬液,之后将其按每孔1×105个细胞接种至24孔板中,每孔体积400 μL,每组3个复孔。培养48 h后收集各组细胞,于1000 r/min 离心5 min,之后用PBS 清洗2 遍,并弃去上清液。加入试剂盒中的缓冲液,混合均匀后加入5 μL An⁃nex-inV/FITC和10 μL PI,于室温避光孵育15 min,用流式细胞仪上样检测,并借助Cell Quest软件分析细胞凋亡率。
1.2.6 Western blot检测
在冰上提取培养48 h的各组细胞的总蛋白,通过BCA 法测定蛋白的浓度,经SDS-PAGF 电泳将蛋白转入PVDF 膜上,然后将膜在5%牛奶中封闭1 h,之后加入一抗(1∶500 稀释的抗-COL2A1、抗-MMP-13、抗-MMP-3、抗-β-actin),4 ℃孵育过夜,PBST 漂洗3 次,加入HRP标记的二抗(1∶500),室温条件下孵育1 h,再次用PBST漂洗3次,最后滴加ECL曝光显影。
1.3 统计学分析
所有数据通过SPSS 22.0软件进行统计分析,实验结果以平均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有显著性意义。
2 结果
2.1 qRT-PCR 检测转染后细胞miR-92a-3p 含量的变化
与转染相应阴性对照及Control 组相比,经miR-92a-3p mimics 转染后,软骨细胞中miR-92a-3p 的表达水平显著升高(P<0.01);而经miR-92a-3p inhibitor转染后,软骨细胞中miR-92a-3p的表达水平显著降低(P<0.01)(见图1)。

图1 转染后miR-92a-3p的相对表达量
2.2 qRT-PCR 检测miR-92a-3p 在不同处理组中差异表达
与Control组相比,IL-1β组及IL-1β mimics-NC组miR-92a-3p 表达水平显著降低,IL-1β miR-92a-3p mimics 组miR-92a-3p 表达水平显著升高(P<0.01);与IL-1β组及IL-1β mimics-NC 组相比,IL-1β miR-92a-3p mimics 组miR-92a-3p 表达水平显著升高(P<0.01)(见图2)。

图2 miR-92a-3p在各组软骨细胞中的表达
2.3 过表达miR-92a-3p对软骨细胞活力的影响
与Control组相比,IL-1β组和IL-1β mimics-NC组细胞活力显著降低(P<0.01);与IL-1β 组和IL-1β mimics-NC组相比,IL-1β miR-92a-3p mimics组细胞活力显著升高(P<0.01)(见图3)。
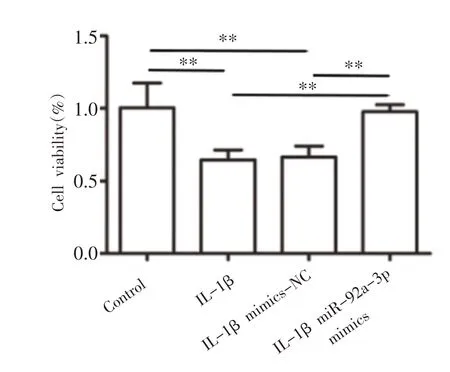
图3 miR-92a-3p对各组软骨细胞活力的影响
2.4 过表达miR-92a-3p对软骨细胞凋亡的影响
与Control组相比,IL-1β组和IL-1β mimics-NC组细胞凋亡率显著升高(P<0.01);与IL-1β组和IL-1β mimics-NC组相比,IL-1β miR-92a-3p mimics组细胞凋亡率显著降低(P<0.01)(见图4)。
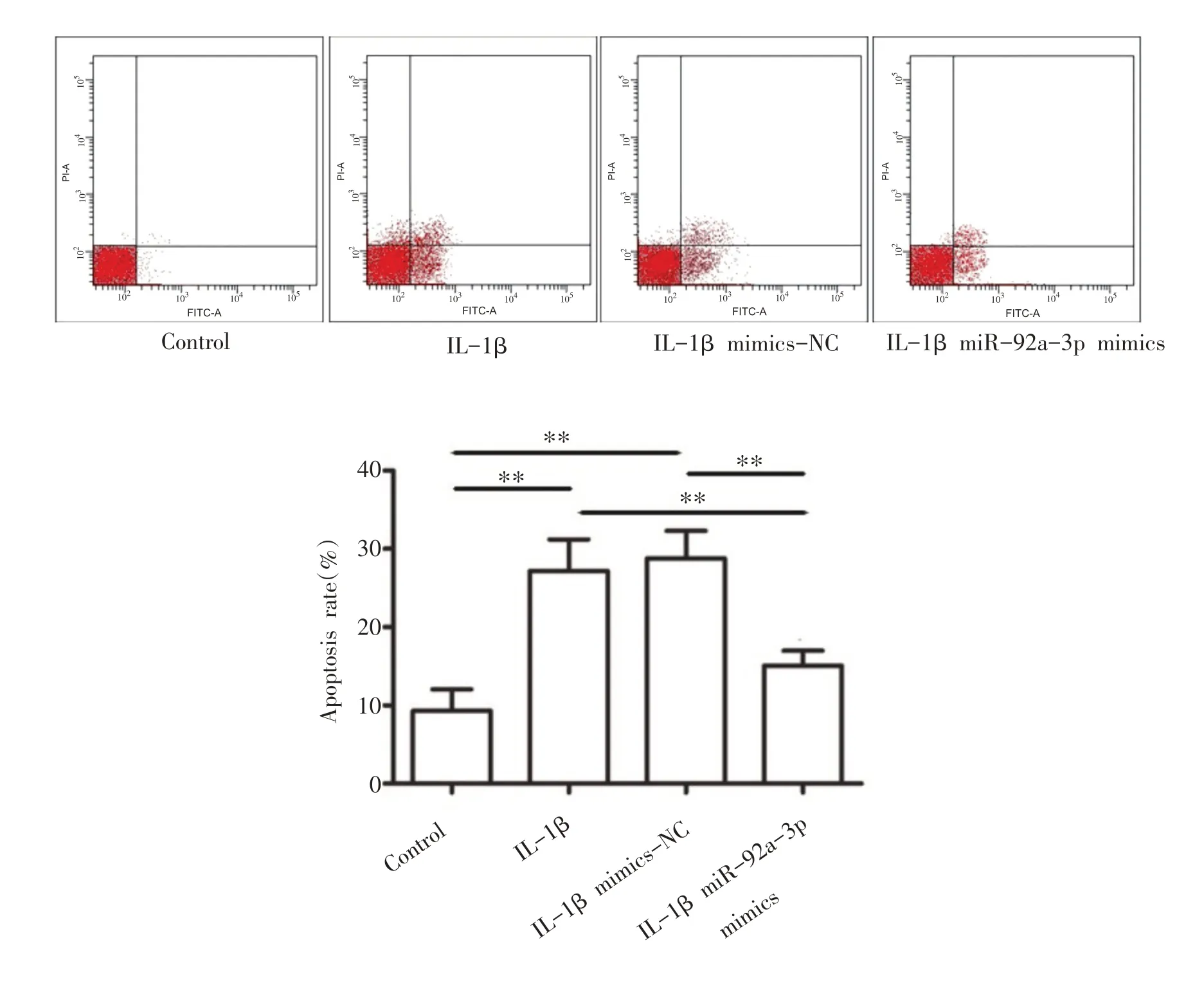
图4 miR-92a-3p对各组软骨细胞凋亡的影响
2.5 过表达miR-92a-3p对软骨细胞COL2A1、MMP-13及MMP-3蛋白表达的影响
与Control组相比,IL-1β组和IL-1β mimics-NC组COL2A1 蛋白表达显著降低(P<0.01),MMP-13 蛋白及MMP-3 蛋白的表达显著升高(P<0.01);与IL-1β组和IL-1β mimics-NC 组相比,IL-1β miR-92a-3p mimics组COL2A1 蛋白显著升高(P<0.01),MMP-13 蛋白及MMP-3蛋白的表达显著降低(P<0.01)(见图5)。
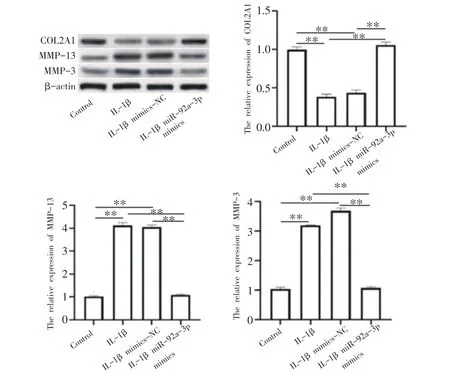
图5 miR-92a-3p对各组软骨细胞COL2A1、MMP-13及MMP-3蛋白表达的影响
2.6 HA对IL-1β诱导的软骨细胞miR-92a-3p表达的影响
与IL-1β组相比,IL-1β+HA 组和IL-1β+HA in⁃hibitor-NC 组miR-92a-3p 表达显著升高(P<0.01);与IL-1β+HA 组和IL-1β+HA inhibitor-NC 组相比,IL-1β+HA miR-92a-3p inhibitor组miR-92a-3p表达显著降低(P<0.01)(见图6)。

图6 HA对IL-1β诱导的软骨细胞miR-92a-3p表达的影响
2.7 HA对IL-1β诱导的软骨细胞活力的影响
与IL-1β组相比,IL-1β+HA 组和IL-1β+HA in⁃hibitor-NC 组细胞活力显著升高(P<0.05);与IL-1β组和IL-1β+HA inhibitor-NC 组相比,IL-1β+HA miR-92a-3p inhibitor 组细胞活力显著降低(P<0.05)(见图7)。
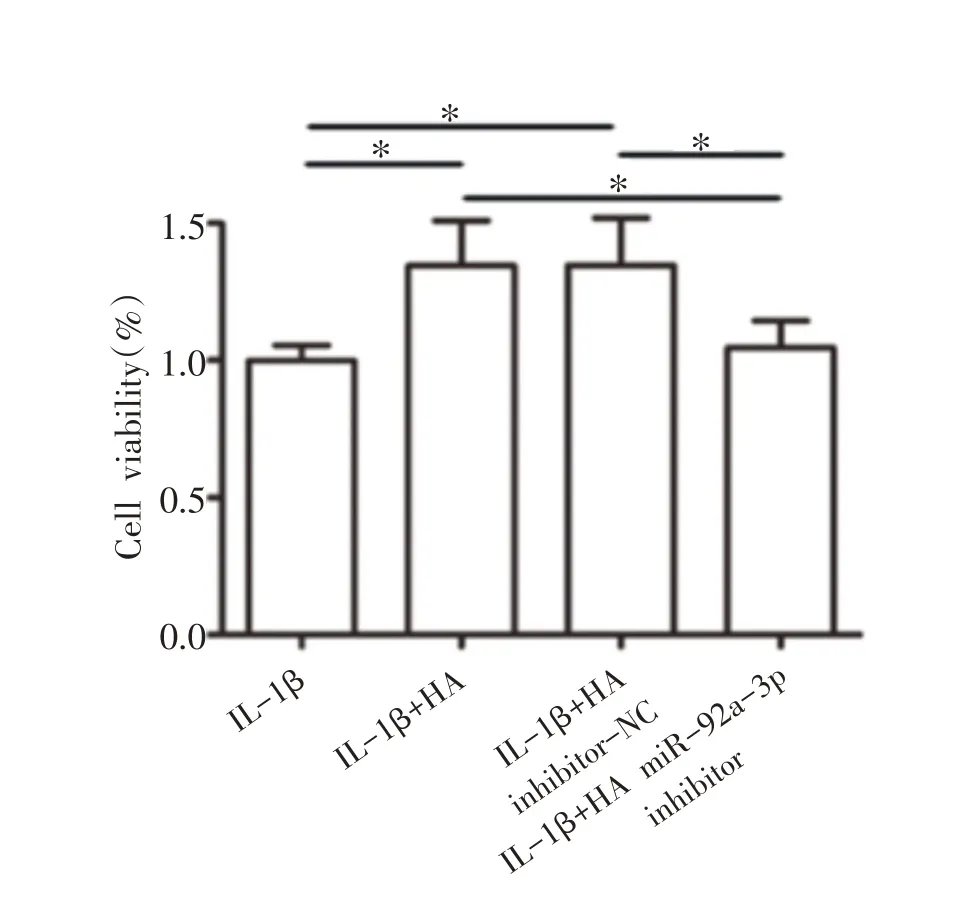
图7 HA对IL-1β诱导的软骨细胞活力的影响
2.8 HA对IL-1β诱导的软骨细胞凋亡的影响
与IL-1β组相比,IL-1β+HA 组和IL-1β+HA in⁃hibitor-NC 组细胞凋亡率显著降低(P<0.01);与IL-1β组和IL-1β+HA inhibitor-NC组相比,IL-1β+HA miR-92a-3p inhibitor 组细胞凋亡率显著升高(P<0.01)(见图8)。
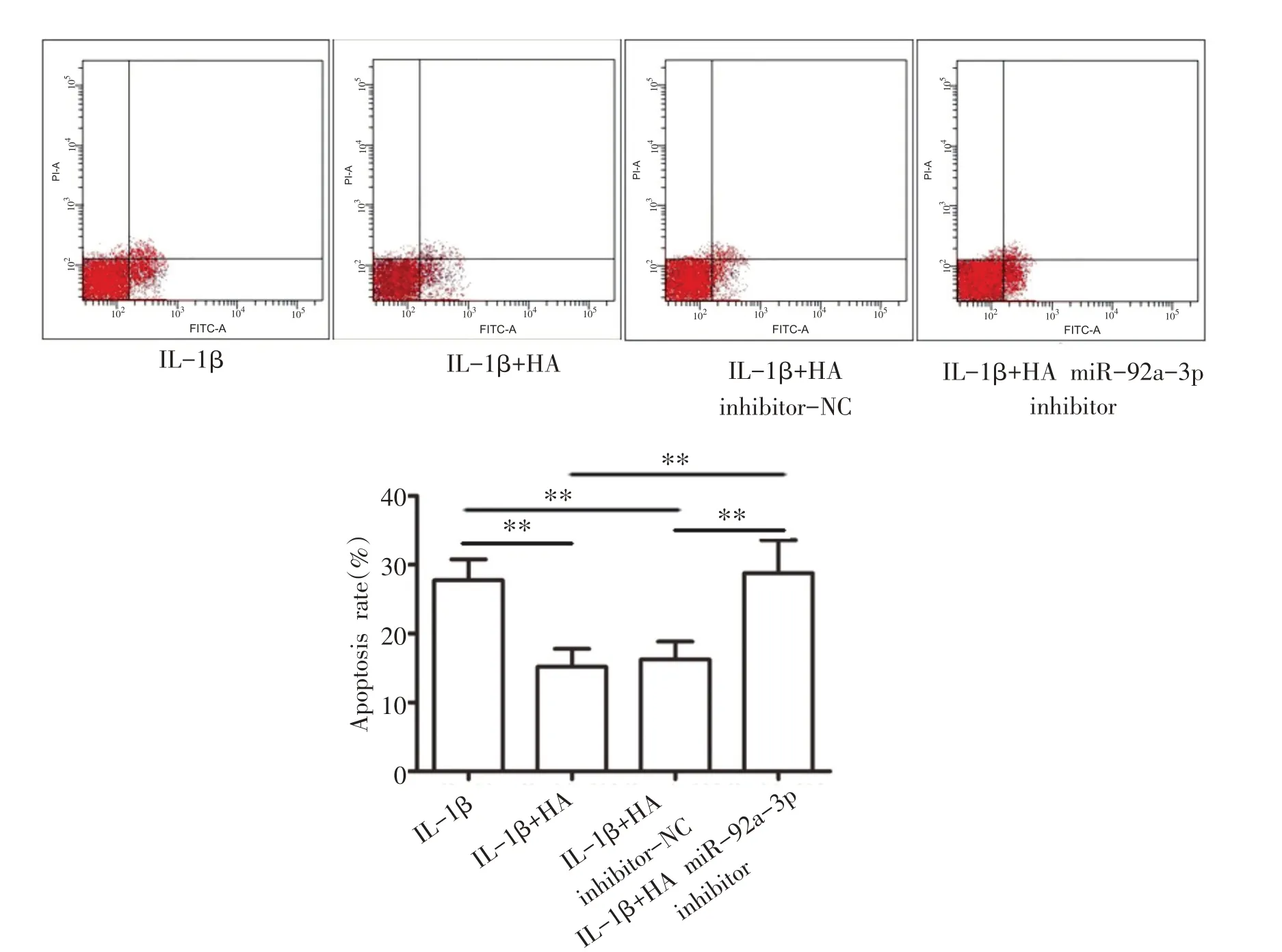
图8 HA对IL-1β诱导的软骨细胞凋亡的影响
2.9 HA 对IL-1β诱导的软骨细胞COL2A1、MMP-13及MMP-3蛋白表达的影响
与IL-1β组相比,IL-1β+HA 组和IL-1β+HA in⁃hibitor-NC 组COL2A1 蛋白表达显著升高(P<0.01),MMP-13 蛋白及MMP-3 蛋白的表达显著降低(P<0.01);与IL-1β+HA组和IL-1β+HA inhibitor-NC 组相比,IL-1β+HA miR-92a-3p inhibitor 组COL2A1 蛋白显著降低(P<0.01),MMP-13 蛋白及MMP-3 蛋白的表达显著升高(P<0.01)(见图9)。

图9 HA对IL-1β诱导的软骨细胞COL2A1、MMP-13及MMP-3蛋白表达的影响
3 讨论
OA是一种以软骨退行性病变为特征的慢性疾病,具有复杂的发病机制。已有研究证明,软骨细胞的凋亡和细胞外基质的降解会最终导致软骨破坏。IL-1β是一种炎性细胞因子,它可以刺激软骨细胞,以诱导其产生MMPs,在软骨基质降解中起十分重要的作用。Ⅱ型胶原纤维α1 基因(COL2A1)是构成软骨基质胶原的主要成分,是软骨细胞的标志[24]。王晓峰等发现,与对照组相比,OA 组软骨细胞中COL2A1 的mRNA 表达显著减少[25]。已有研究表明,在OA发生的过程中,MMPs的分泌增多会加重软骨基质的损伤[26]。夏汉庭等发现,MMP-13和MMP-3能直接或间接裂解Ⅱ型胶原,抑制MMP-13 和MMP-3 的表达在体内外实验中均能起到抗OA 的作用[27]。李保驰的研究表明,与非OA 组相比,MMP-13 和MMP-3 蛋白在OA 组滑膜中的表达量显著升高[28]。在本研究中,我们首先证实了与正常软骨细胞相比,经IL-1β诱导的软骨细胞中MMP-13 及MMP-3的表达显著升高,COL2A1的表达显著降低,这与之前的研究结果相一致。
miRNA 是一类高度保守的非编码小RNA,其可通过与靶基因mRNA的5’UTR结合在转录水平上对基因的表达进行调控。已有研究表明,miRNA 不仅参与包括增殖、分化、发育、凋亡等人体正常的生理过程,还参与很多的病理过程。Zhang等发现,miR-21在OA患者体内的表达显著升高,且与关节软骨的形成密切相关[29]。Akhtar等证明,miR-101-3p在IL-1β诱导的软骨细胞中表达降低[30]。Zhang等的研究表明,miR-502-5p能降低IL-1β诱导的软骨细胞中MMPs的分泌,从而缓解软骨细胞损伤[31]。miR-92a-3p是目前较为公认的致癌miRNA,它可通过阻遏PTEN 介导的PI3K/AKT 通路引起肿瘤细胞的侵袭和转移[18,32]。Tsuchida等发现,miR-92a-3p 在结肠癌患者中的表达水平显著升高[33]。Mao等的研究则表明,miR-92a-3p 在OA 患者的软骨中表达降低[34]。本研究发现,miR-92a-3p 在IL-1β诱导的软骨细胞中表达降低,这与张明焕等的研究结果一致[20]。在此基础上,本研究还表明过表达miR-92a-3p 可减缓IL-1β诱导造成的细胞凋亡,降低细胞中MMP-13及MMP-3蛋白的表达,增加COL2A1蛋白表达。
现阶段OA 的治疗重点主要围绕针对性减轻患者疼痛、改善关节功能、延缓病情等方面进行,可用于进行保守治疗的药物主要有非甾体抗炎药、解热镇痛抗炎药、类固醇类药物及关节内注射HA 等[35,36]。其中,最直接、副作用最小的就是HA关节腔内注射治疗。尽管如此,目前却鲜有与HA 治疗OA 相关的机制研究。本研究发现,HA 可以通过上调IL-1β诱导的软骨细胞中miR-92a-3p的表达,进而增加COL2A1蛋白的表达,降低MMP-13蛋白及MMP-3蛋白的表达,而抑制细胞中miR-92a-3p的表达,则会抵消这一反应。
4 结论
综上所述,本研究结果显示HA 能通过上调miR-92a-3p 的表达,进而明显减轻IL-1β诱导的软骨细胞损伤,这表明miR-92a-3p 在OA 的发生发展中可能起关键作用,这也为进一步研究miR-92a-3p 在OA 发病机制中的作用奠定了理论基础,但其具体的作用机制还需进一步证实。

