葡萄籽原花青素对高精料育肥羔羊免疫功能的影响
牟春堂 杨文军 王鹏举 任国栋 剧 浩 张暄梓 张建新 郝小燕
(山西农业大学动物科学学院,晋中030801)
由于季节性和地区性的优质粗饲料资源缺乏,高精料饲粮在我国反刍动物生产中应用非常普遍。长期饲喂高精料饲粮容易造成反刍动物瘤胃代谢异常,进而发生瘤胃酸中毒,导致瘤胃内产生并积累大量的异常代谢物,包括D-乳酸、组胺、色胺和脂多糖(LPS)等[1]。反刍动物长期摄入高精料饲粮,瘤胃和后肠道中低pH和高浓度LPS会导致细胞上皮结构受损,细胞间紧密连接的屏障功能受到破坏,游离的LPS会迁移至循环系统[2]。LPS进入循环系统中会引起动物氧化应激和免疫活化,增加动物对病原的易感性。Nagaraja等[3]报道,发生瘤胃酸中毒后,外周血中中性粒细胞比例增加,淋巴细胞比例降低。吴永霞[4]研究也表明,高精料饲粮组较低精料饲粮组奶牛的外周血中白细胞和中性粒细胞数量显著升高。
细胞免疫是动物免疫系统的重要组成部分,而T细胞在细胞免疫中至关重要。T细胞的过度增殖和活化均不利于机体健康。白细胞分化抗原(cluster of differentiation,CD)是存在于T细胞膜表面的主要标志物,其中CD4和CD8分别存在于辅助性T细胞和细胞毒性T细胞的膜表面。机体CD4+T细胞比例高时,能够迅速启动免疫系统抵抗外源性病原微生物的入侵,不易感染疾病。当机体CD8+T细胞比例高时,说明机体遭受外源感染的程度更严重,机体自身的免疫功能降低,需要依靠外源药物抵抗病原[5]。因此,机体T淋巴细胞中CD4+和CD8+的细胞比例及二者的比值高低与动物机体的免疫功能密切相关。
葡萄籽原花青素(GSPs)广泛存在于葡萄枝叶、果皮、果肉和籽实中,由不同数量的黄烷醇单体聚合而成。研究表明,植物多酚和黄酮类化合物可以增强动物机体抗氧化力,调节机体免疫反应,改善动物健康状况,促进机体生长发育[6]。邢文丽等[7]研究表明,GSPs能够上调大鼠血清白细胞介素-12(IL-12)含量,促进CD4+T细胞的活化,提高机体免疫功能。茅婷婷等[8]报道,GSPs可以促进体外培养的大鼠脾脏淋巴细胞增殖,具有提高细胞抗氧化和细胞免疫的作用。沙葱黄酮对绵羊免疫功能有调控作用,可以提高绵羊外周血淋巴细胞转化率,上调CD4+T细胞比例及CD4+/CD8+比值,下调CD8+T细胞比例[9],同时促进淋巴细胞增殖[10]。目前,关于GSPs在反刍动物的中应用研究主要集中在对机体抗氧化能力和瘤胃内环境调控等方面,而对于反刍动物免疫功能调控作用方面的研究很少。本试验在高精料饲粮舍饲条件下给羔羊饲喂不同水平GSPs,旨在探究GSPs对羔羊外周血淋巴细胞亚群、淋巴细胞转化率和凋亡率、细胞因子水平的影响,旨在为开发绵羊功能性免疫佐剂提供理论指导,为舍饲羔羊健康、高效养殖提供新思路。
1 材料与方法
1.1 试验设计及动物管理
GSPs购自南京某生物科技有限公司,其主要成分为原花青素(96.4%)、儿茶素(0.533%)、表儿茶素(0.239%)、表没食子儿茶素没食子酸酯(0.225%)、表儿茶素没食子酸酯(0.171%)。
本试验在山西农业大学国家肉羊产业技术体系饲料资源岗位试验基地进行,选取48只4月龄、体重[(22.75±1.20) kg]相近的杜寒杂交一代公羔羊,严格检疫。试验开始前对羊舍进行全面的清洗、消毒,对试验羊进行羊痘、口蹄疫和小反刍兽疫疫苗免疫。采用单因素完全随机试验设计,将48只试验羊随机分成4组,每组12只羊。各组分别在基础饲粮中添加0(对照组)、10(10GSPs组)、20(20GSPs组)、40 mg/(kg BW·d)(40GSPs组)的GSPs。试验期共60 d,其中预试期15 d,正试期45 d。
GSPs的饲喂量在正试期每周根据体重调整1次,提前用分析天平准确称取每只羔羊每日GSPs的饲喂量,在晨饲前与100 g粉状饲料混合后,逐只一次性饲喂,确保每只羊完全采食GSPs后再投喂饲料。基础饲粮精粗比例为70∶30,基础饲粮组成及营养水平见表1。所有羔羊单栏(3.0 m×0.8 m)饲养,每日饲喂2次(07:00和19:00),自由采食、饮水,记录每只羔羊日采食量。分别于正试期第1和45天晨饲前称量试验羊体重,计算平均日增重。

表1 基础饲粮组成及营养水平(干物质基础)
1.2 样品采集
分别于正试期第1、15、30和45天晨饲前颈静脉采集血液于5 mL肝素钠采血管中,迅速带回实验室,待测淋巴细胞亚群。第45天同时采集2份5 mL血液,一份用于测定淋巴细胞转化率和凋亡率;另一份用常规方法分离血清后-20 ℃保存,待测细胞因子和免疫球蛋白含量。
1.3 测定指标与方法
1.3.1 饲粮营养水平的测定
饲料原料及基础饲粮经粉碎后过1 mm筛,制成风干样品待测。干物质、粗灰分、粗蛋白质、粗脂肪含量参照AOAC(2000)[12]的方法测定。中性洗涤纤维和酸性洗涤纤维含量参照Van Soest等[13]的方法,采用Ankom 220纤维分析仪(美国ANKOM公司)测定。
1.3.2 外周血淋巴细胞亚群CD4+、CD8+T细胞比例的测定
外周血淋巴细胞亚群检测参考木其尔[9]的测定方法,即取60 μL血液于流式管中,加入MOUSE ANTI SHEEP CD4∶TITC和MOUSE ANTI SHEEP CD8∶RPE抗体,室温避光孵育20 min。再加入1×红细胞裂解液(索莱宝生物科技有限公司,No.:R1010)2 mL,轻轻混匀,室温避光孵育10 min。300×g离心5 min,弃上清。再加入4 mL磷酸盐缓冲液(PBS),300×g离心5 min,弃上清。加入300 μL流式细胞仪上机液(或PBS),上流式细胞仪(FACSCalibur,美国BD公司)检测。
1.3.3 外周血淋巴细胞的分离
利用试剂盒(索莱宝生物科技有限公司,No.:P9030)分离绵羊外周血淋巴细胞,按说明书操作步骤进行。1)使用真空采血管采集试验羊新鲜血液3 mL,迅速带回实验室;2)在无菌操作台中,将血液与稀释液等体积混合均匀;3)先往15 mL进口离心管中加入4 mL的淋巴细胞分离液,再缓慢沿管壁加入5 mL稀释血液,1 000×g离心25 min;4)用移液枪小心吸取白色中间层,再加入5 mL PBS+1%双抗缓冲液,500×g离心5 min;5)加入5 mL 1×红细胞裂解液,室温裂解5 min,500×g离心5 min;6)PBS+1%双抗缓冲液重复清洗2遍,获得淋巴细胞;7)将收集的淋巴细胞置于5%胎牛血清(美国Gibco公司,No.:26010074)和1%双抗RPMI-1640的细胞培养液中,待用。
1.3.4 外周血淋巴细胞转化率的测定
外周血淋巴细胞转化率检测参考朱丽君等[14]报道的方法并加以改进。将已分离的外周血淋巴细胞浓度调整为2×106个/mL,取100 μL接种于96孔板中,标记组别,设置对照组,每个样品3个重复。试验组每孔加入10 g/mL刀豆蛋白(ConA)100 μL,对照组加入等体积PBS,在37 ℃、5% CO2培养箱(型号:BC-J80-S,上海博迅医疗生物仪器股份有限公司)中培养48 h。培养结束前4 h每孔加入CCK-8溶液10 μL,置于培养箱中继续培养。培养结束,取出96孔板,用酶标仪测定450 nm处的吸光度值(OD450)。按以下公式计算羔羊外周血淋巴细胞转化率:
外周血淋巴细胞转化率(%)=100×(试验组
OD450-对照组OD450)/对照组OD450。
1.3.5 外周血淋巴细胞凋亡率的测定
外周血淋巴细胞凋亡率的测定参考木其尔[9]的方法。将羔羊外周血淋巴细胞悬液置于离心管中,1 000×g离心5 min,弃掉细胞培养液,再用预冷的PBS漂洗2次,收集细胞。使用1×Binding buffer工作液,重悬细胞,并调整细胞浓度至1×106个/mL。吸取100 μL细胞悬液至流式管中,再加入膜联蛋白V(Annexin V)异硫氰酸荧光素(FITC)和碘化丙啶(PI)各5 μL,轻轻混合均匀,室温避光孵育15 min。染色孵育后,加入1×Binding buffer工作液400 μL,1 h内使用流式细胞仪检测。
1.3.6 血清细胞因子和免疫球蛋白含量的测定
采用比色法测定血清中免疫球蛋白G(IgG)、免疫球蛋白M(IgM)和免疫球蛋白A(IgA)含量;采用酶联免疫吸附测定试验(ELISA)法测定血清中白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)和干扰素-γ(IFN-γ)含量,ELISA试剂盒购自南京建成生物工程研究所。
1.4 数据分析
利用Excel 2013进行试验数据初步整理,采用SAS 9.2软件进行单因素方差分析(one-way ANOVE),并采用Duncan氏法进行多重比较,通过正交多项式分析处理的线性和二次效应。P<0.05表示差异显著,0.05≤P<0.10表示有显著的趋势。
2 结 果
2.1 GSPs对羔羊生长性能的影响
GSPs对羔羊生长性能的影响详见牟春堂等[15]。简言之,10GSPs和20GSPs组羔羊平均日增重和平均日采食量显著高于对照组和40GSPs组(P<0.05),40GSPs与对照组差异不显著(P>0.05);各组料重比无显著差异(P>0.05)。
2.2 GSPs对羔羊外周血淋巴细胞亚群的影响
由表2可知,在正试期第1天,各组间羔羊外周血中CD4+和CD8+T细胞比例及CD4+/CD8+比值均无显著差异(P>0.05)。正试期第15天,GSPs对外周血中CD4+T细胞比例没有显著影响(P>0.05),但CD8+T细胞比例有线性降低的趋势(P=0.057),CD4+/CD8+比值有线性升高的趋势(P=0.075)。正试期第30天,20GSPs和40GSPs组外周血中CD4+T细胞比例显著高于对照组(P<0.05),CD8+T细胞比例显著低于对照组(P<0.05),10GSPs组与对照组之间差异不显著(P>0.05);20GSPs组CD4+/CD8+比值最高,显著高于10GSPs和对照组(P<0.05)。正试期第45天,与对照组相比,20GSPs和40GSPs组外周血中CD8+T细胞比例显著降低(P<0.05),CD4+T细胞比例及CD4+/CD8+比值显著升高(P<0.05);10GSPs组与20GSPs和对照组差异不显著(P>0.05)。
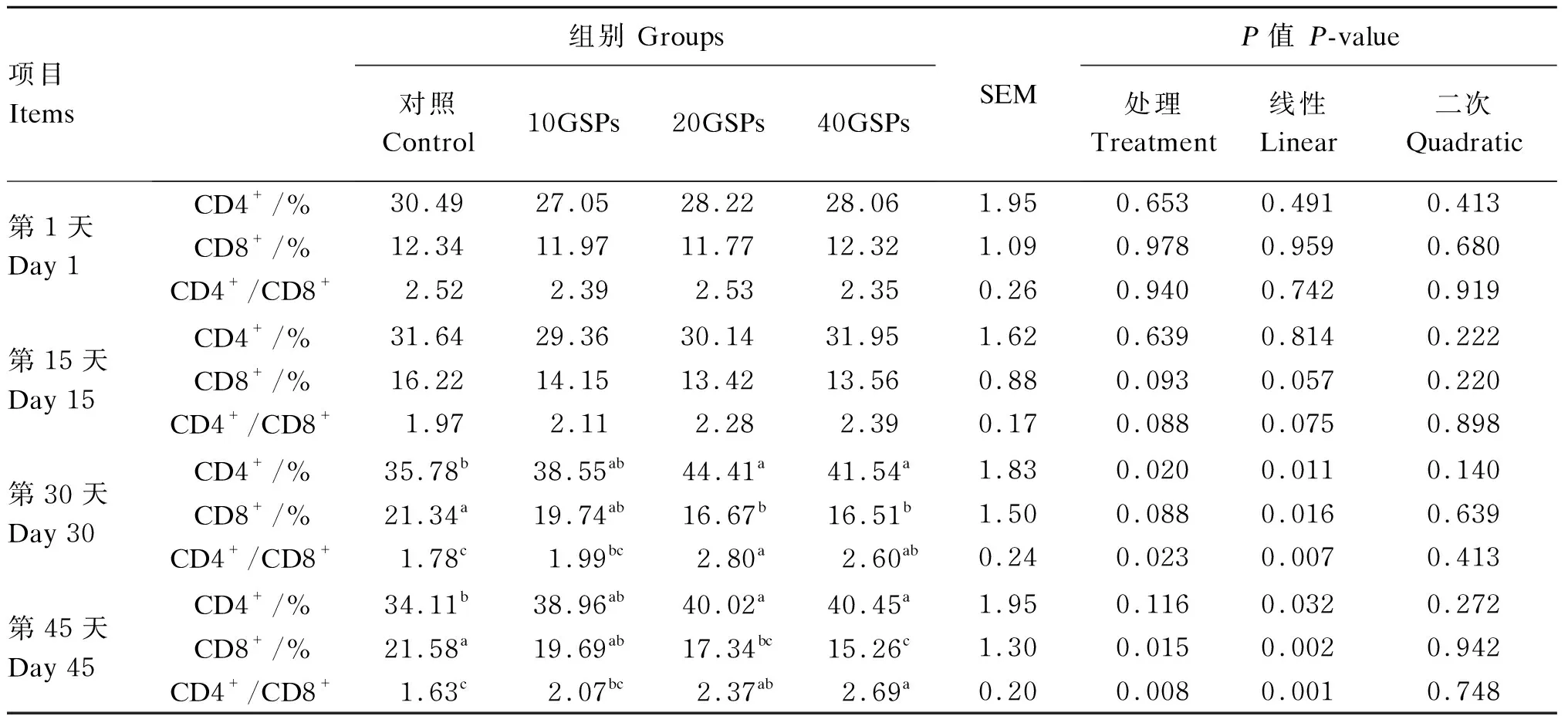
表2 GSPs对羔羊外周血淋巴细胞亚群的影响
2.3 GSPs对羔羊外周血淋巴细胞转化率和凋亡率的影响
由表3和图1可知,随着GSPs添加水平的增加,外周血淋巴细胞转化率线性升高(P<0.05);20GSPs和40GSPs组的外周血淋巴细胞转化率显著高于对照组(P<0.05),与10GSPs组差异不显著(P>0.05)。随着GSPs添加水平的增加,GSPs外周血淋巴细胞凋亡率线性降低(P<0.05);20GSPs和40GSPs组的外周血淋巴细胞凋亡率显著低于对照组(P<0.05)。
2.4 GSPs对羔羊血清细胞因子和免疫球蛋白含量的影响
由表4可知,随着GSPs添加水平的增加,血清IL-2含量有线性升高的趋势(P=0.057),血清IL-6含量有线性降低的趋势(P=0.074),但各组间血清IL-2、IL-6含量差异不显著(P>0.05)。20GSPs和40GSPs组血清IL-4含量显著高于对照组(P<0.05)。各组间血清IFN-γ含量差异不显著(P>0.05)。随着GSPs添加水平的增加,血清IgG含量线性增加(P<0.05);20GSPs组血清IgG含量显著高于10GSPs和对照组(P<0.05),40GSPs组显著高于对照组(P<0.05)。各组间血清IgA和IgM含量差异不显著(P>0.05)。
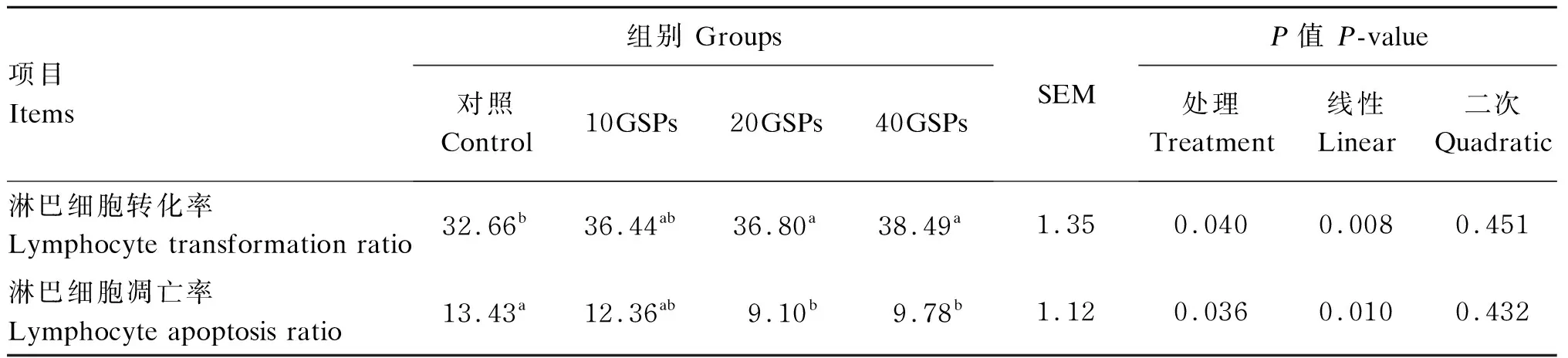
表3 GSPs对羔羊外周血淋巴细胞转化率和凋亡率的影响
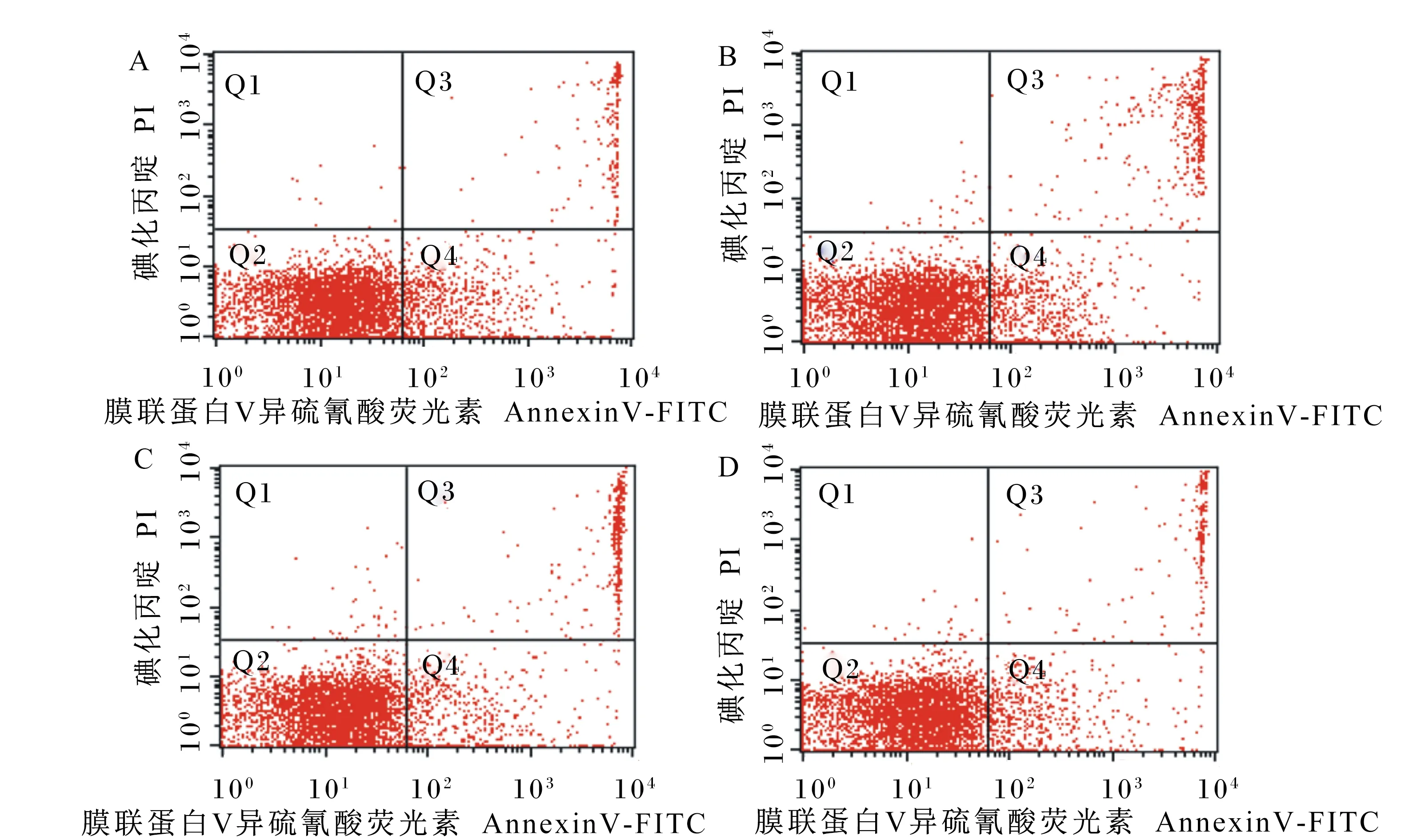
A:对照组;B:10GSPs组;C:20GSPs组;D:40GSPs组。Q1:机械性死亡细胞区域;Q2:晚期凋亡和坏死细胞区域;Q3:活细胞区域;Q4:早期凋亡细胞区域。

表4 GSPs对羔羊血清细胞因子及免疫球蛋白含量的影响
3 讨 论
3.1 GSPs对羔羊生长性能及外周血淋巴细胞亚群的影响
在高产奶牛、肉牛和肉羊生产中,通常会采用高精低粗的饲粮结构满足其营养需求。然而,反刍动物长期饲喂高精料饲粮会引起瘤胃发酵及微生物区系的改变,引发机体代谢紊乱,造成酸中毒、脂肪肝、蹄叶炎和全身炎症等[16]。研究发现,与低精料饲粮组相比,饲喂以玉米秸秆为唯一粗饲料的高精料饲粮后,奶牛血液中白细胞和中性粒细胞数量升高,CD4+/CD8+比值显著降低,表明不同饲粮模式对奶牛免疫功能会产生不同的影响[4]。血液中淋巴细胞亚群的变化是衡量机体免疫功能的重要指标,能够反映机体的健康状况。孙国庆等[5]研究发现,随着日龄的不断增加,羔羊血液中CD4+T淋巴细胞含量逐渐升高,之后趋于稳定状态,此时机体处于免疫功能最佳状态。CD8+T细胞比例越高,CD4+/CD8+比值越低,表明机体的免疫能力越弱。在人医临床上,CD4+/CD8+比值大小常作为病毒感染、肿瘤或其他造成免疫功能降低的疾病临床诊断的重要指征[17-18]。本研究中,羔羊的基础饲粮精料比例为70%,正试期第30天和第45天各组羔羊外周血中CD4+细胞比例在数值上比第1天均有所升高,可能与羔羊日龄增加有关;各组羔羊的CD8+细胞比例在数值上也较第1天有明显的增加,说明饲喂高精料可能使羔羊的免疫机能降低。试验组给羔羊饲喂不同水平GSPs,饲喂30和45 d后外周血淋巴细胞亚群有所改善,20GSPs和40GSPs组羔羊CD4+T细胞比例较对照组显著增加,CD8+T细胞比例较对照组低,说明一定水平的GSPs可以缓解羔羊长期采食高精料造成的CD8+T细胞比例增加的免疫反应。据报道,GSPs具有很强的抗氧化、抗炎功能[19],同时具有一定的免疫调节功能[20]。茶多酚可以提高断奶仔猪血液中CD4+T淋巴细胞的比例,抑制T细胞向CD8+分化,缓解氧化应激造成的仔猪免疫功能紊乱[21]。木其尔[9]研究发现,沙葱黄酮可以降低肉羊外周血中CD8+T细胞比例,提高CD4+T淋巴细胞的比例及CD4+/CD8+比值,改善肉羊的免疫功能。张海军等[20]研究表明,适量的葡多酚可以改善肉仔鸡免疫功能,但高水平葡多酚(>15 mg/kg饲粮)会降低各类淋巴细胞的数量,影响肉仔鸡的生长性能。本课题组前期研究也发现,适量的GSPs可以提高羔羊的平均日增重和育肥末体重,但40GSPs组羔羊的平均日增重和平均日采食量低于20GSPs和10GSPs组[15],一方面原因可能是适量的GSPs发挥其天然抗氧化功能,有效清除机体自由基[6],降低高精料饲粮引起的羔羊氧化应激,提高羔羊的免疫力,有利于羔羊的健康;另一方面原因可能是因为酚类物质降低了饲粮蛋白质在瘤胃中的降解率,增加了小肠中可消化饲粮蛋白质的比例[22],为机体提供了充足的代谢蛋白质。而高水平的GSPs会抑制瘤胃微生物活性,从而抑制羔羊采食和生长[23]。
3.2 GSPs对羔羊外周血淋巴细胞转化率和凋亡率的影响
在机体免疫应答过程中,淋巴细胞增殖分化程度与机体的免疫应答水平有直接关系。T淋巴细胞表面有多种受体存在,在受到特异性抗原或特异性有丝分裂原(如ConA)作用时,细胞代谢会加强,体积变大,转化为原淋巴细胞。研究表明,机体在应激状态下T淋巴细胞转化显著被抑制[24]。房群[25]研究表明,大量自由基的攻击会引起体内T淋巴细胞转化率下降,通过给大鼠补充适量的抗氧化剂可以提高机体的抗氧化能力,可以改善淋巴细胞膜的流动性,提高淋巴细胞物质转运、信号传导的功能,提高大鼠外周血淋巴细胞转化率。木其尔[9]研究显示,沙葱黄酮可以有效提高肉羊T淋巴细胞转化率。在幼犬的饲粮中添加适量(0.3%或0.5%)的茶多酚,可以提高幼犬的抗氧化能力和淋巴细胞转化率,改善幼犬的健康状况[26]。本研究中,羔羊长期采食高精料饲粮可能引起机体的氧化应激和炎症反应[27],而补饲GSPs后机体的抗氧化能力有所改善[28],机体抗氧化能力的改善可能有助于淋巴细胞转化率的提高。因此,本研究中20GSPs和40GSPs组淋巴细胞转化率显著高于对照组,说明GSPs对羔羊细胞免疫水平有一定的调控作用。
细胞凋亡是正常细胞在生理和病理的刺激下发生的一种自发性死亡过程。机体可以通过细胞凋亡来清除衰老的细胞,保持机体细胞的正常新陈代谢。机体在维持免疫稳态的过程中,淋巴细胞凋亡发挥着关键作用。淋巴细胞的凋亡和增殖调控是一个复杂的过程,受多种细胞因子、激素以及外界环境诱因(如温度、药物、感染、射线等)的调控。有研究表明,热应激能显著提高奶牛的外周血淋巴细胞凋亡率,造成机体一定程度的免疫抑制[29]。雏鸡发生铜中毒时,血液和免疫器官中淋巴细胞凋亡率均会显著升高[30],机体免疫功能下降。刘玉娟等[31]研究表明,葡多酚可以有效缓解X射线引起的人外周血淋巴细胞凋亡,对淋巴细胞辐射损伤有良好的保护作用。红松球果多酚类化合物可以改善患肿瘤小鼠的脾脏组织损伤,降低脾脏淋巴细胞的凋亡率,改善小鼠的免疫功能[32]。本研究中,20GSPs和40GSPs组淋巴细胞凋亡率较对照组显著降低,说明GSPs一定程度上改善了高精料引起的机体免疫功能下降。但木其尔[9]研究发现沙葱黄酮一定程度上提高了肉羊的淋巴细胞凋亡率,造成研究结果不一致的原因尚不明确,可能与试验动物机体氧化应激程度和免疫功能水平不同有关。
3.3 GSPs对羔羊血清细胞因子和免疫球蛋白含量的影响
淋巴细胞可以分泌多种细胞因子,其中IL-2和IFN-γ主要由CD4+T细胞中的炎症性T细胞分泌。IL-4则主要由CD4+T细胞中的辅助性T细胞产生。炎症性T细胞的主要功能是激活T细胞,参与细胞免疫;辅助性T细胞的主要功能是促进B淋巴细胞增殖和产生抗体,参与体液免疫。机体在氧化应激时T淋巴细胞的活性降低,血清中IL-2含量降低,淋巴细胞转化率降低[33],免疫球蛋白含量降低[34]。有研究表明,茶多酚可以有效缓解断奶仔猪的氧化应激,增加CD4+T细胞比例,提高血清IL-2和IL-4含量,提高机体细胞免疫功能[19]。GSPs可以提高血清中IgG、IgM含量,提高机体体液免疫功能[35]。Iqbal等[36]报道,利用原花青素替代维生素E饲喂肉仔鸡可以提高肉仔鸡的抗氧化能力和抗体效价。本研究中,长期采食高精料可能引起羔羊机体氧化应激以及胃肠道上皮黏膜损伤,引起机体炎症反应。GSPs对血清中IL-2和IFN-γ含量影响不显著,而血清中IL-4含量随着GSPs添加水平的增加线性升高,说明GSPs促进了CD4+细胞向Th2细胞分化,进一步促进B淋巴细胞产生抗体,提高血清IgG含量。此外,GSPs抑制T细胞向CD8+细胞分化,使机体细胞免疫和体液免疫得到改善。然而,Correddu等[37]报道,给泌乳母羊饲喂葡萄籽(300 g/d)会轻微降低母羊血清中IgG含量,降低CD4+/CD8+比值,引起一定的免疫抑制。因此,我们推测适量的GSPs有助于提高机体的抗氧化能力和免疫功能,而原花青素的摄入量超过一定水平后可能造成免疫抑制。
4 结 论
适量的GSPs可以提高羔羊平均日增重,提高外周血淋巴细胞中CD4+T细胞比例及CD4+/CD8+比值,促进淋巴细胞转化,提高血清IgG含量。综上所述,适量的GSPs可以改善羔羊生长性能和免疫功能,本试验条件下,GSPs的适宜添加水平为20 mg/(kg BW·d)。

