弓形虫微线体蛋白MIC9的原核表达及免疫反应性分析
张梓轩,黄武琴,郑百利,于金玲,史丽华,李冰,刘孝刚
(锦州医科大学畜牧兽医学院,辽宁 锦州 121001)
弓形虫病是由弓形虫属的刚地弓形虫(Toxoplasmagondii)引起的一种重要人畜共患寄生虫病,特别是当宿主免疫力下降时更容易感染发病,是一种重要机会性致病原虫[1-2]。弓形虫宿主范围十分广泛,能感染包括人在内的所有温血动物[3]。弓形虫病呈世界性分布,据相关文献报道,全世界大约有1/3的人类被弓形虫感染,欧美人群的感染率达到25%~50%,个别国家高达80%。最新的一项调查结果显示,我国普通人群弓形虫抗体阳性率为8.2%,孕妇为8.6%[4]。在动物感染方面,我国部分地区绵羊、鸡弓形虫的平均感染率分别为13.87%、19%[5],辽宁省猪的血清阳性率为11.3%[6]。该病不仅对人类健康构成严重的威胁,同时也能导致动物的广泛感染和发病,给畜牧业造成巨大的经济损失。
微线体蛋白(MIC)是由位于弓形虫前端的微线体所分泌,在弓形虫黏附和侵袭宿主的过程中起到十分重要的作用[7]。目前已知的微线体蛋白有27种,包括 MIC1~MIC17、顶膜抗原(AMA1)、枯草杆菌蛋白酶(SUB1)、菱形体蛋白(ROM1)、金属蛋白酶(TLN4)、可变性血小板反应蛋白(SPATR)等,目前关于MIC1~MIC8等微线体蛋白的研究报道较多,而针对MIC9的研究较少[8]。本研究对微线体蛋白MIC9进行克隆和表达,并对其免疫反应性进行分析,为MIC9蛋白免疫功能等后续相关基础研究及临床应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 虫株、菌株和质粒
弓形虫RH虫株由本实验室保存提供,克隆菌株DH5α和表达菌株大肠杆菌BL21购于宝生物工程(大连)有限公司,表达载体pGEX-4T-1购于武汉淼灵质粒有限公司。
1.1.2 主要试剂
血液/细胞/组织基因组DNA/RNA提取试剂盒(离心柱型,货号:DP315)、质粒小量提取试剂盒(货号:D1100),购于天根生化科技有限公司;琼脂糖凝胶DNA回收试剂盒、2×Taq酶、反转录试剂盒,购于北京康为世纪生物科技有限公司;pMD-18T载体、内切酶EcoRⅠ和SalⅠ、T4连接酶,购于宝生物工程(大连)有限公司;异丙基硫代半乳糖苷(IPTG)、5×蛋白上样缓冲液、2×蛋白上样缓冲液、DL2000 DNA Marker、DL5000 DNA Marker,购于北京索莱宝科技有限公司;预染蛋白Marker,购于碧云天生物技术;聚偏二氟乙烯膜(PVDF),购于美国密理博;弓形虫RH株鼠源全虫多克隆抗体(货号:GTX36747),购于LifeSpan BioSciences;谷胱甘肽S-转移酶(GST)标签单克隆抗体、辣根过氧化物酶(HRP)标记山羊抗鼠lgG,购于凯基生物;增强化学发光法(ECL)发光显色液,购于上海天能。
1.2 方法
1.2.1 引物设计
利用Oligo 7软件参照已公布的MIC9蛋白基因序列(GenBank:XM_018780746.1)设计1对引物,2条引物5′端分别插入EcoRⅠ和SalⅠ限制酶切位点(下划线处),引物由上海生工生物工程股份有限公司合成。上游引物:5′-GCAGGAATTCATGAGGGTTTCGTTTAACGTAC-3′,下游引物:5′-GCAGGTCGACTCAATACATTCCTTCAAAATCG-3 ′。
1.2.2 弓形虫MIC9基因PCR扩增
用DNA/RNA提取试剂盒提取弓形虫RH株总基因组,并对基因组进行反转录,用本研究设计的引物进行PCR扩增,同时设阴性对照。反应体系50 μL:模板5 μL、2×Taq酶25 μL、上游引物和下游引物各2 μL、ddH2O 16 μL。反应条件:94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃总延伸5 min。
1.2.3 MIC9基因重组克隆质粒的构建及测序
用琼脂糖凝胶纯化回收试剂盒回收目的片段,然后将目的片段与pMD-18T载体连接后,转化到大肠杆菌DH5α感受态细胞中,提取质粒,进行EcoRⅠ、SalⅠ双酶切鉴定,并将鉴定正确的重组克隆质粒进行测序。
1.2.4 MIC9基因片段的原核表达载体构建
用EcoRⅠ、SalⅠ双酶切pGEX-4T-1原核表达载体,胶回收载体片段。将重组克隆质粒双酶切后获得的目的片段胶回收产物和pGEX-4T-1载体的酶切胶回收产物用T4连接酶16 ℃连接过夜,将连接产物转化到感受态细胞大肠杆菌 BL21,然后提取重组质粒并进行EcoRⅠ、SalⅠ双酶切鉴定,用1.5%的琼脂糖凝胶电泳检测鉴定结果。
1.2.5 重组蛋白MIC9在大肠杆菌中的表达分析
将鉴定正确的重组质粒转化到大肠杆菌BL21感受态细胞中,IPTG(终浓度为1.5 mmol/L)37 ℃诱导表达6 h,同时设置对照组,对照组不加入IPTG,其余条件均一致。分别取诱导和对照组菌液1 mL,12 000 r/min离心1 min,弃上清,加入1 mL PBS重悬沉淀,10 000 r/min 离心1 min,弃上清,清洗3次。菌体沉淀用40 μL ddH2O重悬,加入10 μL 5×SDS上样缓冲液二硫苏糖醇(DTT),混匀后,沸水煮5 min,冷却至室温;10 000 r/min 离心1 min,取10 μL上清进行 SDS-PAGE分析表达产物。
1.2.6 Western blot对重组蛋白MIC9的验证与分析
1.2.6.1 GST标签抗体进行Western blot验证
取MIC9蛋白样品进行SDS-PAGE检测,电泳结束后,以GST标签抗体作为一抗,以HRP标记山羊抗鼠IgG抗体为二抗进行Western blot检验,验证重组蛋白的表达情况。
1.2.6.2 用弓形虫全虫抗体进行Western blot验证
取蛋白样品进行SDS-PAGE检测,电泳结束后,以弓形虫全虫抗体作为一抗,以HRP标记山羊抗鼠IgG抗体为二抗进行Western blot检验,对重组蛋白的免疫反应性进行检验和分析。
2 结果与分析
2.1 弓形虫RH株MIC9基因PCR扩增
以弓形虫RH株总DNA作为模板,用本研究设计的引物进行PCR扩增,凝胶电泳结果显示,扩增出1条约900 bp的条带,与预期目的片段大小相一致,结果如图1。
2.2 MIC9基因重组克隆质粒的构建及测序
将MIC9基因片段连接到pMD-18T载体,提取质粒经双酶切获得约2 000和900 bp的2个片段,与预期结果一致,详见图2。阳性质粒测序获得有效核苷酸903 bp,与预期结果一致,测序结果已上传到NCBI数据库,并获得基因编号: MK704431。经BLAST比对,与基因数据库中已有的4条弓形虫MIC9基因序列同源性均在99%以上,具体比对结果如下:与其中3条基因(MK704432.1、XM-018780746.1、LN714502.1)的同源性均为99.89%,与另1条基因AF353166.1的同源性为99.11%,证明pMD-18T-MIC9重组质粒构建成功。

M.DL2000 Marker;1. MIC9目的基因扩增片段;2. 阴性对照

M. DL5000 Marker;1. pMD-18T-MIC9质粒;2. pMD-18T-MIC9质粒酶切
2.3 MIC9基因原核表达载体鉴定
用EcoRⅠ、SalⅠ双酶切pGEX-4T-1原核表达载体和pMD-18T-MIC重组质粒,将MIC9基因片段连接到pGEX-4T-1载体,提取质粒经双酶切鉴定,获得约4 000和900 bp的2个片段,与预期结果一致,阳性质粒测序结果插入片段为903 bp,无基因突变,证明pGEX-4T-1-MIC9原核表达载体构建成功。详见图3。
2.4 重组蛋白MIC9在大肠杆菌中的表达
用1.5 mmol/L的IPTG诱导表达6 h,菌体蛋白(上清液)经SDA-PAGE检测显示,MIC9重组蛋白样品和空载分别在59 kDa(含标签蛋白)和26 kDa处有明显蛋白表达条带,表明成功诱导出MIC9重组蛋白,其结果如图4。
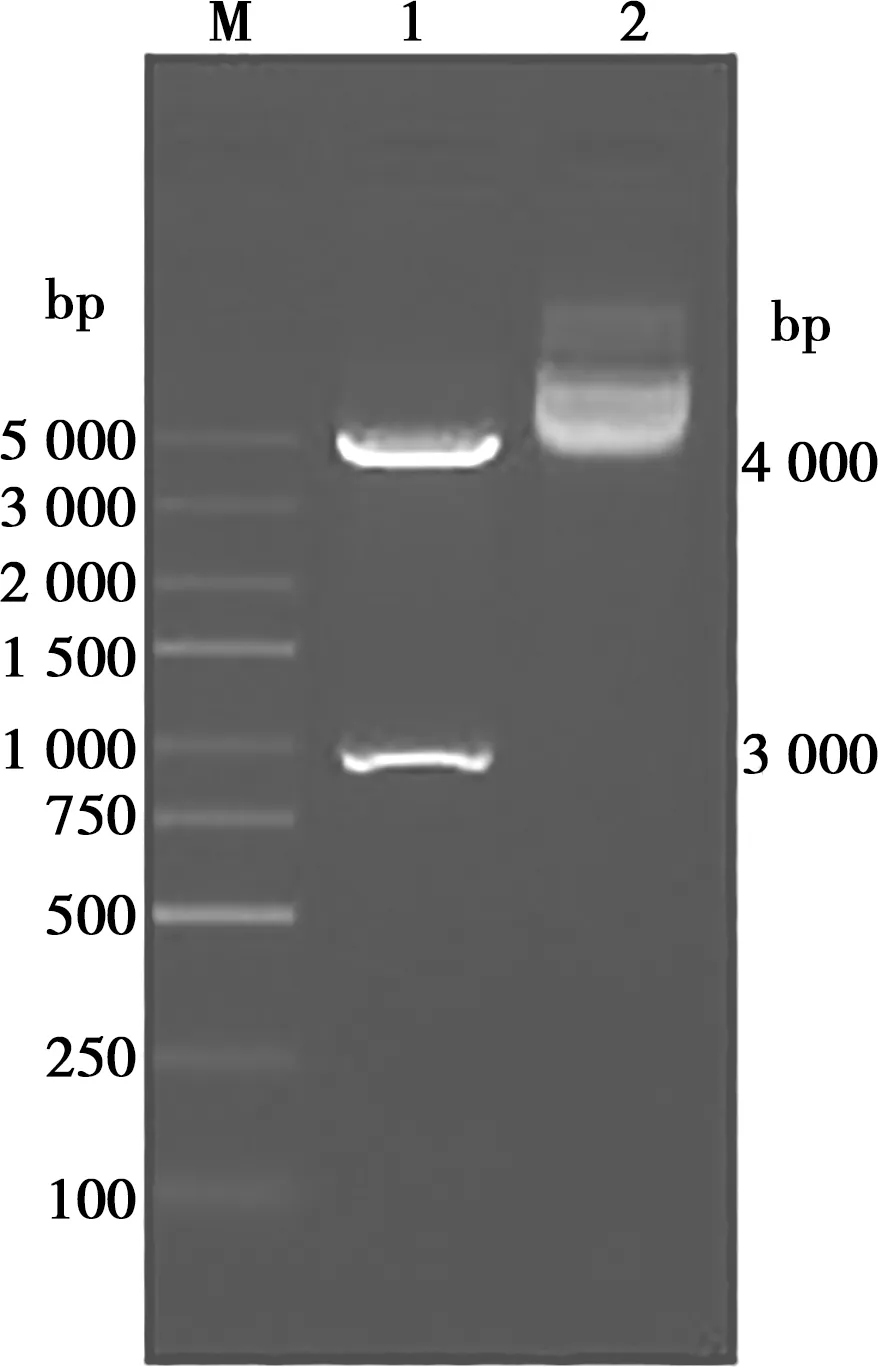
M. DL5000 Marker;1. pGEX-4T-1-MIC9质粒双酶切;2. pGEX-4T-1-MIC9质粒

M.蛋白质Marker;1.诱导菌体蛋白;2.未诱导菌体蛋白;3. pGEX-4T-1载体诱导;4. pGEX-4T-1未诱导
2.5 MIC9重组蛋白的GST标签抗体Western blot验证
重组蛋白pGEX-4T-1-MIC9(上清液)经SDS-PAGE检测结束后,采用半干转方法用转膜仪将凝胶上的蛋白转印到PVDF膜上,用GST单克隆抗体为一抗进行Western blot验证,其显影结果表明诱导后的重组蛋白MIC9和GST标签载体的目的蛋白处均有1条59 kDa(含GST标签)和26 kDa大小的目的蛋白条带,证明重组蛋白MIC9成功表达,如图5。
2.6 MIC9重组蛋白弓形虫全虫抗体Western blot验证
将重组pGEX-4T-1-MIC9蛋白转印到PVDF膜上,用弓形虫全虫抗体为一抗进行Western blot验证,其结果表明经诱导后的重组pGEX-4T-1-MIC9蛋白有预期的目的蛋白条带(59 kDa),能被弓形虫全虫抗体特异性识别,证明重组蛋白MIC9具有免疫反应性,如图6所示。
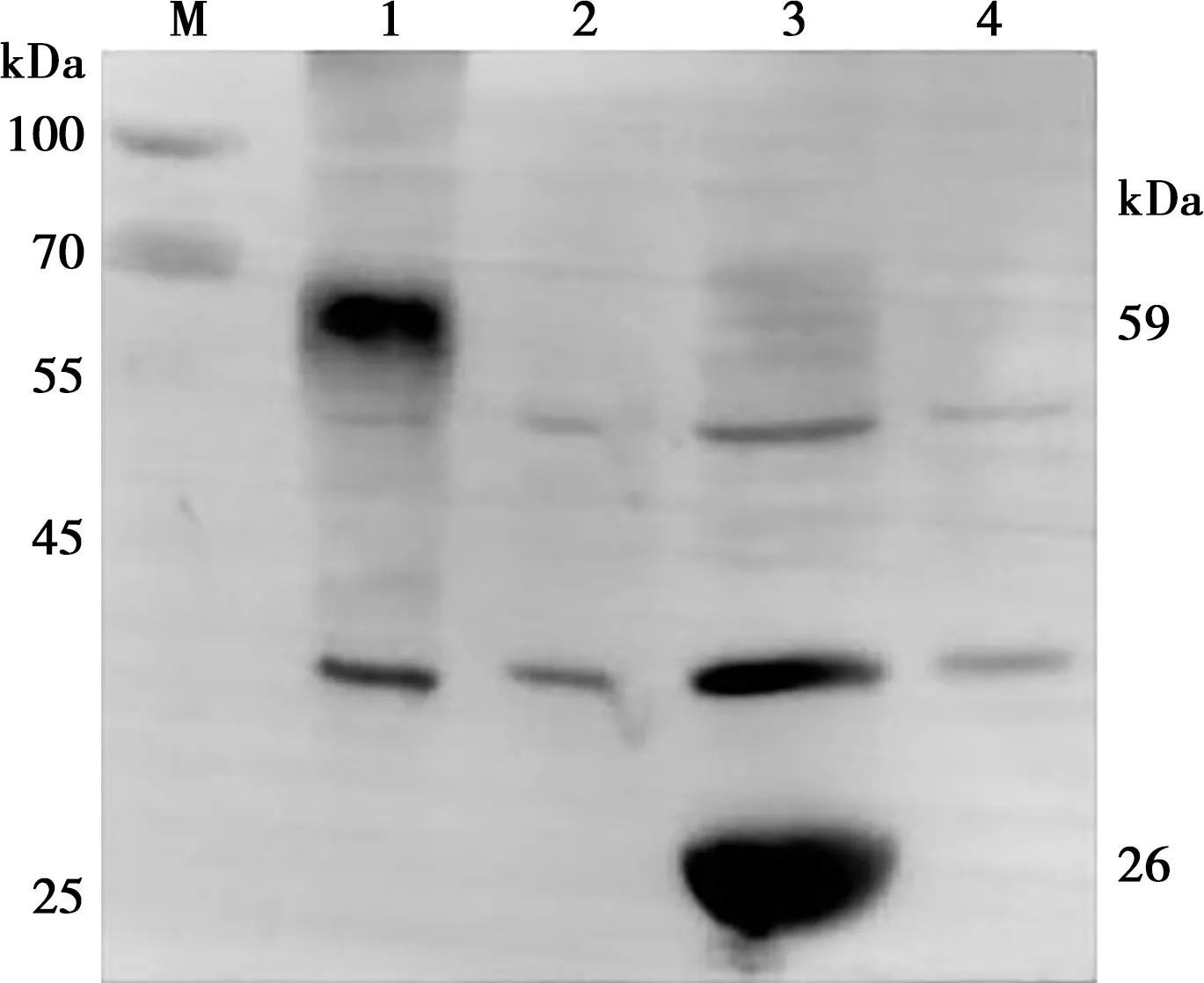
M.蛋白质Marker;1. 诱导菌体蛋白;2. 未诱导菌体蛋白;3. pGEX-4T-1载体诱导;4. pGEX-4T-1空载体未诱导

M. 蛋白质Marker;1. 诱导菌体蛋白;2. 未诱导菌体蛋白
3 讨论
微线体是位于弓形虫前部的分泌器官。所有微线体蛋白均在粗面内质网内合成,再经高尔基体到达微线体中贮存,最后分泌到虫体表面,在识别、黏附、侵入宿主细胞的过程中发挥重要的作用[9]。在微线体蛋白的合成、运输和分泌过程中,多种微线体蛋白会结合起来,以复合体的形式发挥作用[10]。除上述功能外,某些微线体蛋白(MIC1、MIC3、MIC4、MIC6、MIC8等)具有一定的免疫功能,是弓形虫的疫苗候选分子[11]。
关于MIC1-8等微线体蛋白的研究报道较多,而针对MIC9的研究较少[7]。目前已知MIC9具有跨膜结构,含有表皮生长因子样结构域,能够在包囊内慢殖子期表达,关于微线体蛋白MIC9其他方面的信息报道较少[12]。
本研究成功扩增出大小为903 bp的MIC9基因片段,在大肠杆菌中成功表达,经免疫学鉴定,MIC9重组蛋白能够被弓形虫全虫抗体特异性识别,证明重组蛋白MIC9具有良好的免疫反应性。本研究结果为微线体蛋白MIC9相关基础研究及临床疫苗的研究提供了参考。

