不同月份产羔母羊泌乳期生殖激素与生长激素监测
赵晓娥,张静,高臻,孙念琴,徐明辉,李延华,马保华*
(1. 西北农林科技大学动物医学院/农业部动物生物技术重点实验室,陕西 杨凌 712100;2. 许昌百益奶山羊养殖场,河南 许昌 461000;3. 富平县畜牧技术推广中心,陕西 富平 711700)
在我国北方地区,传统的奶山羊生产周期是秋季配种、春季产羔,经过6~8个月的泌乳期后,在干奶期之前进入下一年度的繁殖和生产周期。在这种生产模式下,奶山羊每年都有相对固定的配种、产羔、泌乳周期,其中鲜奶供应周期大约固定在每年的1~8月份。为了满足奶山羊养殖场对市场全年供应鲜羊奶的需求,通过同期发情与诱导发情的方法可以使奶山羊在不同季节妊娠、产羔及产奶。奶山羊的发情、排卵、妊娠和泌乳受体内生殖激素的调控[1],其泌乳期间激素水平的动态变化对维持正常泌乳及泌乳后期卵巢机能恢复起重要作用。目前,国内对母羊生殖内分泌的研究主要集中在不同品种母羊发情周期内分泌的变化[2-3],或母羊在不同季节内分泌的变化[4-5]。据报道绵羊、山羊外周血中促黄体生成素(LH)和卵泡刺激素(FSH)浓度均存在着季节性变化,繁殖季节高于非繁殖季节[4-7]。那么,奶山羊在不同季节产羔后,季节性变化是否引起产后母羊生殖激素及生长激素(GH)水平的变化还不清楚。因此,本研究选取1、3、5、8月份生产的关中奶山羊,采集母羊产羔后不同时间的静脉血,分离血清,使用ELISA试剂盒检测血清中激素的变化规律,为调控奶山羊在不同季节配种实现全年均衡产奶提供参考。
1 材料与方法
1.1 试验动物
1.5~4岁的关中奶山羊,选自河南许昌百益奶山羊养殖场,体况良好,无繁殖及传染性疾病,于当年的8、10、12以及次年3月份分4批同期发情及配种处理,于次年的1、3、5、8月份产羔,每批次随机抽取10只产羔母羊,共40只用于试验,舍饲饲养,常规管理。
1.2 试验方法
试验羊分别于产羔后的0 d、7 d、1~8个月(每月的第15天)采集静脉血,1 600 r/min离心12 min,取血清移入2 mL离心管中,-20 ℃冰箱保存待用。分别用上海邦奕生产的羊催乳素(PRL)ELISA试剂盒(BYE80053)、羊FSH ELISA 试剂盒(BYE80199)、羊LH ELISA试剂盒(BYE80054)、羊孕激素(PROG)/孕酮(P4)ELISA试剂盒(BYE80231)和羊雌激素(E2) ELISA试剂盒(BYE93052)测定血清中的生殖激素水平,用羊生长激素释放多肽(GHRP)ELISA试剂盒(BYE80125)对血清中的GH水平进行检测,由上海邦奕生物科技有限责任公司代测。
1.3 数据统计与分析
试验数据采用SPSS 17.0软件进行t检验统计分析,P<0.05表示差异显著。数据以“平均值±标准差”表示。
2 结果与分析
2.1 不同月份产羔母羊泌乳期PRL水平变化
不同月份母羊产后泌乳期PRL水平检测结果如图1所示。
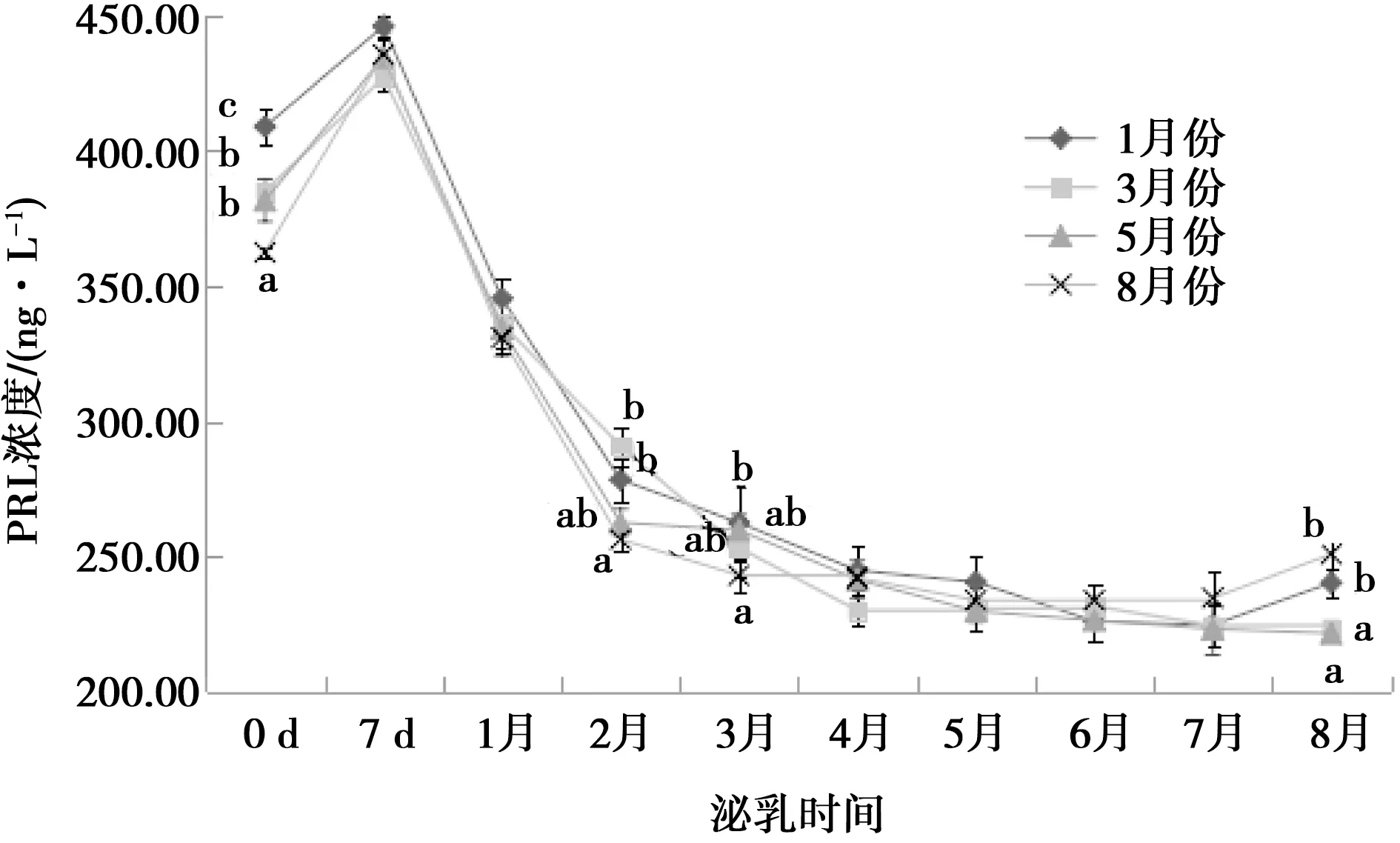
相同泌乳期标注不同字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。下同
1、3、5和8月份产羔母羊泌乳期间血清中PRL含量的动态变化趋势一致,PRL浓度从产后0 d开始上升,7 d达到峰值,之后下降,60 d后缓慢下降,逐渐维持在一定水平波动。泌乳期间PRL浓度最高为(446.17±3.74)ng·L-1,最低为(221.72±2.20)ng·L-1。产后0 d,不同月份产羔母羊外周血中PRL浓度差异较大。8月份产羔母羊,在泌乳2个月时,外周血中PRL含量显著低于1和3月份产羔母羊(P<0.05);在泌乳3个月时,外周血中PRL含量显著低于1月份产羔母羊(P<0.05)。在泌乳8个月时,1月份和8月份产羔母羊外周血中PRL含量显著高于3月份和5月份产羔母羊(P<0.05)。
2.2 不同月份产羔母羊泌乳期FSH水平变化
不同月份产羔母羊泌乳期FSH水平检测结果如图2所示。

图2 不同月份产羔母羊泌乳期FSH水平
1、3、5、8月份产羔母羊在8个月泌乳期间外周血中FSH含量动态变化趋势一致,FSH浓度从产后0 d开始上升,产后7 d达峰值,随后下降,1个月后,稳定在一定浓度范围内浮动。母羊泌乳期间FSH浓度最高为(9.49±0.77)U·L-1,最低为(3.82±0.09)U·L-1。在产后0 d,3月份和8月份产羔母羊外周血中FSH浓度显著高于1月份和5月份产羔母羊(P<0.05)。
2.3 不同月份产羔母羊泌乳期LH水平变化
不同月份产羔母羊泌乳期LH水平检测结果如图3所示。

图3 不同月份产羔母羊泌乳期LH水平
1、3、5、8月份产羔母羊泌乳期外周血中LH含量的动态变化趋势一致,产后1个月内LH浓度持续下降,之后上升,2个月时恢复到产后0 d水平,之后缓慢下降。母羊泌乳期间LH浓度最高为(351.17±8.73)pg·mL-1,最低为(218.16±4.41)pg·mL-1。产后0 d,8月份产羔母羊外周血中LH浓度显著低于其他月份(P<0.05);产后2个月时,1月份产羔母羊外周血中LH的浓度显著高于其他月份(P<0.05)。
2.4 不同月份产羔母羊泌乳期P4水平变化
不同月份产羔母羊泌乳期P4水平检测结果如图4所示。

图4 不同月份产羔母羊泌乳期P4水平
从图4可以看出,1、3、5、8月份产羔母羊泌乳期外周血中P4含量的动态变化趋势一致,产后1周内P4浓度稍有下降,之后逐渐上升,60 d后再次缓慢下降。母羊泌乳期间P4浓度最高为(4 086.83±114.81)pmol·L-1,最低为(3 568.15±33.50)pmol·L-1。产后8个月时,1月份和8月份产羔母羊外周血中P4含量显著高于3月份和5月份产羔母羊(P<0.05)。
2.5 不同月份产羔母羊泌乳期E2水平变化
不同月份产羔母羊泌乳期E2水平检测结果如图5所示。
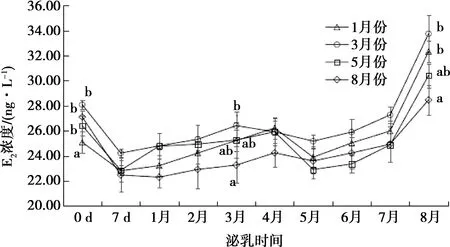
图5 不同月份产羔母羊泌乳期雌二醇水平
1、3、5、8月份产羔母羊泌乳期血清中E2含量的动态变化趋势一致,产后1周内E2浓度下降,之后直到第7个月E2水平维持在一定浓度范围内上下浮动,7个月之后开始上升。母羊泌乳期间E2浓度最高为(33.74±1.48)ng·L-1,最低为(22.30±0.83)ng·L-1。产后0 d,1月份产羔母羊外周血中E2浓度显著低于3月份、5月份和8月份产羔母羊(P<0.05);产后3个月,8月份产羔母羊外周血中E2浓度低于3月产羔母羊(P<0.05);产后8个月,8月份产羔母羊外周血中E2浓度低于1月份和3月份产羔母羊(P<0.05)。
2.6 不同月份产羔母羊泌乳期GH水平变化
不同月份产羔母羊泌乳期外周血中GH水平检测结果如图6所示。
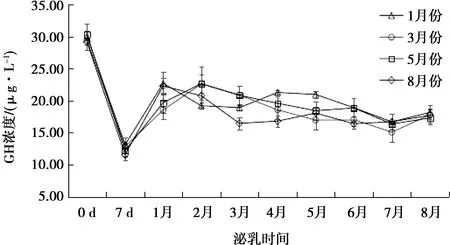
图6 不同月份产羔母羊泌乳期GH水平
1、3、5、8月份产羔母羊泌乳期外周血中GH含量的动态变化趋势一致,GH浓度最高为(30.36±1.67)μg·L-1,最低为(11.57±0.92)μg·L-1。不同月份产羔母羊在产后0 d血清中GH浓度最高,产后7 d最低。1个月后,各批次母羊血清中GH浓度基本稳定在一定范围内上下浮动。
3 讨论
PRL、P4、E2、FSH、LH是母畜产后维持泌乳的主要激素。母羊分娩后开始泌乳,其血清中P4水平开始降低,解除它对PRL的抑制作用使PRL浓度升高,而高水平的PRL及胎盘、卵巢分泌的P4、E2共同作用促进母羊产后泌乳[8]。这与本试验的结果相符。本试验中,母羊从产后0 d开始,外周血中PRL浓度开始升高,E2、P4浓度下降,7 d后,PRL浓度开始降低,E2、P4浓度逐渐升高,继而E2、P4浓度稳定在一定水平上下波动,而PRL仍处于下降趋势,直到3个月之后稳定下来,此时,3种激素稳定分泌以维持母羊正常泌乳。本试验中母羊产羔后7 d FSH升高到较高水平,之后下降,1个月后,维持在一定浓度范围内上下浮动,这符合母畜产后FSH和P4之间的消减规律。母畜在分娩后P4迅速降低解除它对PRL的抑制作用,同时解除丘脑下部对促性腺激素释放激素(GnRH)的分泌,使FSH释放增加,而LH没有像FSH那样在产后7 d时升高,而是下降,可能与高浓度PRL有关。据报道,母畜产后,吮乳刺激能促进母畜PRL分泌[9-10],促进初乳的生成与分泌,引起产奶量增加[11]。高浓度的PRL抑制垂体LH的分泌,即产后母畜外周血LH水平同PRL水平负相关[12]。但吮乳刺激对母畜体内E2、P4和FSH分泌都无明显影响[13]。本试验中,母羊产后,LH开始下降,7 d后,尽管PRL开始下降,但相对于整个泌乳期而言,PRL仍处在较高水平,负反馈调控使LH浓度继续缓慢下降。总之,5种激素共同作用维持母羊产后正常泌乳。
奶山羊在不同月份产羔后,同一泌乳期部分激素水平有差异,这可能与4个批次母羊处于不同的季节有关,即产羔月份的不同对奶山羊激素水平有一定的影响。本试验发现3和5月份产羔母羊从产后7个月开始LH、FSH、P4浓度升高,主要是因为这2个批次母羊在泌乳7个月时,一方面奶山羊进入泌乳后期,另一方面此时正是奶山羊常规繁殖季节秋冬季,母羊处于短日照季节,有利于P4分泌。Suttie等[14]报道,短日照可以加速P4分泌,而长日照明显抑制P4的分泌。P4是一个重要的内分泌信号,它控制着FSH分泌峰的周期性及母羊新生卵泡的数量[15]。即P4对母羊的发情具有“启动”作用,可以促使卵巢从相对静止状态转变为活跃状态,从而使母羊的发情和排卵恢复正常,LH、FSH浓度也上升[16]。因此,这2个批次母羊在泌乳7个月时已恢复正常的发情周期,母羊外周血中FSH、LH和P4浓度升高。
GH的作用是调节母畜的乳腺发育和泌乳活动,反刍奶畜依赖于GH维持其泌乳[17]。家畜GH的分泌受昼夜节律、运动、机体代谢以及应激刺激的影响。本试验中,母羊产后第7天GH下降到最小值,可能的原因与产房内悬挂白炽灯提供昼夜照明有关。为了更好地护理母羊与羔羊,母羊产羔后,饲养工人将母羊关在悬挂白炽灯的产房内,由于母羊长时间处于光照条件下,抑制GH的分泌,当母羊重新回到圈舍,母羊血中GH浓度上升。本研究中,4个批次母羊GH到达峰值时不在同一泌乳阶段,可能的原因是母羊处于不同的季节,昼夜长短不一样,昼夜节律、光照时间对母羊GH分泌的影响。
4 结论
奶山羊在不同月份产羔后,同一泌乳期部分激素水平有差异,这可能与4个批次母羊处于不同的季节有关,即奶山羊在不同月份产羔后,对其激素水平有一定的影响,但是在整个泌乳期间静脉血中PRL、FSH、LH、P4、E2及GH浓度的变化趋势是一致的。因此,奶山羊在不同月份进行配种、产羔对其泌乳期生殖内分泌影响较小,可以对奶山羊进行分批次配种、产羔,实现其全年均衡产奶。

