实时荧光环介导等温扩增快速检测耐甲氧西林金黄色葡萄球菌方法的建立与评价*
赵峻英,董剑,何建春,梅小亿,欧国平
(大足区人民医院 检验科,重庆 402360)
耐甲氧西林金黄色葡萄球菌(multiple-resistant staphylococcus aureus,MRSA)是金黄色葡萄球菌(staphylococcus aureus,SA)的一个独特菌株,对多种抗生素耐药,可引起严重的社区获得性感染和医源性感染[1-2],由于其症状与其他细菌感染无明显差异,临床难以早期针对该菌感染进行精准诊断和治疗。常规的细菌培养方法通常需要2~3 d,甚至更久,难以满足临床的需求,因此,快速、灵敏、准确的MRSA检测手段,是控制其感染和流行的关键[3-4]。本研究拟以环介导恒温扩增技术(loop-mediated isothermal amplification,LAMP)和实时荧光技术相结合,构建实时荧光 LAMP(Rea-LAMP),同时检测葡萄球菌的mecA耐药标志性基因和SA特有的femA基因,并与VITEK2 Compact全自动微生物分析仪鉴定结果进行比较,初步探讨实时荧光 LAMP(Rea-LAMP)方法快速鉴定MRSA在临床应用中的可行性。
1 材料与方法
1.1 材料
1.1.1菌株来源 随机抽取2015年10月—2019年10月经VITEK2 Compact全自动微生物分析仪鉴定并保存于-80 ℃冰箱的68株SA,其中MRSA 37株、MSSA 31株。本研究选择的标准菌株为MSSA(ATCC25923)、MRSA(ATCC43300)、表皮葡萄球菌(ATCC49134)、溶血葡萄球菌(CGMCC1.10528)、人葡萄球菌(ATCC27844)、沃氏葡萄球菌(ATCC17917)、头状葡萄球菌(ATCC 35661)、科氏葡萄球菌(ATCC29974)、路邓葡萄球菌(ATCC700328)、腐生葡萄球菌(ATCC49907)、耳状葡萄球菌(ATCC33753)、产色葡萄球菌(ATCC 43764)、佩氏葡萄球菌(DSM19554)、中间葡萄球菌(ATCC51874)、大肠埃希菌(ATCC25922)、肺炎克雷伯杆菌(ATCC700603)、铜绿假单胞菌(ATCC27853)、鲍曼不动杆菌(ATCC19606)和粪肠球菌(ATCC29212)标准菌株,由国家卫生和计划生育委员会临床检验中心提供。
1.1.2仪器与试剂 DEAOU-308C迪澳恒温荧光检测仪、VITEK2 Compact全自动微生物分析仪、细菌核酸提取试剂盒购自重庆中元汇吉生物技术有限公司,Loopamp DNA扩增试剂盒、梅里埃DENSIMAT比浊仪99234。
1.2 方法
1.2.1细菌基因组DNA提取 将-80 ℃保存的19种标准菌株和68株临床SA菌株接种于血平板上,于37 ℃温箱培养18~24 h,取平板上的菌落于无菌生理盐水中制成麦氏浊度为3.0~4.0的菌悬液1.5 mL,按细菌核酸提取试剂盒说明书操作步骤提取细菌DNA。
1.2.2引物设计与合成 从美国国立生物技术信息中心(national center for biotechnology information,NCBI)网站查找mecA和femA基因序列,并对查找到的基因序列使用Bioedit软件进行比对,根据比对结果选择保守区域利用LAMP引物设计软件PrimerExplorer V5设计引物,引物序列由英潍捷基上海贸易有限公司合成。见表1。

表1 SA的Rea-LAMP检测体系引物
1.2.3Rea-LAMP反应体系 将合成的引物序列F3、B3、FIP、BIP、LF、LB按1 ∶1 ∶8 ∶8 ∶4 ∶4混合配制引物混合液,然后取引物混合液1 μL进行Rea-LAMP反应,总反应体系25 μL:引物1 μL,2X反应液12.5 μL,链置换DNA聚合酶(Bst DNA polymerase)8U,待检菌株DNA 2 μL,SYBR 0.5 μL,超纯水补足至25 μL,在恒温荧光检测仪中进行反应(63 ℃,1 h)。
1.2.4特异性试验 按1.2.1方法将提取的MRSA和MSSA及其他17种革兰阳性和阴性标准菌株的全基因组DNA,按照Rea-LAMP的反应条件进行扩增,分析检测信号并观察熔解曲线,评价该体系引物的特异性。
1.2.5灵敏度试验 测量提取的MRSA标准菌株全基因组DNA模板浓度,将浓度为1 mg/L的MRSA基因组DNA用超纯水进行10倍梯度稀释4次,得到5个不同浓度的DNA模板(1 000、100、10、1和0.1 μg/L),加入Rea-LAMP反应体系中进行反应,观察扩增曲线,确定引物最低检出限。
1.2.6重复性试验 将MRSA和MSSA标准菌株作为阳性菌株,其余17种标准菌株作为阴性菌株,分别进行3次Rea-LAMP重复性试验,所有标准菌株重复性试验所用模板为同一模板。
1.2.7临床菌株的检测 用Rea-LAMP试验体系对68株SA进行检测,并与VITEK2 Compact全自动微生物分析仪鉴定结果进行比较。
2 结果
2.1 特异性检测结果
MRSA标准菌株出现femA和mecA基因扩增曲线,MSSA标准菌株出现femA基因扩增曲线,其余17种病原菌的标准菌株未出现femA或mecA基因扩增曲线。扩增过程未出现引物二聚体的干扰,熔解曲线无杂峰。见图1。
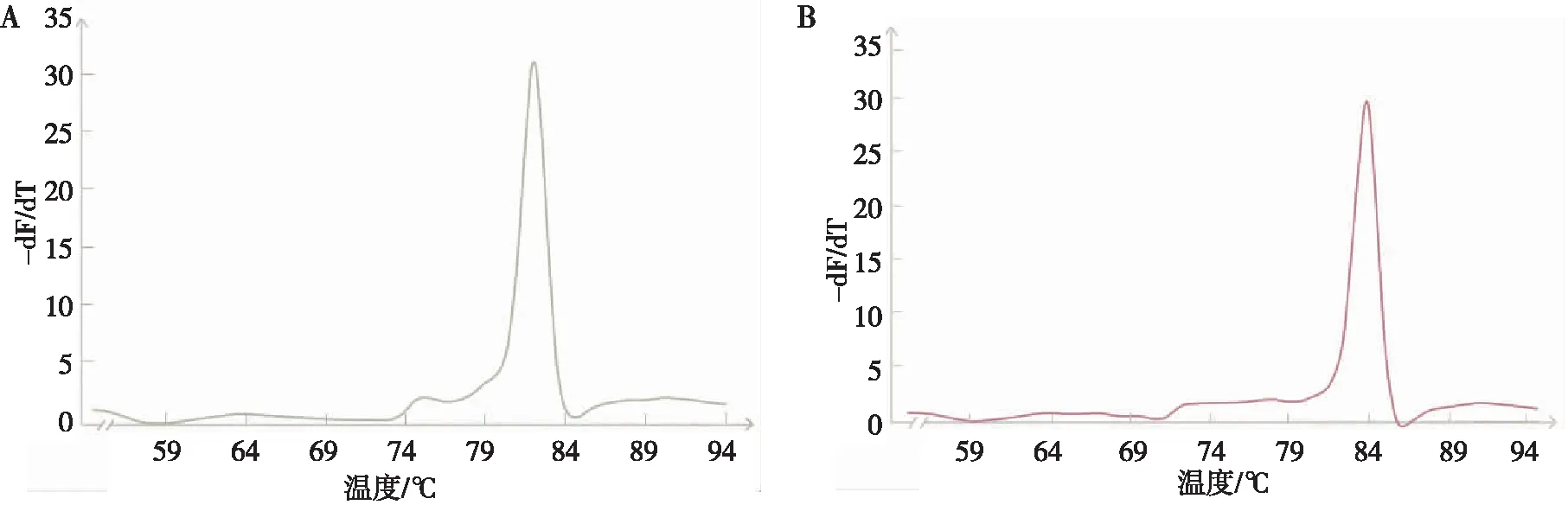
注:A为femA基因熔解曲线,B为mecA基因熔解曲线。
2.2 MRSA灵敏度试验结果
本研究体系显示1 μg/L MRSA基因组DNA约23 min出峰,出现扩增曲线,此浓度为本研究体系的最低检测限,见图2。
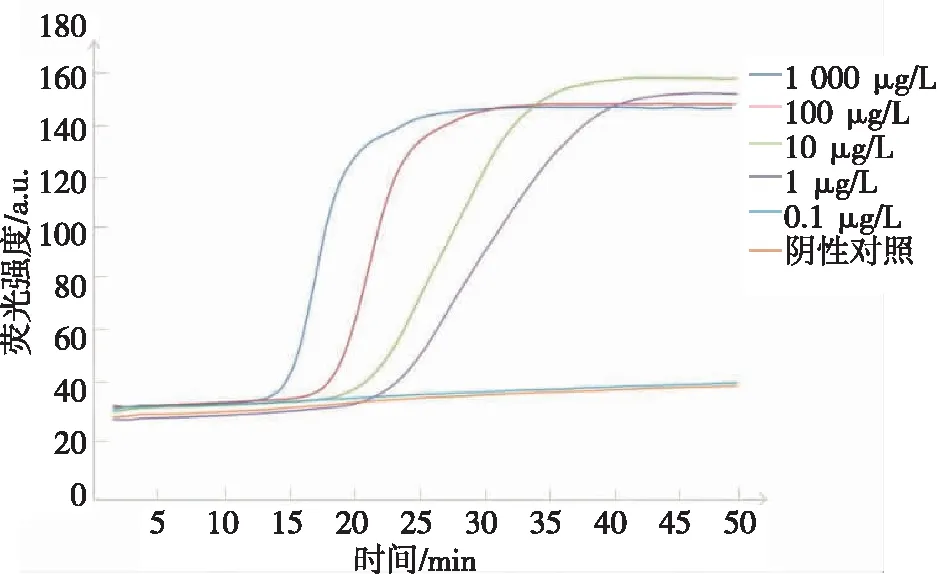
图2 MRSA灵敏度检测
2.3 各菌株重复性试验结果
MRSA和MSSA各自的3个重复管几乎同时出峰且扩增曲线几乎重叠,其余菌株各自的3个重复管均无扩增曲线。
2.4 临床菌株检测结果
结果显示,对68株临床菌株检测结果与VITEK2 Compact全自动微生物分析仪鉴定结果一致,见表2。

表2 本研究测试结果与VITEK2 Compact全自动微生物分析仪鉴定结果比较
3 讨论
MRSA一直以来是全球引起感染性疾病的重要病原菌之一,其耐药性严重、耐药机制复杂,使得临床感染死亡率增高,成为当今感染医学的一个难题[5-7]。
相关研究证明,MRSA菌株的耐药性主要由mecA基因介导[8-9],其编码产生的青霉素结合蛋白2a(PBP2a)使菌株对β-内酰胺类抗生素的亲和力明显降低,从而使细菌产生耐药性[10-12]。故SA一旦获得mecA基因,便可表现为高度和多重耐药。
femA基因为SA所特有的基因,也是MRSA耐药性的辅助基因[13-14],在MRSA中,femA基因启动子或调控区域的插入,可使细菌细胞壁成分或结构发生改变,协助mecA基因降低对β-内酰胺类抗生素的敏感性,从而导致对甲氧西林耐药[15-16]。
对于临床实验室而言,选择合适的检测方法,准确及时地发出检验报告尤为重要。LAMP是2000 年,由日本学者Notomi等[17]提出的一种恒温核酸扩增技术,其特点是反应快、特异性强、灵敏度高、检测成本低以及操作简单等,被广泛应用于分子诊断技术中[18-22]。本研究基于LAMP的基本原理,在mecA和femA基因序列上设计6条引物:2条外引物(F3、B3)、2条内引物(FIP、BIP)和2条环引物(LF、LB),特异性识别mecA和femA基因序列上的6个独立区域,启动循环链置换反应。内引物杂交在目标DNA区域,启动互补链的合成,再通过外引物在同一链上互补序列,这样周而复始形成有很多茎-环DNA混合物。环引物提高了反应灵敏度,缩短了反应时间,从而实现对目的DNA序列的快速扩增。同时,在反应体系中加入了SYBR荧光染料,反应过程在DEAOU-308C迪澳恒温荧光检测仪中进行,可对整个反应过程进行实时动态检测。
本研究将LAMP的快速性和实时荧光的敏感性有机结合起来建立了Rea-LAMP检测MRSA的新方法,主要特点包括以下5个方面。(1)特异性强,在靶基因mecA和femA的6个不同的区域设计了6条不同引物,要使目标序列快速扩增,引物必须与靶序列的6个区域严格识别配对,不受非目标DNA的干扰。本实验选取了MRSA、MSSA和17种其他常见病原菌的全基因组DNA同时作为模板在Rea-LAMP检测体系中扩增,仅MRSA和MSSA出现相应的扩增曲线。(2)检测灵敏度高,本Rea-LAMP检测体系的灵敏度达1 μg/L。(3)速度快,1 h以内即可完成检测,大大缩短了检测周期。常规的细菌培养的检测方法通常需要2~3 d,甚至更久,本研究与常规的细菌培养和鉴定方法相比时间大大缩短,与普通的PCR方法相比省去了PCR模板的高温变性和低温退火步骤,节约了温度变化导致的时间耗损。(4)稳定性好,MRSA和MSSA作为阳性样品,各自的3个重复管几乎同时出峰且扩增曲线几乎重叠,说明该反应体系具有良好的稳定性。(5)实时动态检测,本研究体系通过收集荧光信号,可对扩增体系进行实时动态检测,及时跟踪检验结果。同时,由于本研究的荧光染料SYBR在反应前加入,避免了实验反应结束后开盖导致气溶胶污染。
在临床菌株检测中,同时出现mecA和femA扩增曲线的为MRSA,只出现femA扩增曲线的为MSSA。所检测的临床68株SA中,检测出MRSA37株,MSSA31株,与VITEK2 Compact全自动微生物分析仪鉴定结果一致。由于本研究体系所检测的临床菌株数量有限,需增加菌株的数量做进一步的验证。本研究只是定性检测,下一步需要将尝试设计标准曲线用于定量检测。本研究只能检测mecA和femA基因,对与MRSA耐药机制有关的其他基因如mecC基因等[23-25]无法检出。也无法区分MRSA和MSSA感染或定植。
综上所述,虽然本研究的Rea-LAMP检测MRSA的体系具有一定的局限性,但具有特异性强、稳定性好、灵敏度高、操作简单快捷的特点,并且能够实时动态观察检测结果,可为MRSA提供一种新的的快速检测方法。

