PYCR1基因在肝细胞癌中的表达及与预后的关系
程秋华 周帅 向杨 杨树龙 符国珍
中南大学湘雅医学院附属海口医院肝胆外科(海口570208)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌,在肝硬化患者中多见[1]。在过去的二十年中,HCC 的发病率和死亡率居高不下,大多数HCC 患者发生在东亚、东南亚和非洲等地区[2]。HCC 患者5 年生存率仅在5%左右,临床预后不佳[3]。目前,HCC 的具体发病机制仍不明确。因此,更好地了解病因和进展过程中的关键因素和调控途径,对新的预后指标和治疗靶点的预测以及HCC 患者临床治疗的改善具有重要意义。
脯氨酸在细胞增殖、凋亡及自噬中扮演重要角色[4]。PYCR1 能够催化NADP 依赖的吡咯啉-5-羧酸转化成脯氨酸,在脯氨酸的生物合成中发挥重要作用[5]。有研究[6]指出,人类PYCR1 基因突变可引起皮肤松弛症。此外,PYCR1 基因在结肠癌、肺癌、乳腺癌、前列腺癌等恶性肿瘤中与肿瘤发生、发展、转移及化疗敏感性相关[7-10]。最近一项研究[11]报道指出,HCC 组织中PYCR1 mRNA 和蛋白水平均显著高于癌旁组织。然而,HCC 患者中PYCR1 表达与临床病理特征和预后的关系尚不清楚。本研究通过探讨PYCR1 表达水平与患者临床病理特征和预后的关系,为HCC 患者临床治疗靶点选择提供循证医学证据。
1 对象与方法
1.1 研究对象80例HCC患者病理标本均为中南大学湘雅医学院附属海口医院肝胆外科2015 年1 月至2018 年12 月收集,随访资料完整。本研究获得医学伦理委员会批准,研究对象均知情同意。
1.2 主要试剂和仪器总RNA提取试剂盒(DP419,TIANGEN,北京);qRT-PCR 反转录试剂盒(FP314,TIANGEN,北京);SYBR@Premix Ex TaqTMII 试剂盒(RR820A,TaKaRa,大连);PYCR1 抗体和GAPDH抗体(ab102601/ab8245,Abcam,美国);甲胎蛋白(Alpha-fetoprotein,AFP)检测试剂盒(LT5020401,蓝图生物,黄石);癌胚抗原(Carcinoembryonic antigen,CEA)检测试剂盒(YKE-C14,研科生物,广州)。
1.3 PYCR1 mRNA 表达水平测定利用总RNA提取试剂盒采用离心柱法提取HCC 及癌旁组织总RNA;A260/A280范围为1.8 ~2.0,计算mRNA 浓度;将琼脂糖变性凝胶电泳检测完整性良好的RNA按照qRT-PCR 反转录试剂盒说明逆转录为cDNA,-20 ℃冰箱保存待用;以β-actin 为内参基因,PYCR1 引物序列为:上游5′-CGCCGACATTGAGGACAGAC-3′,下游5′-CGACTGGAGTGTTGGTCATGC-3′,根据SYBR@Premix Ex TaqTMII 试剂盒说明书进行荧光定量PCR 扩增反应。结果以2-△△Ct方法计算,实验独立重复3 次。
1.4 PYCR1 蛋白表达水平测定HCC 及癌旁组织蛋白采用蛋白裂解法收集;BCA 法检测蛋白含量,确保各孔上样量相等,进行垂直电泳,转膜,TBS 漂洗,封闭液封闭2 h;加入兔抗人PYCR1 和GAPDH 单克隆抗体,4 ℃孵育过夜,TBST 洗涤后加人二抗,在室温下30 min 后,再TBST 洗涤,暗室内发光显影。
1.5 PYCR1免疫组织化学染色方法及分组HCC组织标本经10%甲醛固定,常规石蜡包埋,切片;60 ℃烘片,常规二甲苯脱蜡,梯度乙醇复水,柠檬酸缓冲液高压修复抗原,3%双氧水封闭后滴加一抗与辣根过氧化物酶标记羊抗兔IgG 二抗,染色并封片,其他按照试剂盒说明书操作。PYCR1表达量判定方法:由3 位病理学医师采用双盲法在显微镜下观察组织切片上每个小块的所有区域,判定染色强度和染色阳性率。染色强度评分:0 分(阴性)、1 分(阳性)、2 分(强阳性)。染色阳性率评分:0 分,1 分(1% ~25%),2 分(26% ~50%),3分(51%~75%),4分(76%~100%)。以染色强度评分和染色阳性率评分的乘积为总评分,<4 分为PYCR1 低表达,≥4 分为PYCR1 高表达[12]。本研究中,PYCR1 低表达22 例,PYCR1 高表达58 例,见图1。
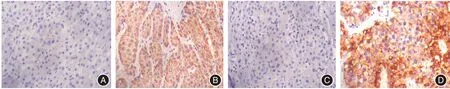
图1 PYCR1 在HCC 组织中的表达Fig.1 Expression of PYCR1 in HCC tissues
1.6 随访采用电话或患者来院就诊的方式对所有患者进行随访,随访至患者死亡或2020 年9 月1 日。记录两组患者5 年无瘤生存时间和总体生存时间。随访时间13 ~63 个月,平均(48.02 ±12.35)个月。
1.7 统计学方法应用SPSS 19.0 软件进行统计学分析。计量资料以均数±标准差表示,比较采用t检验;计数资料以百分率表示,比较采用χ2检验。采用Cox 比例风险模型对影响HCC 患者预后的因素进行单因素、多因素分析。采用Kaplan-Meier 法绘制HCC 患者生存曲线,并应用Log-rank法进行差异性检验。所有统计采用双侧概率检验,P<0.05 为差异有统计学意义。
2 结果
2.1 PYCR1在HCC和癌旁组织中表达水平比较HCC 组中PYCR1 mRNA 和蛋白相对表达量均明显高于癌旁对照组(均P<0.05)。见表1,图2。
表1 PYCR1 在HCC 和癌旁组织中表达水平比较Tab.1 Expression of PYCR1 in HCC and adjacent tissues±s
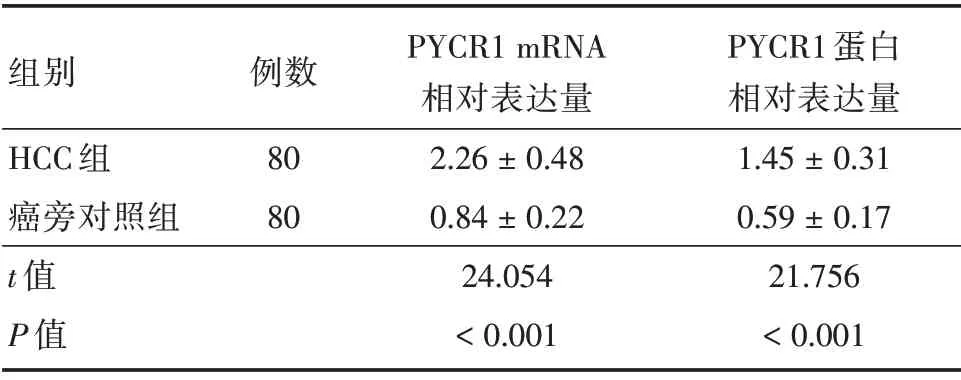
表1 PYCR1 在HCC 和癌旁组织中表达水平比较Tab.1 Expression of PYCR1 in HCC and adjacent tissues±s
组别HCC 组癌旁对照组t 值P 值例数80 80 PYCR1 mRNA相对表达量2.26±0.48 0.84±0.22 24.054<0.001 PYCR1 蛋白相对表达量1.45±0.31 0.59±0.17 21.756<0.001
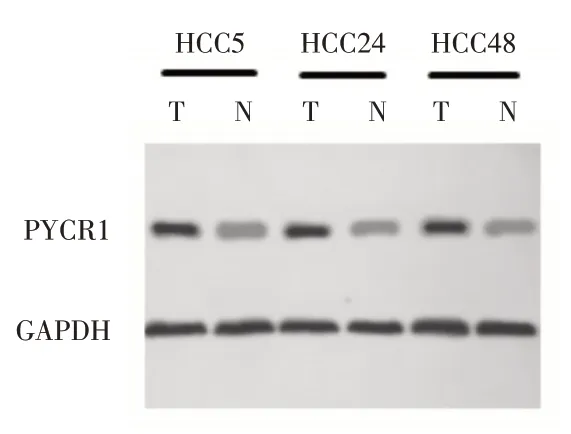
图2 PYCR1 在HCC 和癌旁组织蛋白表达水平Fig.2 Protein expression levels of PYCR1 in HCC and paracancerous tissues
2.2 HCC组织中PYCR1表达水平与临床病理特征的关系HCC组织中PYCR1表达水平与肿瘤大小、卫星灶、血管侵犯、TNM 分期有关(均P<0.05),其余指标无相关性(均P>0.05)。见表2。
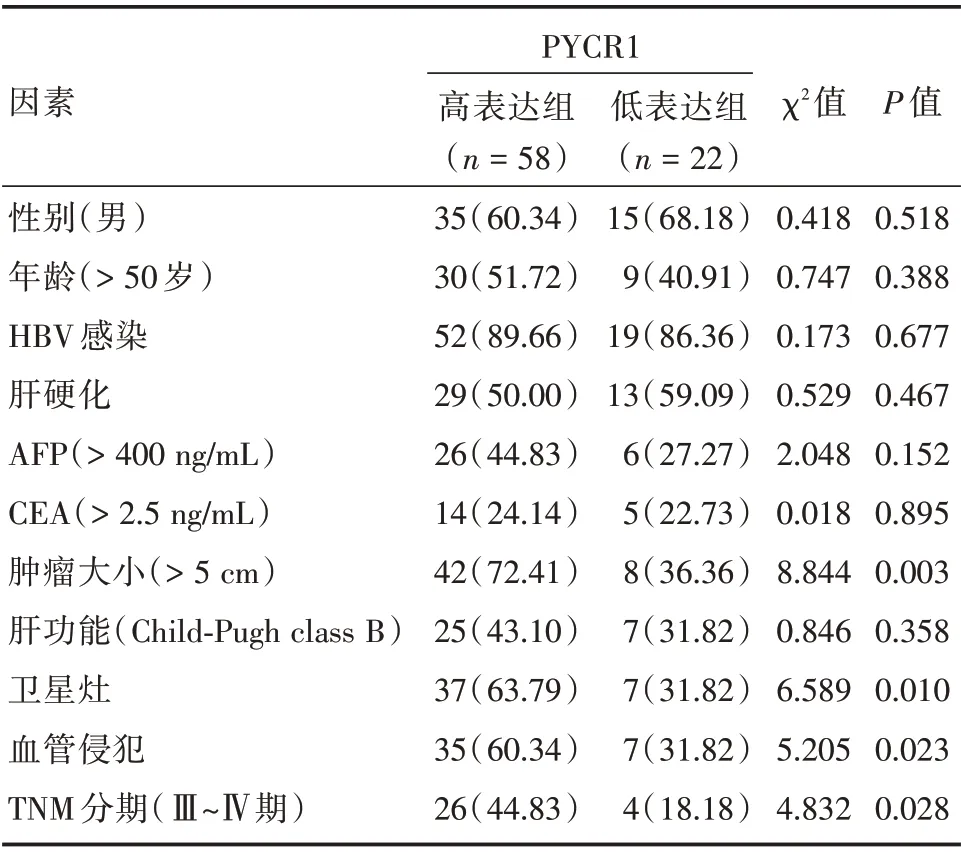
表2 HCC 组织中PYCR1 表达水平与临床病理特征的关系Tab.2 Relationship between expression level of PYCR1 and clinicopathological characteristics in HCC例(%)
2.3 影响HCC 患者预后的单因素、多因素Cox 回归分析Cox 回归分析结果显示,肿瘤大小、卫星灶、血管侵犯、TNM 分期、PYCR1 表达水平是影响HCC患者5年总体生存率的独立因素(均P<0.05);血管侵犯、TNM 分期、PYCR1 表达水平是影响HCC患者5 年无瘤生存率的独立因素(均P<0.05)。见表3、4。
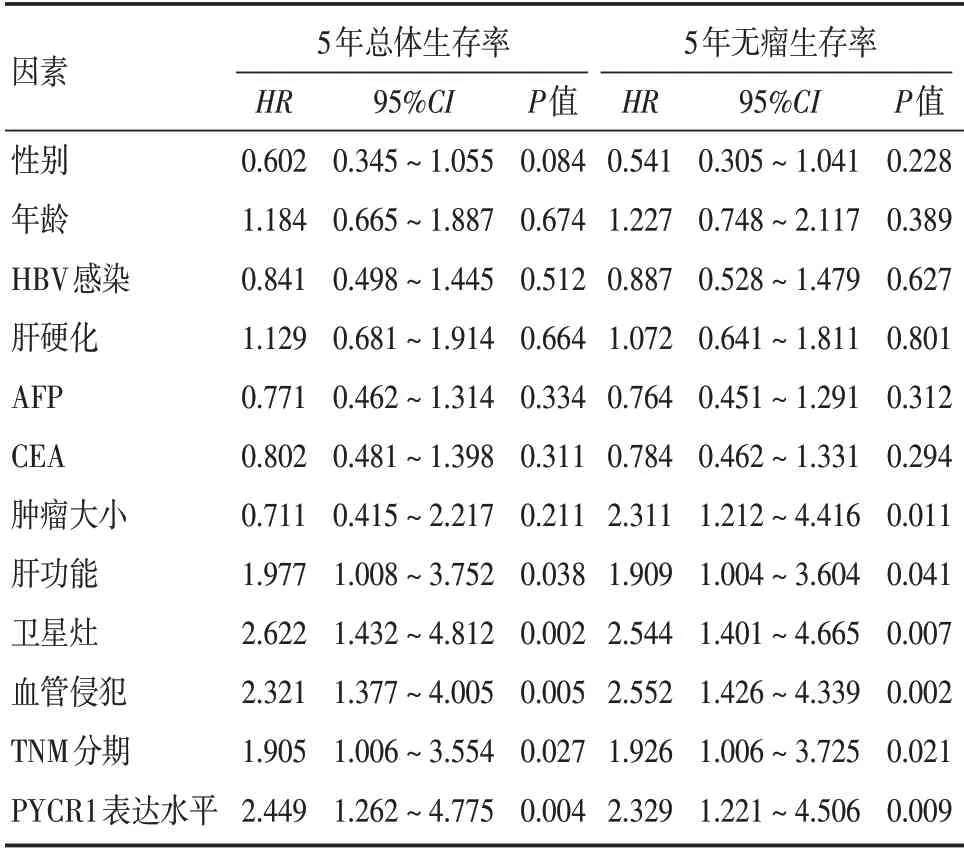
表3 影响HCC 患者预后的单因素Cox 回归分析Tab.3 Univariate Cox regression analysis of prognosis in patients with HCC

表4 影响HCC 患者预后的多因素Cox 回归分析Tab.4 Multivariate Cox regression analysis of prognosis in patients with HCC
2.4 HCC组织中PYCR1表达水平与预后的关系Kaplan-Meier 生存分析结果显示,HCC 组织中PYCR1 低表达组患者5 年总体生存率、无瘤生存率明显高于PYCR1 高表达组(均P<0.05)。见图3。
3 讨论
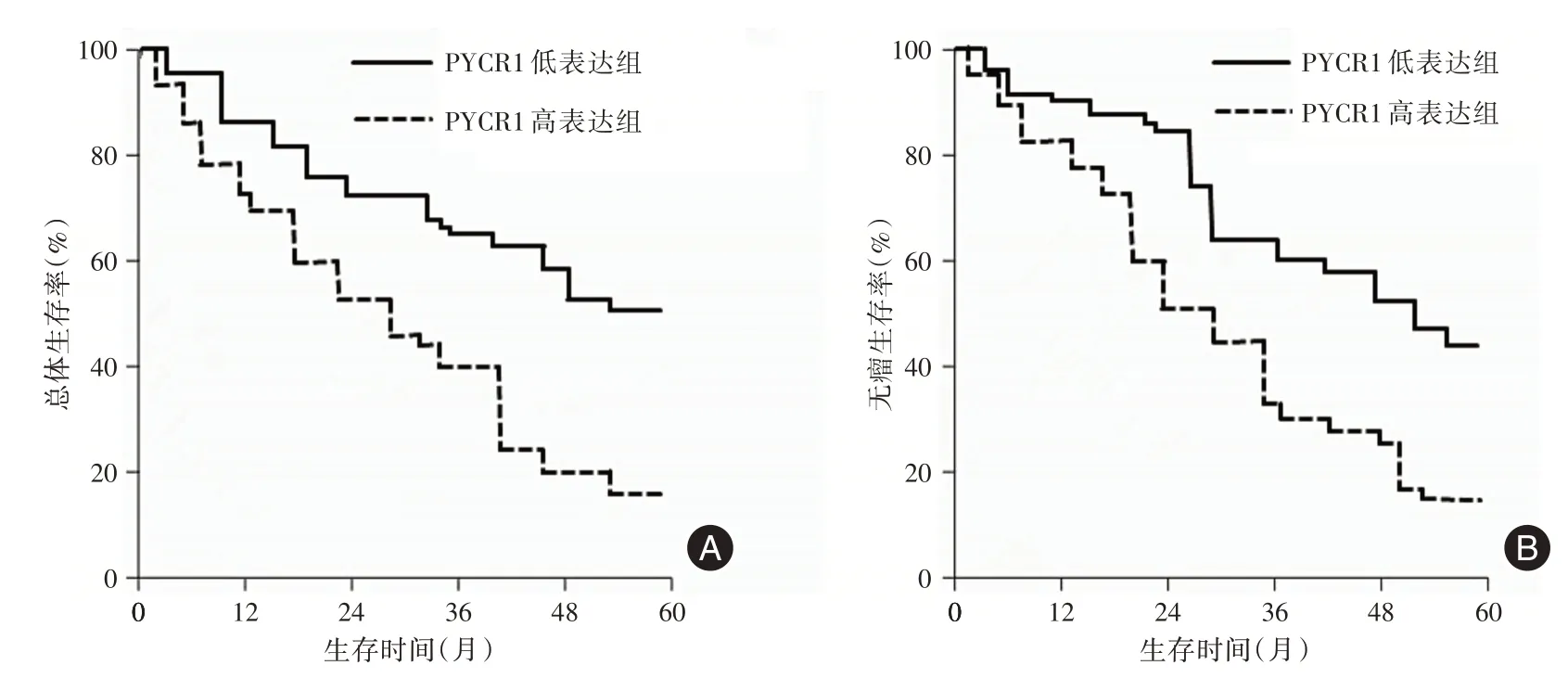
图3 HCC 组织中PYCR1 表达水平与5 年总体生存率和无瘤生存率的关系Fig.3 Relationship between PYCR1 expression and 5 years overall survival rate and disease-free survival rate in HCC
据报道,50% ~90%接受HCC 根治切除术的患者最终都死于肿瘤复发[13]。因此,早期发现是提高HCC 患者生存率的有效策略之一。迄今为止,许多临床病理特征和生物标志物被发现与HCC 患者预后显著相关[14-15]。然而,对影响HCC预后因素的识别远远不足以使既往研究结果普遍应用于临床。本研究选择与肿瘤发生、发展、转移及化疗敏感性相关的PYCR1 基因,从mRNA、蛋白相对表达量方面入手,比较HCC 组织与癌旁组织中PYCR1 表达差异。通过免疫组织化学法,确定PYCR1 高表达和低表达组,分析PYCR1 表达水平与HCC 患者临床病理特征和预后关系。本研究发现,HCC 组中PYCR1 mRNA 和蛋白相对表达量均显著高于癌旁对照组,组织中PYCR1 表达水平是影响HCC 患者5 年无瘤生存率和总体生存率的独立因素,HCC 组织中PYCR1 低表达组患者5 年总体生存率、无瘤生存率高于PYCR1 高表达组。
有报道[16]指出,脯氨酸代谢过程中的两个关键酶脯氨酸脱氢酶/脯氨酸氧化酶和PYCR1 与恶性肿瘤细胞的生长、侵袭、转移密切相关。PYCR1是广泛存在于人体各种组织细胞中的一种线粒体酶,可将NAD(P)H+的氧化还原产物转运至线粒体,在细胞中促进脯氨酸合成。有研究证实,PYCR1 是原癌基因c-myc 的靶点,发挥抗肿瘤细胞凋亡和抗氧化的作用[17]。DING 等[18]的研究指出,乳腺癌的形成与谷氨酸-脯氨酸代谢密切相关,PYCR1 在乳腺癌组织中高表达,其mRNA 水平与乳腺癌患者生存率呈负相关;此外,体外研究[18]证实,siRNA 干扰PYCR1 基因后,乳腺癌细胞的生长和侵袭能力受到抑制。FU 等[19]的研究指出,PYCR1 mRNA 和蛋白水平在肾癌组织中高表达,与TCGA 数据库结果一致;PYCR1 蛋白水平检测对肾癌的诊断具有一定的准确性;PYCR1 是肾癌患者预后的独立预测因子。谢智彬等[20]通过探讨PYCR1 在膀胱癌组织中的表达及其临床意义,发现PYCR1 在膀胱癌中高表达,并与年龄、病理分级、N 分期、T 分期、M 分期和临床分期密切相关,提示PYCR1 参与了膀胱癌的发生及进展。上述研究表明,PYCR1 或许可以作为肿瘤诊断和预后的一种新型标志物,并有望成为肿瘤治疗的新靶点。PYCR1 与HCC 关系的研究报道不多,最近一项研究报道[11],HCC 组织中PYCR1 mRNA 和蛋白水平均显著高于癌旁组织,通过抑制HCC 细胞株BEL-7404 细胞和SMMC-7721 细胞中PYCR1 的表达之后,肝癌细胞的增殖能力受到显著抑制,细胞凋亡率显著升高,这一过程受到c-Jun 氨基末端激酶/胰岛素受体底物1 信号通路调节;裸鼠实验也证实了干扰PYCR1 表达可显著抑制裸鼠移植瘤的生长,瘤体的体积和重量显著缩小。本研究与上述研究结果一致,结果显示HCC 组中PYCR1 mRNA 和蛋白相对表达量均显著高于癌旁对照组。本研究还发现,组织中PYCR1 表达水平与肿瘤大小、卫星灶、血管侵犯、TNM 分期有关,提示PYCR1 发挥的潜在机制可能与大肿瘤(>5 cm)患者的比例增加、形成肿瘤卫星灶、促进血管侵犯和TNM 分期进展有关。
本研究为单中心研究,样本量较少,影响统计效能,还需大样本、多中心研究加以验证。总之,本研究发现PYCR1 基因在HCC 组织中高表达,并与HCC 患者临床病理特征存在相关性,提示PYCR1 可能参与了HCC 的发生、发展。PYCR1 表达水平与HCC 患者预后关系密切,提示PYCR1 或许可作为一种新的预后指标和治疗靶点。然而,PYCR1 与HCC 之间关系的确切机制目前尚未明确,后续研究还应建立过表达及沉默PYCR1 的HCC 细胞株模型,探讨其参与HCC 发生、发展的可能机制。

