circ_NEK6靶向miR-370-3p对分化型甲状腺癌131I耐受细胞恶性生物学行为的影响
陈富坤 邓智勇 刘超 吕娟 贾莉 杨传周 刘鹏杰 冯志平
1云南省肿瘤医院核医学科(昆明650118);2昆明医科大学第三附属医院核医学科(昆明650118)
分化型甲状腺癌(DTC)是最常见的内分泌恶性肿瘤,虽然仅占全身恶性肿瘤的2.6%,但近年来发病率迅速增长[1]。放射性核素131I 是治疗DTC 的有效方法[2]。然而,由于DTC 细胞对131I 发生继发性放疗抵抗,导致放疗后病灶残留、增殖和转移,无法达到预期治疗效果。研究[3]发现,环状RNA(circRNA)的异常表达与肿瘤的放疗抵抗密切相关。例如,circ_CCDC66[4]和circ_MTDH.4[5]参与调控肿瘤放疗抵抗。前期研究[6]证实,circ_NEK6 在甲状腺癌组织和细胞系中异常高表达,但其在DTC 细胞131I 耐受的作用机制尚不清楚。此外,在线生物学数据库显示,miR-370-3p 作为circ_NEK6的潜在靶基因之一,且miR-370-3p 在多种恶性肿瘤发展进程中作为抑癌基因,包括甲状腺癌[6]、宫颈癌[7]和白血病[8],同时,miR-370-3p 也参与调控恶性肿瘤细胞的放疗耐受性[9]。然而,circ_NEK6通过靶向miR-370-3p 调控DTC 的131I 放疗抵抗分子机制尚不清楚。因此,本研究拟探讨circ_NEK6对131I 耐受DTC 细胞增殖、凋亡、侵袭和迁移的影响以及其潜在作用机制,以期为临床治疗131I 放疗抵抗的DTC 患者提供实验依据。
1 材料与方法
1.1 材料
1.1.1 临床样本收集2016 年5 月至2019 年5 月于云南省肿瘤医院核医学科救治的DTC 患者经手术切除的组织标本。纳入标准:(1)病理证实为DTC;(2)行甲状腺全切或次全切除;(3)首次接受131I 治疗;(4)预期生存期不低于1 年。排除标准:(1)治疗前血常规异常者;(2)接受过其他免疫治疗或者放化疗者;(3)心脏、肝、肾等重要脏器功能出现严重不全者。此外,根据中华医学会核医学会公布的131I 治疗DTC 指南(2014 版)[10],将患者分为131I 敏感组(20 例)和131I 耐受组(20 例)。其中131I耐受组评判标准[11]:(1)转移灶在清甲成功后首次131I 治疗后全身显像中即表现为不摄碘;(2)原本摄碘的功能性转移灶经131I治疗后逐渐丧失摄碘能力;(3)部分转移灶摄碘,而部分转移灶不摄碘,且可被18F-FDG PET/CT、CT 或MRI 等其他影像学检查所显示;(4)摄碘转移灶在经多次131I 治疗后虽然保持摄碘能力,但仍在1年内出现病情进展的患者。131I敏感组评判标准[11]:甲状腺癌术后经131I治疗后残留甲状腺组织清甲完全。所有组织标本取出后立即储存于-80 ℃冰箱保存备用。手术前均告知患者并签署知情同意书,并获得本医院伦理委员会批准。
1.1.2 细胞系和主要试剂人DTC 细胞、人甲状腺滤泡上皮细胞以及HEK-293T 均购自北纳生物;DMEM 和Trizol 试剂盒购自Thermo 公司;胎牛血清购自Gibco 公司;LipofectamineTM3000 和逆转录试剂盒购自TaKaRa 公司;CCK-8 试剂盒购自上海碧云天公司;Transwell 小室购自康宁公司;双荧光素酶报告基因购自Promega 公司。
1.2 方法
1.2.1 细胞培养、分组及转染采用含有10%的胎牛血清和双抗的DMEM 培养上述细胞系。待Res-BCPAP 细胞生长密度达到80%时,将细胞调整密度2 × 105个/孔平铺到6 孔板中,严格参照LipofectamineTM3000 试剂说明书进行转染处理,分为敲降circ_NEK6 组、敲降miR-370-3p 组、同时敲降circ_NEK6+miR-370-3p inhibitor 组,转染培养6 h后,更换正常DMEM 继续培养用于后续实验。
1.2.2131I 耐受细胞构建参考前期文献[12],将对数生长期的BCPAP 细胞置于0.5 mCi 放射性核素131I 照射下培养24 h。更换新鲜的DMEM 继续培养,并观察细胞活力,若无明显死亡则选择该对数期细胞增加剂量,反复传代培养,直至最后在131I(1.05 mCi)照射下能够稳定存活,即构建成功131I放疗抵抗细胞株Res-BCPAP。
1.2.3 RT-qPCR收集组织和细胞,采用Trizol提取总RNA,并采用NanoDrop 检测RNA的浓度。随后,采用一步法逆转录试剂盒将RNA 反转录为cDNA,严格按照qPCR 试剂盒说明书检测circ_NEK6 和miR-370-3p 的表达,以U6 和GAPDH 为内参。
1.2.4 细胞增殖检测将处理的Res-BCPAP 细胞培养至对数生长期,以每孔1 × 105个细胞接种96孔板,每组设置6 个复孔,置于37 ℃、5%CO2的培养箱中培养0、24、48 和72 h 后,向每孔加入10 μL CCK-8 溶液(0.5 mg/mL)后继续于培养箱中孵育4 h 后,采用酶标仪检测450 nm 处的每孔光密度(OD450)值。
1.2.5 细胞凋亡检测将经转染后的细胞调整浓度为1 × 105个/孔接种到6 孔板,过夜培养后用胰蛋白酶消化细胞,PBS 洗涤后加入300 μL 结合液重悬,加入10 μL Annexin V-FITC 室温避光孵育15 min,再加入5 μL PI 溶液染色,混合均匀后避光孵育5 min,流式细胞仪检测细胞凋亡百分比。
1.2.6 细胞侵袭和迁移检测将经转染处理的细胞,以1 × 105个/孔的浓度接种于Transwell 小室上室,下室加入500 μL DMEM后常规培养24 h。培养结束后采用1%结晶紫染色20 min,并于光学显微镜下随机选择5 个视野计算侵袭和迁移细胞数。对于侵袭实验,Transwell 小室上室需采用Matrigel胶包被,其他实验与迁移实验步骤一致。
1.2.7 双荧光素酶报告实验由湖南普拉特泽生物科技有限公司构建circ_NEK6 基因的3′UTR,插入pGL3-Promoter 质粒载体中,将该重组质粒命名为pGL3-circ_NEK6-3′UTR WT,采用基因突变法定点突变获得circ_NEK6 突变型载体(pGL3-circ_NEK6-3′UTR MUT)。然后,将HEK-293T 细胞接种于12 孔板中,待细胞汇合度达到70%时分别将miR-370-3p mimic、miR-NC、circ_NEK6 野生型载体、circ_NEK6 突变型载体共转染于细胞中,转染6 h 后更换为新鲜的含10%胎牛血清的DMEM 培养液,继续培养36 h。最后,采用双荧光素酶报告基因检测荧光素酶活。
1.3 统计学方法采用SPSS 22.0 对所有数据进行统计学分析,并利用GraphPad Prism 8 对实验数据进行绘图。其中两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 circ_NEK6在DTC组织和细胞系中高表达RT-qPCR结果显示,circ_NEK6 在131I 耐受DTC 组织中的表达明显高于敏感组织(P<0.001,图1A)。相比于Nthy-ori3-1 细胞,circ_NEK6 在DTC 细胞系中高表达(P<0.001,图1B),特别是在BCPAP细胞。此外,circ_NEK6 在Res-BCPAP 细胞中的表达高于其亲本细胞BCPAP(P<0.01,图1C)。由此可知,circ_NEK6 的高表达可能与DTC 的131I 耐受相关。
2.2 敲降circ_NEK6 可显著抑制Res-BCPAP 细胞增殖和诱导细胞凋亡相比于对照组,敲降circ_NEK6 可下调Res-BCPAP 细胞中circ_NEK6 的表达(P<0.001,图2A)。同时,敲降circ_NEK6 组细胞增殖受到抑制(图2B),凋亡百分数上调(P<0.001,图2C、D)。

图1 circ_NEK6 在DTC 组织和细胞系中的表达水平Fig.1 The expression of circ_NEK6 in DTC tissues and cell lines
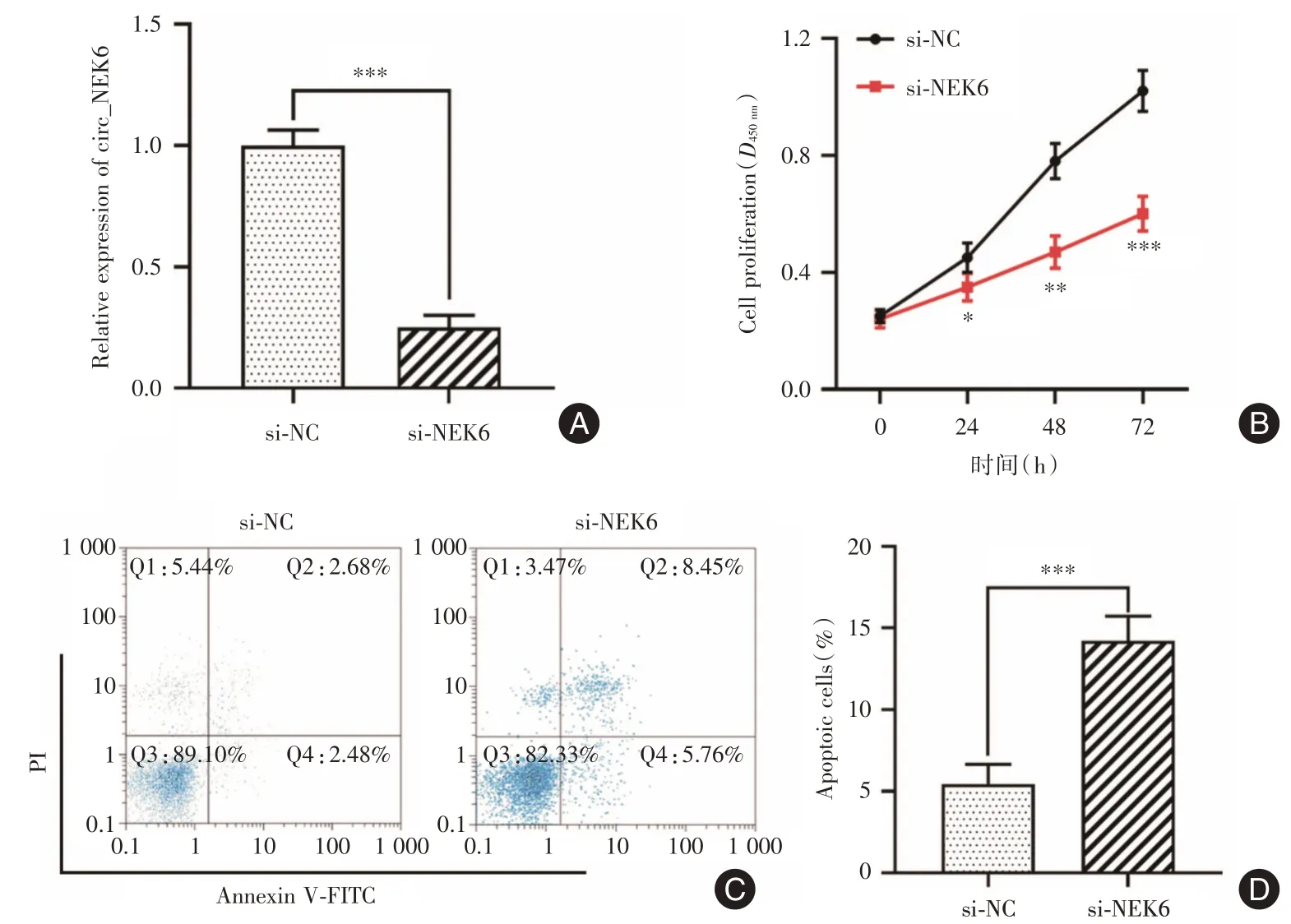
图2 敲降circ_NEK6 对Res-BCPAP 细胞增殖和凋亡的影响Fig.2 Effect of circ_NEK6 knockdown on Res-BCPAP cell proliferation and apoptosis
2.3 敲降circ_NEK6可显著抑制Res-BCPAP细胞侵袭和迁移能力Transwell 检测结果显示,相比于对照组,敲降circ_NEK6 组Res-BCPAP 细胞侵袭(图3A)和迁移能力(图3B)显著下调(均P<0.001)。
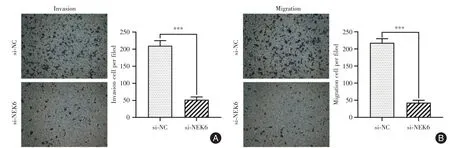
图3 敲降circ_NEK6 对Res-BCPAP 细胞侵袭和迁移能力的影响Fig.3 Effect of circ_NEK6 knockdown on Res-BCPAP cell invasion and migration abilities
2.4 circ_NEK6 靶向下调miR-370-3p 的表达Starbase 数据库预测显示,miR-370-3p 与circ_NEK6存在结合位点(图4A)。同时,miR-370-3p 在Res-BCPAP 细胞中的表达水平明显低于其亲本细胞(P<0.001,图4B)。双荧光素酶报告基因结果显示,过表达miR-370-3p 显著下调野生型circ_NEK6载体的荧光素酶活性(P<0.01,图4C),但对突变型circ_NEK6 载体没有影响。此外,miR-370-3p 在敲降circ_NEK6组中的表达高于si-NC组(P<0.01,图4D)。由此可知,circ_NEK6靶向负调控miR-370-3p 的表达。
2.5 敲降circ_NEK6 靶向上调miR-370-3p 抑制Res-BCPAP细胞恶性生物学行为相比于对照组,miR-370-3p在miR-370-3p inhibitor组中的表达下调(P<0.001,图5A),但回复组(miR-370-3p inhibitor和si-NEK6)上调miR-370-3p的表达(P<0.001)。相比于敲降circ_NEK6 组,细胞增殖活力(图5B)明显上调,细胞凋亡水平下调明显(P<0.001,图5C、D)。Transwell检测结果显示,相比于敲降circ_NEK6 组,回复组细胞侵袭(P<0.001,图5E、G)和迁移(P<0.001,图5F、H)能力明显上调。由此可知,敲降circ_NEK6 通过靶向上调miR-370-3p 的表达水平,进而抑制Res-BCPAP 细胞增殖、侵袭和迁移能力,以及诱导细胞凋亡。
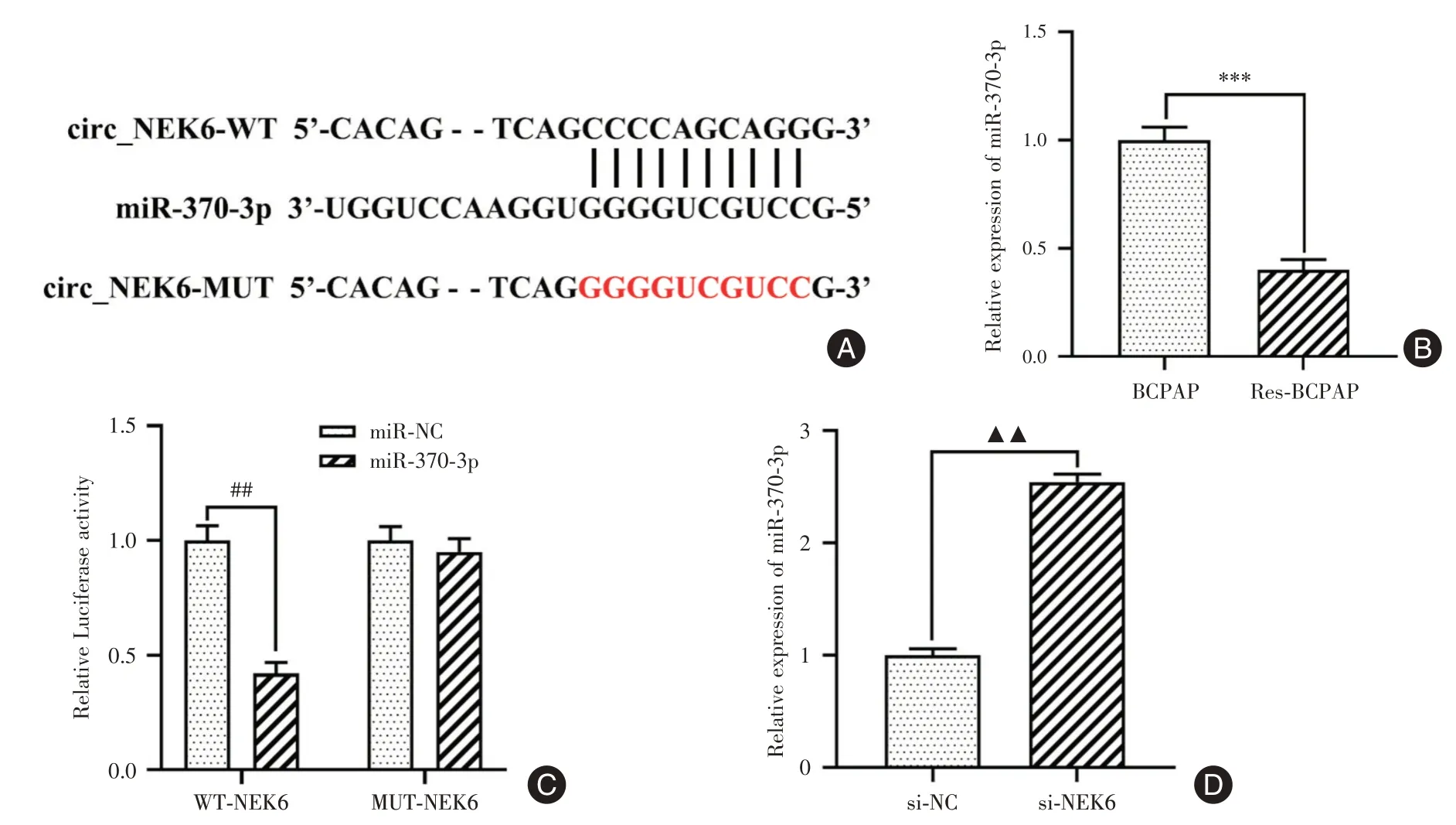
图4 miR-370-3p 是circ_NEK6 的靶基因Fig.4 miR-370-3p was a target gene of circ_NEK6
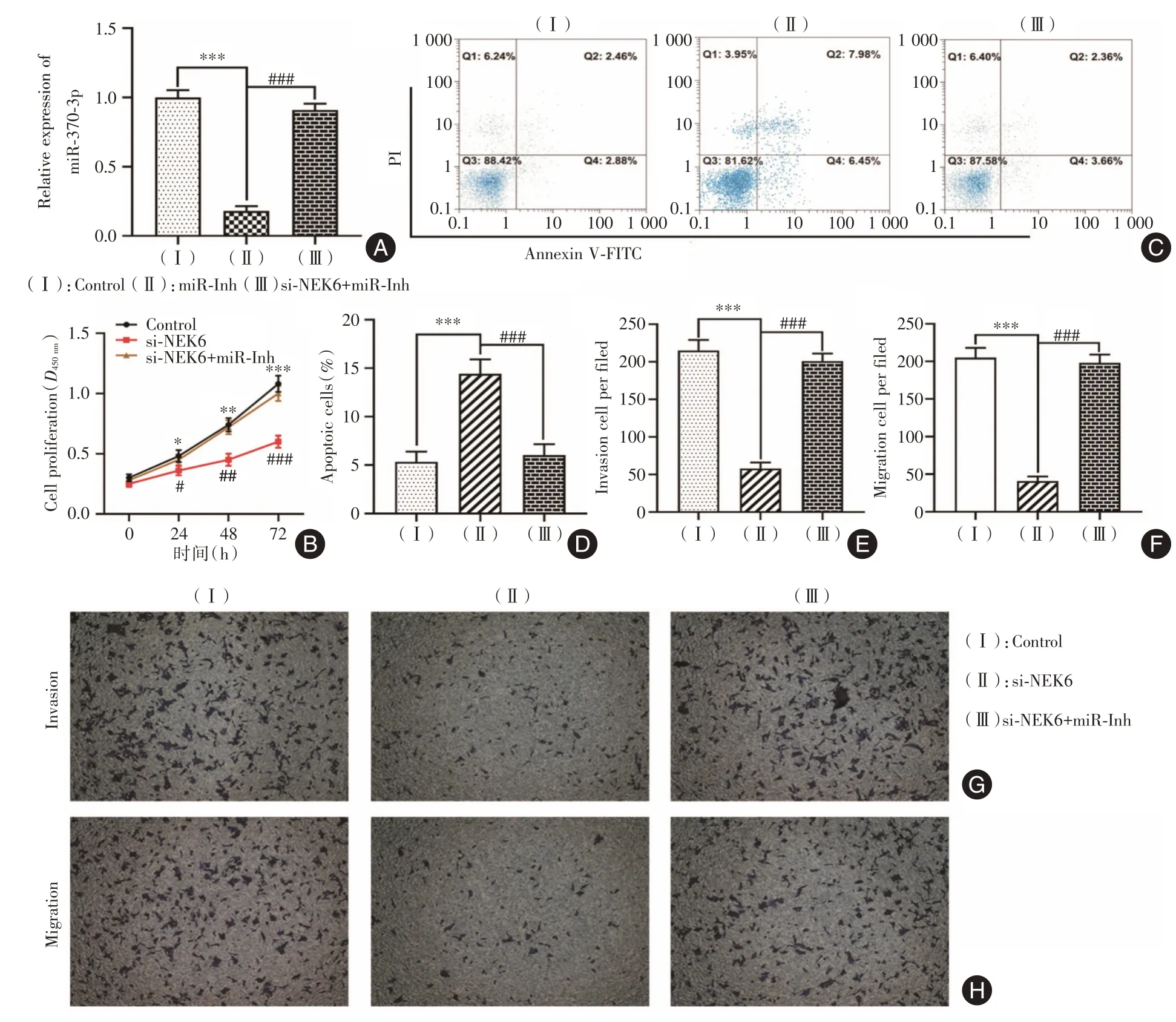
图5 circ_NEK6 靶向miR-370-3p 对Res-BCPAP 细胞增殖、凋亡、侵袭和迁移能力的影响Fig.5 Effect of circ_NEK6 on the proliferation,apoptosis,invasion,and migration capacities of Res-BCPAP cells via targeting miR-370-3p
3 讨论
大量文献[13-15]证实非编码RNA(包括miRNA、lncRNA 和circRNA)通过调控肿瘤细胞恶性生物行为介导多种恶性肿瘤放疗抵抗。尤其是circRNA可作为恶性肿瘤放疗抵抗的重要调控因子[16]。例如,经放疗处理的宫颈癌细胞中有153 个差异circRNA异常表达(其中76个上调和77个下调)[17]。GUAN 等[18]证实,敲降circ_PITX1 通过靶向抑制miR-329-3p 促进胶质瘤细胞对放疗的敏感性。LIU 等[19]研究表明,敲降circ_100367 通过抑制放疗抵抗KYSE-150R 细胞增殖、侵袭和迁移,从而缓解食管鳞状细胞癌细胞对放疗的抵抗。本研究同样证实,circ_NEK6 在131I 耐受DTC 组织和细胞系中异常高表达,敲降circ_NEK6 通过靶向上调miR-370-3p 显著抑制了131I 耐受细胞增殖、侵袭和迁移能力。同时,LIU 等[20]也证实,lncRNA MEG3 通过靶向miR-182 增强甲状腺癌细胞对131I 的敏感性。
大量研究证实,circRNA 通过靶向结合下游miRNA 参与调控恶性肿瘤细胞增殖、侵袭和迁移。例如,circ_AGFG1 通过靶向抑制miR-370-3p 促进宫颈癌细胞增殖和迁移能力[7]。circ_MYO10 通过抑制miR-370-3p 促进骨肉瘤细胞增殖和上皮间质转化,进而加速肿瘤的恶化进程[21]。miR-370-3p作为抑癌基因,在多种恶性肿瘤组织和细胞系中低表达[22]。过表达miR-370-3p 可明显抑制肿瘤细胞恶性生物学行为[23],进而增强肿瘤细胞对放疗敏感性[9]。然而,目前尚未有研究证实miR-370-3p在DTC 细胞对131I 耐受过程中的作用机制。本研究结果显示,miR-370-3p 在131I 耐受Res-BCPAP 细胞中的表达低于BCPAP 细胞,且敲降miR-370-3p 可缓解circ_NEK6 敲降对Res-BCPAP 细胞增殖、侵袭和迁移的抑制作用。也有研究表明,过表达miR-370-3p 增强肿瘤细胞对化疗药物的敏感性[24]。以上研究提示,miR-370-3p 可能是增强DTC 对131I 放射敏感性的有效性靶点。
综上所述,本研究证实circ_NEK6/miR-370-3p分子轴与DTC 细胞对131I 耐受有关,敲降circ_NEK6通过靶向上调miR-370-3p 显著抑制Res-BCPAP 细胞增殖、侵袭和迁移能力。本研究为临床上治疗DTC 患者对131I 放射性粒子植入治疗产生抵抗提供有效的治疗靶点。

