甘氨酸盐捕集二氧化碳后的矿化解吸与再生研究
李亦易 ,孙峤昳 ,马琳鸽 ,卓锦德 ,宋卫国
(1.北京低碳清洁能源研究院,北京102211;2.中国科学院化学研究所)
随着全球气候变暖趋势加剧, 控制CO2排放已成为全球共识[1]。 燃煤电厂的CO2减排是大规模减少CO2排放的有效路径, 其中以有机胺溶液的CO2捕集封存(CCS)技术备受关注[2]。 然而,该技术存在能耗高、成本大的短板。其中高能耗主要集中在加热解吸有机胺溶液的再生阶段, 并且高温加热解吸会引起有机胺挥发、降解以及设备腐蚀;高成本主要产生于加热解吸的CO2需要压缩运输到指定的地质勘探点封存。 因此,针对这些问题,迫切需要新工艺来代替传统加热解吸工艺。 矿化解吸是一种无需加热的低能耗再生方法,原料主要采用富含氧化钙(CaO)的天然矿石以及钢渣、粉煤灰等碱性固废[3-5]。 这些原料储量大、成本低,尤其是粉煤灰这这一类燃煤电厂自产固废,可以直接用来进行燃烧后CO2捕集的矿化解吸,矿化后的地聚物还能用于土壤改良、道路铺设以及矿山填埋,具有广阔的应用前景。
本研究利用CaO 作为模型化合物研究矿化解吸的方法代替传统加热解吸的方法再生已吸收CO2的吸收剂溶液,不仅能直接实现解吸出的CO2矿化生成碳酸钙(CaCO3)沉淀得以封存,而且几乎没有能量消耗[6-7]。 整个过程采用甘氨酸盐作为吸收剂,虽然甘氨酸盐吸收剂在加热解吸的过程中能量消耗比醇胺吸收剂高[8],但矿化解吸过程几乎没有能量消耗,并且甘氨酸盐还具有环境友好、不易挥发降解的优势,因此成为本研究理想的CO2吸收剂。
傅里叶变换红外光谱(FT-IR)是研究CO2吸收-解吸的常用手段[9-12],具有设备成本相对低廉、对样品适用性好以及测量相对简单等优点, 因此相对于其他技术具有显著优势。 通过分子中的化学键或官能团对不同频率红外光的吸收情况做定性或定量分析。 衰减全反射傅里叶变换红外光谱法(ATR-FTIR)是一种不需要对样品做任何前处理且无损的测试技术。 本文利用ATR-FTIR 跟踪测试了CaO 矿化解吸已捕集CO2的甘氨酸盐吸收剂, 通过对反应物和产物的表征了解整个矿化解吸过程,为进一步了解CaO 矿化解吸已捕集CO2吸收剂的反应机理和反应动力学提供了理论基础。
1 实验部分
1.1 实验材料
甘氨酸(纯度≥99%)、氧化钙(CaO,纯度≥99.95%)、氢氧化钾(分析纯)。 所有的试剂无需进一步纯化。 甘氨酸钾溶液是将等摩尔的甘氨酸和氢氧化钾溶解在去离子水中配制而成。CO2气体(纯度≥99.995%)。
1.2 仪器
本实验使用在线 pH 计为 SX836 型 pH 计,IR Prestige-21 型傅里叶变换红外光谱仪,采用ATR 附件:Specac Diamond 单次反射 ATR 附件,入射角为45°, 金刚石晶体。 测试参数设置为 Absorbance 模式,Happ-Genzel 函数,扫描次数为 16 次,分辨率为4 cm-1,扫描范围为 400~4 000 cm-1。
1.3 实验方法
利用图 1 的 CO2吸收-再生装置, 将 CO2气体通入到150 mL 的甘氨酸钾溶液(3 mol/L)中,气体流量控制为1.5 L/min, 流量由气体质量流量计控制,打开磁力搅拌器以500 r/min 的速度搅拌。在CO2的吸收过程中,通过水浴将溶液温度保持在40 ℃。 在吸收反应期间, 每隔一段时间从反应装置中用滴管移取1~2 滴反应样品滴加在ATR 附件的晶体上,使其完全覆盖晶体表面,并保证液体与晶体充分接触,再按照1.2 节的测试参数进行测试, 当所测量的光谱与前一次测量的光谱几乎完全重合时, 停止通入CO2气体,此时甘氨酸钾溶液已饱和吸收CO2。
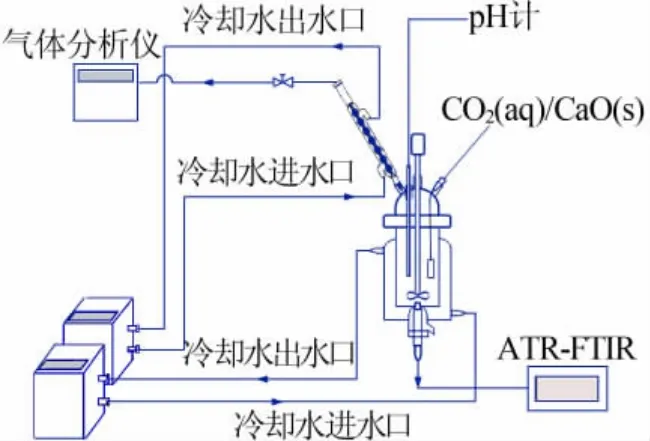
图1 CO2 吸收-再生实验装置示意图
同样, 利用图1 的装置将饱和CO2富液温度降至20 ℃后,向溶液中加入 0.45 mol 的 CaO 粉末(假定甘氨酸钾吸收CO2的物质的量比为1∶1),打开磁力搅拌器以500 r/min 的搅拌速度使固液充分混合。在整个反应过程中,通过水浴将溶液温度保持在20 ℃,防止因矿化反应放出的热量使溶液温度升高而引起热解吸反应。 同样每隔一段时间从反应装置中用滴管移取1~2 滴反应样品滴加在ATR 附件的晶体上,使其完全覆盖晶体表面,并保证液体与晶体充分接触,再按照1.2 节的测试参数完成测试;测试完成后用无尘纸和水清理晶体, 直至谱图中观察不到残留物吸收峰后,方可进行下一个样品的测试。当所测量的光谱与前一次测量的光谱几乎没有变化时,停止反应和测量,此时矿化再生过程已完成。 整个实验过程中的pH 变化通过在线pH 计实时测量。
2 结果与讨论
2.1 CO2 吸收-矿化解吸的红外光谱
通过测量的红外光谱观察到甘氨酸钾溶液在CO2吸收和矿化解吸过程中,1 200~1 700 cm-1的红外光谱有明显的变化, 因此重点关注该区域的红外光谱。 图2 为甘氨酸钾溶液、CO2饱和吸收溶液及矿化再生溶液的红外光谱图。由图2 可见,甘氨酸钾溶液显示7 个明显的特征峰, 其中代表甘氨酸钾中胺基(—NH2)的 1 315 cm-1处峰为—CH2—的面外摇摆振动或卷曲振动与—NH2的平面摇摆振动产生的费米共振,1 342 cm-1处的峰为—CH2—的面外摇摆振动和—NH2的卷曲振动产生的费米共振, 代表甘氨酸钾中羧酸根的1 404 cm-1处峰为—COO-的对称伸缩振动,1 560 cm-1处的峰为—COO-的反对称伸缩振动,表明了甘氨酸钾中—CH2—的 1 426 cm-1和1 448 cm-1处峰为—CH2—的剪式振动,与此同时,1 640 cm-1处的宽峰还有待指认[10-13]。 以上 7个特征峰分别代表甘氨酸钾溶液[KOOCCH2NH2(aq)]各基团的存在状态。 在与CO2的相关反应过程中,可以通过—NH2特征峰的相对强度变化描述其反应效率。
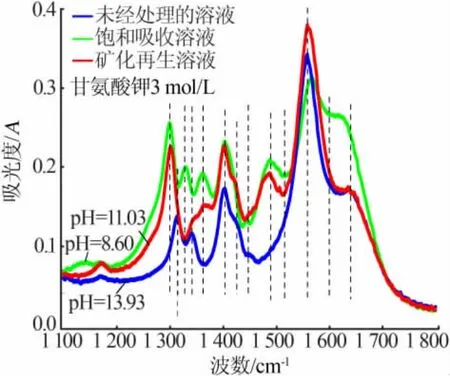
图2 甘氨酸钾溶液、CO2 饱和吸收溶液及矿化再生溶液的红外光谱图
图2 中甘氨酸钾的CO2饱和吸收液比甘氨酸钾纯溶液的红外光谱图多出6 个明显的特征峰, 并且pH 也由13.93 降至8.60,红外光谱中代表胺基甲酸酯(N-COO-)的 1 300 cm-1峰为 N—COO-的伸缩振动,1 490 cm-1处的峰为N—COO-中—COO-的对称伸缩振动,这 2 个峰都代表 KOOCCH2NHCOO-的存在[10-12];1 330 cm-1处的峰为—CH2—的平面摇摆振动或面外摇摆振动,J.J.Max 等[13]研究不同 pH 下甘氨酸盐的红外光谱发现,随着pH 从13.68 降至9.56,会新生成1 330 cm-1峰并且逐渐增强,同时由于—NH2的质子化1 315 cm-1和1 342 cm-1处的费米共振峰逐渐消失,表明1 330 cm-1处的峰出现与溶液由碱性变为中性有关;1 360 cm-1处的峰则代表碳酸氢根(HCO3-)中C—O 的对称伸缩振动[10-12],而 1515 cm-1附近的峰为—NH3+的对称变角振动,1 598 cm-1处的峰为—COO-的反对称伸缩振动和—NH3+的反对称变角振动产生的费米共振,这2 个峰都代表KOOCCH2NH3+的存在[10-13]。 同时尚未确认归属的 1 640 cm-1宽峰也然存在。 因此,甘氨酸钾的 CO2饱和吸收液中—NH3+、N—COO-、HCO3-特征峰的强度,分别代表KOOCCH2NH3+、KOOCCH2NHCOO-以及 HCO3-的相对含量。 通过N—COO-和HCO3-的特征峰强度变化可以描述吸收剂吸收CO2的效率;—NH2和—NH3+特征峰的变化可以描述甘氨酸钾转化的效率;而—CH2—特征峰的变化可以描述溶液pH 的变化。
图2 矿化解吸的光谱与甘氨酸钾的CO2饱和吸收液的光谱较为接近,没有出现新的特征峰,并且pH 也升至11.03。红外光谱图中除了N—COO-、HCO3-特征峰强度减小,最大的不同就是1 330 cm-1处代表—CH2—的平面摇摆振动或面外摇摆振动的峰消失。 同样可通过N—COO-和HCO3-的特征峰出现强度的降低描述CO2解吸过程的效率;从—NH2和—NH3+特征峰强度变化可描述吸收剂的再生效率;—CH2—特征峰的消失可以描述溶液pH 的回升。
2.2 矿化解吸动力学过程的红外光谱变化
图3 为CaO 矿化解吸已捕集CO2的甘氨酸钾吸收剂的红外光谱图。由图3 可见,整个矿化解吸过程中随着CO2的不断解吸并被CaO 矿化生成CaCO3沉淀,溶液的pH 不断升高,甘氨酸钾溶液的红外光谱发生了显著的变化。 在1 200~1 700 cm-1区域有6个逐渐减弱的特征峰和1 个逐渐增强的特征峰,6个逐渐减弱的峰为1 598 cm-1处的—COO-的反对称伸缩振动和—NH3+的反对称变角振动产生的费米共振峰、1 515 cm-1附近的—NH3+的对称变角振动峰、1 490 cm-1附近的N—COO-中—COO-的对称伸缩振动峰、1 360 cm-1附近的HCO3-中C—O 的对称伸缩振动峰、1 330 cm-1附近的—CH2—的平面摇摆振动或面外摇摆振动峰、1 300 cm-1处峰为N—COO-的伸缩振动;1 个逐渐增强的峰为1 560 cm-1处—COO-的反对称伸缩振动峰。 从1 598 cm-1和1 560 cm-1峰的变化可以看出随着CO2的不断解吸,pH 逐渐增大,溶液中的胺基不断再生(—NH3+→—NH2),溶液中—NH3+的减少造成1 598 cm-1处峰减弱,1 560 cm-1处峰也逐渐恢复到费米共振前的强度。 从1 515、1 490、1 360、1 300 cm-1处峰变化可以看出,溶液中—NH3+、N—COO-、HCO3-的含量在逐渐减少。
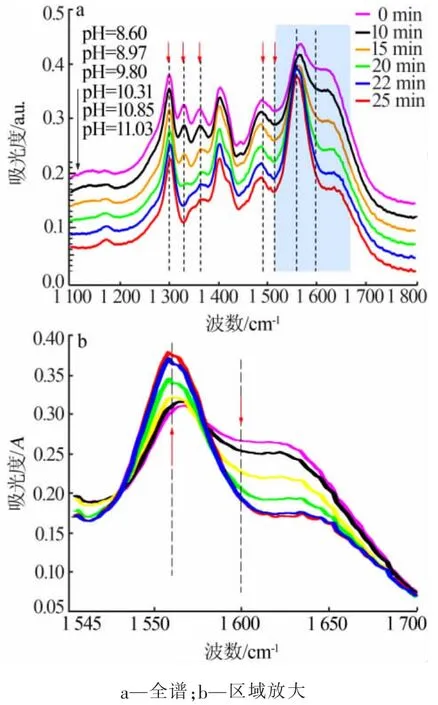
图3 矿化解吸动力学过程的红外光谱图变化
2.3 CO2 吸收-矿化解吸的反应过程
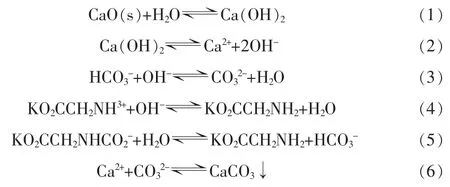
从图2 还可以看出, 甘氨酸钾吸收CO2过程中,溶液中的胺基不断被质子化(—NH2→—NH3+),并且新生成N—COO-和HCO3-的峰, 表明了甘氨酸钾溶液吸收的CO2会以N—COO-和HCO3-的形式存在。 1 330 cm-1和1 598 cm-1处峰在矿化解吸后几乎能完全消失,恢复到吸收CO2前的状态,从这2 个峰的变化可以看出矿化解吸后溶液的pH 增大,溶液由中性又重新变为强碱性,—NH3+可以完全再生回—NH2。 然而从图3 可以看出,矿化解吸完成后1 490、1 360、1 300 cm-1处峰并没有恢复到吸收 CO2前的强度,表明矿化解吸虽然能再生一部分吸收剂,但并不能完全再生甘氨酸钾吸收剂,吸收CO2后生成的一部分N—COO-仍然还保留在吸收剂中。 通过红外光谱的变化可以大致推测出整个矿化解吸反应的过程,如式(1)~(6):
3 结论
本研究以甘氨酸钾为CO2捕集吸收剂, 利用ATR-FTIR 表征了甘氨酸钾溶液以及吸收CO2饱和的甘氨酸钾溶液中的12 个特征峰。通过选定代表—CH2、—NH2、—NH3+、N—COO-、HCO3-的特征峰强度变化,表征了CaO 矿化解吸已捕集CO2的甘氨酸钾吸收剂及其再生的过程。实验结果表明,CaO 在矿化解吸已捕集CO2的甘氨酸钾吸收剂过程中,溶液的 pH 逐渐增大, 溶液中—NH3+、N—COO-、HCO3-的含量在逐渐减少。随着溶液中的—NH2不断生成,甘氨酸钾吸收剂得到再生。 虽然—NH3+可以完全再生回—NH2,但部分N—COO-还保留在吸收剂溶液中。因此,CaO 矿化解吸无法完全再生已捕集CO2的甘氨酸钾吸收剂,其矿化效率、再生效率以及循环再生效率将是下一步的研究重点。

