基于网络药理学、分子对接和实验验证探讨朱茯苓用于失眠的作用机制
周 扬,郭冷秋,刘 逊,谈如蓝,钟其新,曾 峰
1苏州卫生职业技术学院 苏州检验医学生物技术重点实验室,苏州 215009;2广州中医药大学青蒿研究中心,广州 510445;3广州中医药大学深圳医院(福田),深圳 518034
失眠通常指患者对睡眠时间和(或)质量不满足并影响白天社会功能的一种主观体验,是一种常见的生理心理疾患[1],其发病率约为20%[2],已日益成为涉及范围甚广的社会热点,引起人们的广泛重视。失眠在中医中亦称“不寐”,指由于外感或内伤等原因,造成阴阳气血及心、肺、脾、肾等脏腑功能失调而引起的无法正常睡眠为特征的一种病症[3],轻者入睡困难、睡后易醒、醒后不能再寐或时寐时醒等。重者整夜彻夜难眠,长期失眠会给人的正常生活和工作带来严重的不利影响。目前临床治疗失眠的西药以苯二氮卓、非苯二氮卓类为主,此类药物主要作用于神经递质γ-氨基丁酸(GABA)[4],但副作用大、依赖性强、有成瘾风险。而中医药治疗失眠主要以补虚泻实、调整脏腑阴阳为治则,在治疗失眠方面具有副作用小、无依赖性和成瘾性等优势,越来越受到重视,在临床应用广泛并取得良好的疗效。
茯苓味甘性平,归心、肺、脾和肾经,有利水渗湿、健脾宁心的功效[5]。茯苓的主要有效成分为茯苓多糖和三萜类物质,相关研究表明茯苓特有的四环三萜化合物茯苓酸具有镇静催眠作用且茯苓酸的催眠效果与调节脑内GABA的A型受体(GABA-A)表达水平有关[6]。朱砂为硫化物类矿物辰砂族辰砂,主含硫化汞(HgS),朱砂味甘性微寒,归心经,有清心镇惊、安神、明目、解毒的功效,相关研究表明,朱砂能够延长大鼠的慢波睡眠,有效改善大鼠的睡眠[7]。拌衣炮制是一种传统炮制工艺,朱茯苓即为采用此工艺制成,取茯苓块以清水喷淋,稍闷润后加水飞朱砂细粉撒布均匀,反复翻动,使其外表粘满朱砂粉末,然后晾干而成(每50 g茯苓配用水飞朱砂细粉1 g)[8]。《本草纲目》中记载:“茯苓,本草言利小便,伐肾邪……同朱砂能秘真元”。因此理论上,茯苓拌染朱砂后,可共奏镇静安神、祛邪宁心之效,多用于失眠、惊悸、健忘诸症。然而,目前关于朱茯苓治疗失眠的研究和机制探讨的文章尚不多见。
网络药理学紧紧围绕系统生物学、生物网络构建和分析等进行药物有效性、代谢特性的揭示,是建立在高通量组学数据分析、计算机虚拟计算及网络数据库检索基础上的生物信息网络构建及网络拓扑结构分析策略和技术基础上的科学思想和研究策略。利用网络药理学技术构建多层次网络模型,从整体角度对中药进行研究,已成为一种科学解释中药有效性和科学性的新策略,在多方面的中药研究中已具备了成功应用的经验[9]。
本研究以朱茯苓镇静安神的功效为切入点,遵循网络药理学理论与技术,筛选朱茯苓活性成分及潜在靶点,构建活性成分-靶点网络,对交集靶点进行器官定位,并进行GO功能和KEGG通路的富集分析以及分子对接验证,通过免疫印迹实验(Western blot)验证朱茯苓对GABA受体α1亚基基因(Gamma-aminobutyric acid receptor subunit alpha-1,GABRA1)和γ2亚基基因(Gamma-aminobutyric acid receptor subunit gamma-2,GABRG2)两种受体蛋白水平的影响,以期从分子层面初步阐述朱茯苓治疗失眠的可能的分子作用机制,为朱茯苓进行后续深入研究提供新思路和新方法。
1 材料与方法
1.1 朱茯苓的活性成分筛选
朱茯苓活性成分的筛选,基于TCMSP平台(http://tcmspw.com/index.php)、TCMID数据库(http://www.megabionet.org/tcmid/)和BATMAN-TCM数据库(http://bionet.ncpsb.org/batman-tcm/)以及文献查阅,收集茯苓和朱砂的活性成分,以口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL)筛选区符合条件的候选活性成分和对应靶点,将OB≥30%和DL≥0.18设为筛选条件,针对某些成分虽然OD值和DL值较低但仍具有较强活性这一情况,结合相关活性成分的文献记载,得到最终筛选得到的活性成分,使用Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)验证活性成分并获取其分子结构及PubChem CID等信息。
1.2 靶点的预测与筛选
运用TCMSP平台、BATMAN-TCM数据库和STITCH数据库(http://stitch.embl.de/)预测活性成分的靶点。在OMIM数据库(https://omim.org/)、TTD数据库(http://db.idrblab.net/ttd/)、CTD数据库(http://ctdbase.org/)和GeneCards数据库(https://www.genecards.org/)上筛选失眠相关靶点。将活性成分和疾病靶点导入Uniprot数据库(http://www.uniprot.org/),筛除非人类靶点并校正靶点名称。
1.3 化合物-靶点相互作用网络及靶点间相互作用网络的构建与分析
将活性成分及其靶点信息导入Cytoscape_v3.7.2软件(http://www.cytoscape.org/),构建化合物-靶点相互作用网络。基于String数据库(https://string-db.org/)获取活性成分和疾病的交集靶点的高置信度PPI网络信息,在Cytoscape软件中构建靶点间相互作用网络,使用“NetworkAnalyzer”工具对网络进行拓扑分析,根据拓扑参数筛选核心化合物和核心靶点。
1.4 器官定位
将朱茯苓治疗失眠的潜在靶点上传至BioGps数据库(http://biogps.org/)进行器官定位分析,并绘制靶点的器官定位图。
1.5 GO功能和KEGG通路富集分析及化合物-靶点-通路网络的构建
将朱茯苓治疗失眠的潜在靶点上传至David6.8数据库(https://david.ncifcrf.gov/),选择物种和背景为人(Homo sapiens),进行GO功能富集分析及KEGG通路富集分析并在Cytoseape软件中构建化合物-靶点-通路网络。
1.6 分子对接验证
根据上述筛选出的活性成分和核心靶点,从PDB数据库(http://www.rcsb.org/)获取相应靶点的蛋白结构,使用Autodock_vina软件(http://vina.scripps.edu/)对靶点与核心活性成分和阳性对照药物艾司唑仑(estazolam)进行分子对接验证。
1.7 Western blot检测小鼠脑组织中GABRA1及GABRG2的表达
1.7.1 药材、试剂和仪器
艾司唑仑片(20180710,常州四药制药有限公司);朱砂拌白茯苓饮片(2017101808,上海余天成中药饮片有限公司);戊巴比妥钠(626Y9216,美国Sigma公司);GABRA1单克隆抗体、GABRG2单克隆抗体、β肌动蛋白(β-actin)(AH01126063,AC072366,AH11279138,北京博奥森生物技术有限公司);Allegra 64R台式高速冷冻离心机(美国Beckman Coulter公司);PowerPac Basic 型蛋白电泳仪(美国Bio-Rad公司)。
1.7.2 动物
健康SPF级ICR雄性小鼠,体重<15 g,购于上海斯莱克实验动物有限责任公司,实验动物许可证号:SCXK(沪)2017-0005。
1.7.3 实验方法
将30只健康SPF级雄性ICR小鼠适应性饲养7天后,随机分为生理盐水组、艾司唑仑组、朱茯苓水煎液低、中、高剂量组,分别灌胃相应浓度的药液(艾司唑仑药液剂量为0.15 mg/kg,朱茯苓水煎液低中高剂量分别为1.14、2.28和4.55 g/kg),给药体积20 mL/kg,每天1次,连续灌胃7天,于末次给药50 min后腹腔注射戊巴比妥钠阈剂量并禁食12 h,脱颈椎处死小鼠,于冰浴皿上快速取出大脑,剥去脑膜,用预冷的生理盐水洗净,滤纸吸干后,然后取脑组织加入裂解液,冰上裂解1 h后高速离心取上清,测定组织蛋白浓度,以PAGE凝胶电泳分离蛋白样品。按照说明书提供的分子量条带选定切胶范围,湿法转膜,用封闭液封闭1 h(含5%脱脂奶粉的TBS-T缓冲液)。室温孵育后弃去封闭液,加入一抗在4 ℃孵育过夜,TBS-T洗5×5 min,加入二抗温育1 h,TBS-T洗5×5 min,最后进行显色。
2 结果
2.1 朱茯苓的活性成分及靶点预测
通过TCMSP平台、TCMID数据库、BATMAN-TCM数据库、STITCH数据库以及文献查阅,收集朱茯苓的活性成分并预测其潜在靶点,筛除重复化合物及缺少靶点预测的化合物后,使用Pubchem数据库验证活性成分的分子结构并获取PubChem CID等信息。结果共筛选朱茯苓活性成分33种,其中茯苓32种、朱砂1种,经过Uniprot筛选和校正的潜在靶点有267个。表1为朱茯苓的活性成分信息。

表1 朱茯苓的活性成分信息
2.2 化合物-靶点网络
在Cytoscape中构建朱茯苓的化合物-靶点相互作用网络,使用Network Analyzer进行拓扑分析。化合物-靶点网络共有300个节点(包括 33个化合物和267个靶点),453条边。网络中一个节点的度(degree)表示网络中和节点相连接的路线条数,活性成分度值越高,作用的潜在靶点越多,活性成分的度值越高说明该成分越可能是核心活性成分。该网络中每个活性成分平均有13.7个靶点,度值中位数为9。拓扑分析结果显示,15个活性成分的作用靶点≥10个,其中麦角胺(8223)、齿孔醇(9803310)、腺嘌呤(190)、去氢齿孔酸(15250826)等四个活性成分的作用靶点≥30个,上述15个高度值活性成分可作为朱茯苓的核心活性成分。图1为朱茯苓的化合物-靶点相互作用网络,橙色节点为靶点,蓝色节点为活性成分,其中深蓝色节点为核心活性成分。表2为degree≥10的核心活性成分拓扑参数表。

表2 核心活性成分拓扑参数表
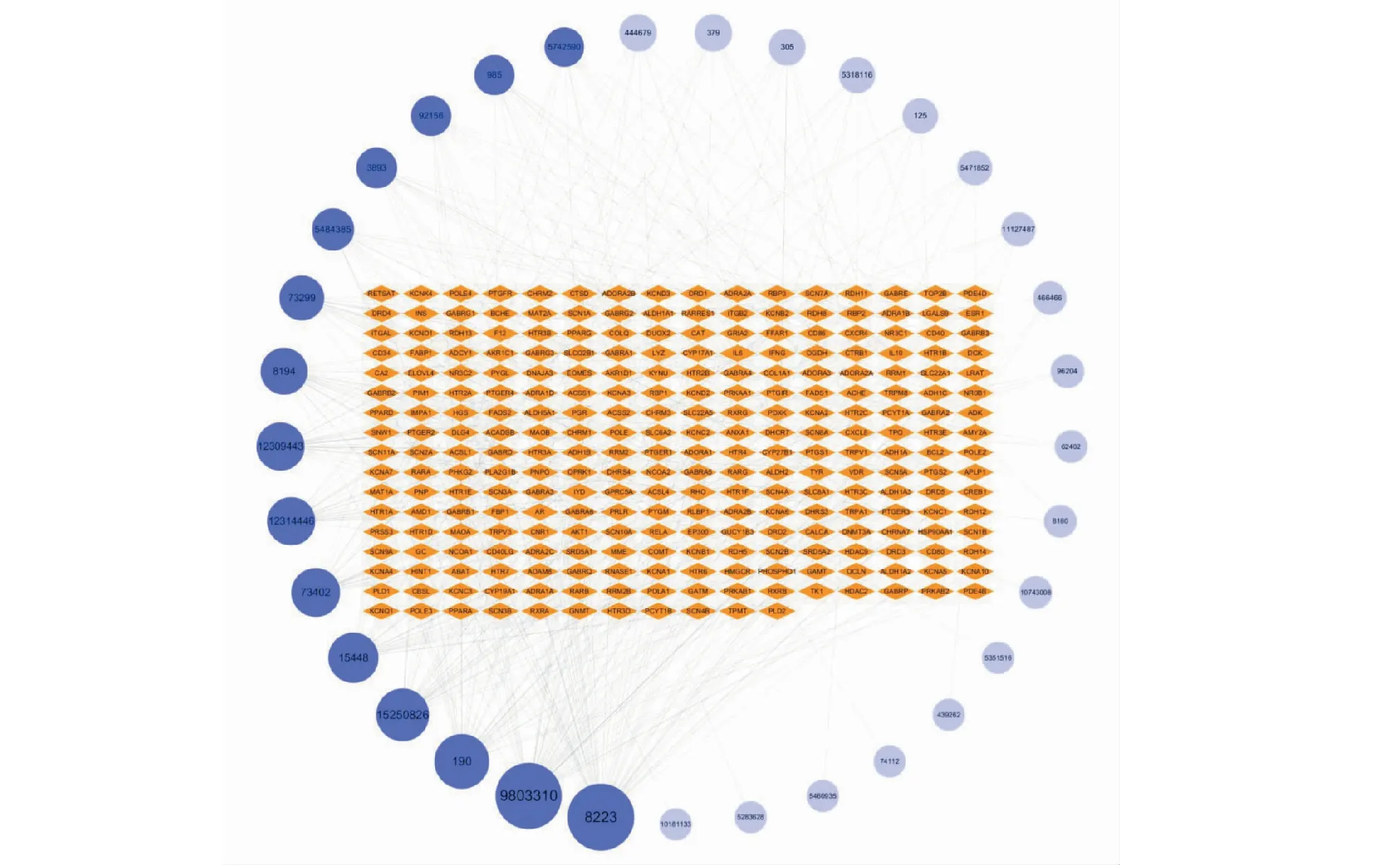
图1 朱茯苓治疗失眠的化合物-靶点网络图Fig.1 The compound-target network of Zhufuling in the treatment of insomnia
2.3 交集靶点间的相互作用网络
从OMIM数据库、TTD数据库、CTD数据库和GeneCards数据库共筛选到258个失眠相关靶点,朱茯苓的潜在靶点与失眠相关靶点共存在36个交集靶点,将36个交集靶点上传String数据库,获得高置信度的靶点间相互作用信息,在Cytoscape中构建交集靶点间的相互作用网络。使用Network Analyzer进行拓扑分析,结果为介度中心度(betweenness centrality,BC)中位数为0.026 338 32,紧密中心度(closeness centrality,CC)中位数为0.45,度(degree)中位数为5,表3为核心靶点的拓扑参数表,图2为朱茯苓治疗失眠的预测靶点间相互作用网络图,节点直径与度值大小成正比,深色节点为核心靶点。结果表明共有13个靶点的拓扑参数满足上述中位数卡值,可作为朱茯苓治疗失眠的核心靶点。
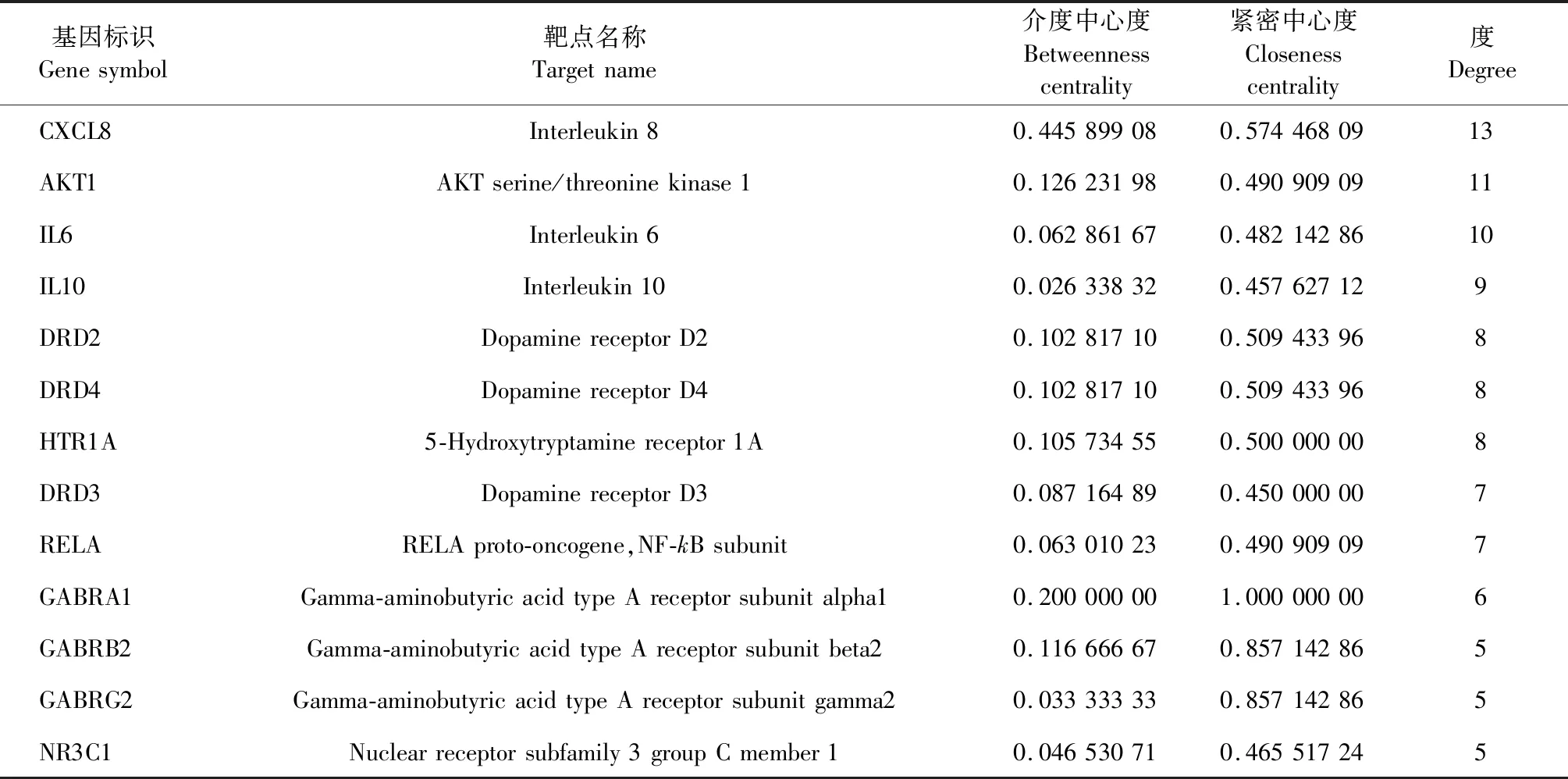
表3 朱茯苓治疗失眠的核心靶点拓扑参数表
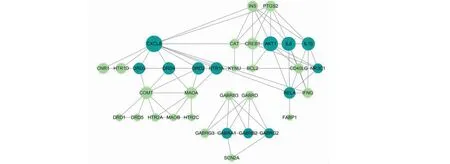
图2 朱茯苓治疗失眠的靶点蛋白高置信度交互作用网络图Fig.2 The high confidence interaction network of target protein of Zhufuling in the treatment of insomnia
2.4 器官定位结果
基于BioGps数据库对朱茯苓治疗失眠的潜在靶点进行器官定位分析,结果见图3,图3为朱茯苓治疗失眠潜在靶点的器官定位图,其中深红色靶点为核心靶点。结果表明36个交集靶点中11个靶点作用于脑,6个靶点作用于心,3个靶点作用于肝,2个靶点作用于肺,14个靶点作用于淋巴、小肠等其他器官。说明朱茯苓主要通过对脑、心及淋巴等器官的共同作用实现对失眠的治疗效果。
2.5 富集分析结果
图4为GO功能富集分析条形图,GO功能富集分析共富集到P<0.05的GO条目189个,包括154个生物过程(biological process,BP)条目、16个细胞组分(cell components)条目、19个分子功能(molecular function)条目。其中GABA信号通路(gamma-aminobutyric acid signaling pathway)、5-羟色胺(5-HT)信号通路(serotonin receptor signaling pathway)、多巴胺(DA)突触传递(synaptic transmission,dopaminergic)、GABA-A型受体活动(GABA-A receptor activity)等条目P值小且与失眠密切相关。图5为KEGG通路富集分析气泡图,KEGG通路富集分析共富集到24条与失眠相关的通路,其中刺激神经组织的互动(neuroactive ligand-receptor interaction)、DA能神经突触(dopaminergic synapse)、5-HT神经突触(serotonergic synapse)、逆行神经信号(retrograde endocannabinoid signaling)、cAMP信号通路(cAMP signaling pathway)、GABA受体神经突触(GABAergic synapse)等条目P值最小。
2.6 化合物-靶点-通路网络
在Cytoscape中构建化合物-靶点-通路网络,图6为朱茯苓治疗失眠的化合物-靶点-通路网络图,其中深绿色节点为核心活性成分,深蓝色节点为核心靶点。网络共有79个节点和188条边,包括24种活性成分,33个靶点和24条KEGG通路。可见,朱茯苓通过多种成分的多个靶点作用于多条失眠相关的通路,实现对失眠的治疗作用。
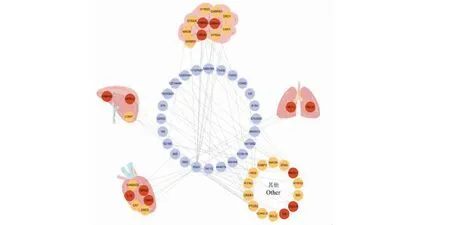
图3 朱茯苓治疗失眠潜在靶点的器官定位图Fig.3 The organ location map of potential target of Zhufuling in the treatment of insomnia
2.7 分子对接结果
选取两个核心靶点GABRA1和GABRG2与相应核心活性成分进行分子对接。从PDB数据库筛选的GABRA1受体蛋白PDB-ID为6HUK,Ligand-ID为HOZ;GABRG2受体蛋白PDB-ID为6HUJ,Ligand-ID为NAG。使用分子对接模拟软件Autodock_vina对GABRA1、GABRG2两个靶点与10个核心活性成分及阳性对照药物艾司唑仑进行分子对接验证,计算活性成分、艾司唑仑与受体蛋白间的最低结合能。
表4为分子对接最低结合能计算结果,图7为茯苓酸与两种受体蛋白的分子对接可视化结果。表4结果表明所有活性成分与受体蛋白的最低结合能均远小于-5.0 kJ/mol,结合图7的分子对接可视化结果,可以说明,GABRA1、GABRG2两个靶点能够与活性成分自发结合并借助氢键等分子间作用力形成较为稳定的构象。
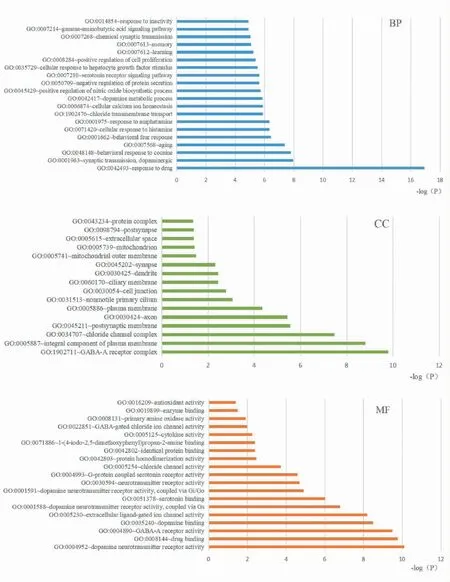
图4 GO生物功能富集条形图Fig.4 The bar chart of GO biological function enrichment
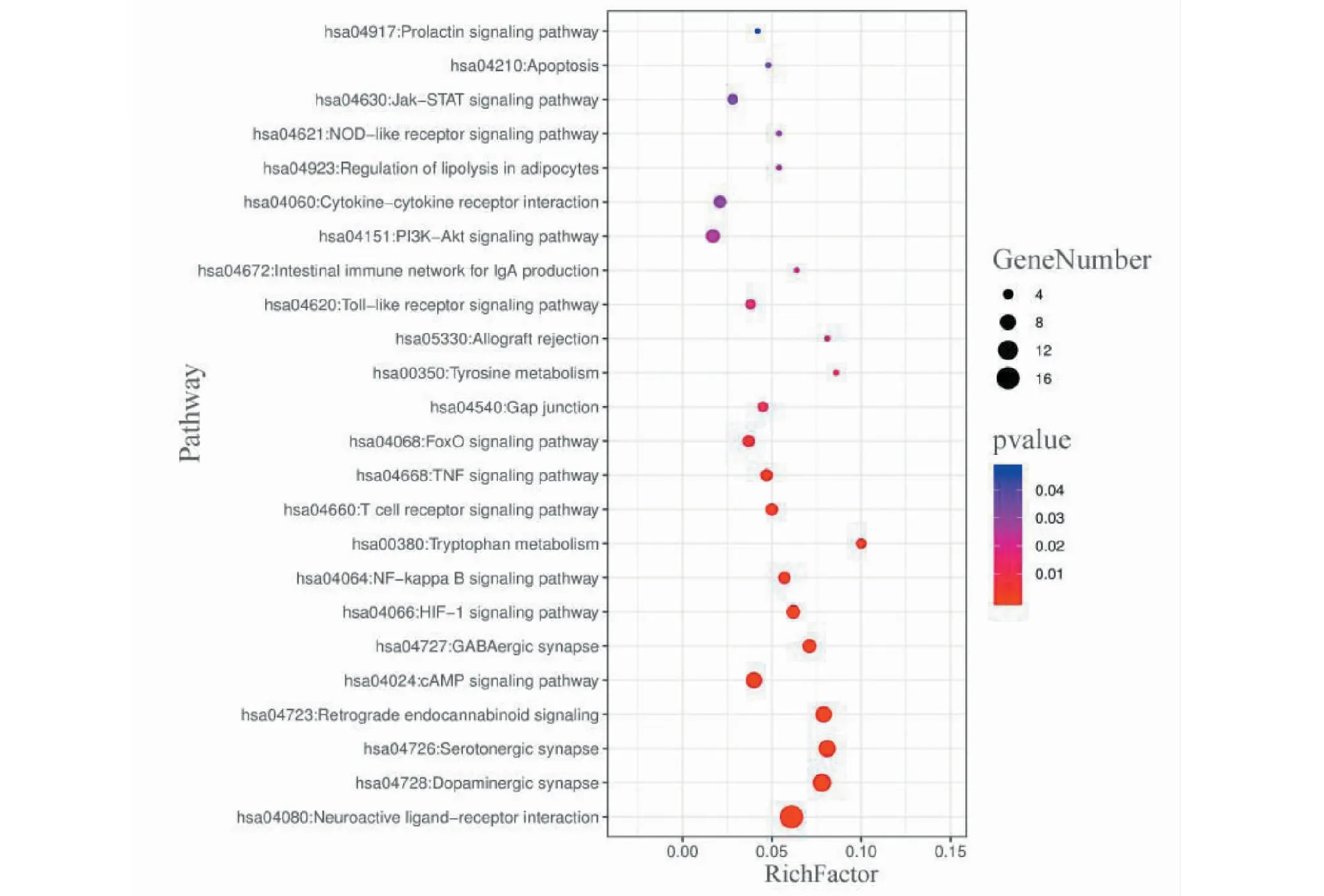
图5 KEGG通路富集分析气泡图Fig.5 The bubble chart of KEGG pathway enrichment analysis
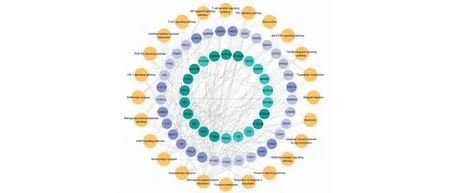
图6 朱茯苓治疗失眠的化合物-靶点-通路网络Fig.6 The compound-target-pathway network of Zhufuling in the treatment of insomnia
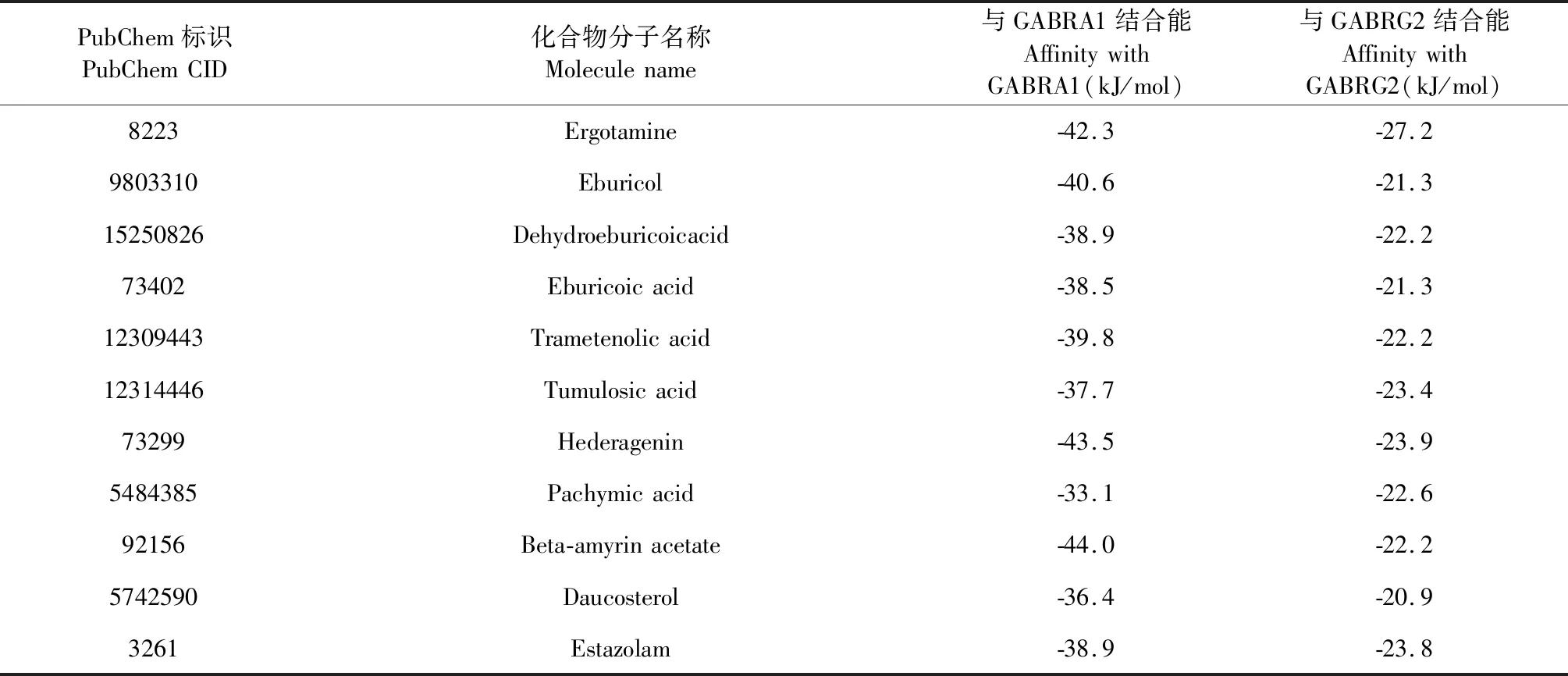
表4 活性成分与受体蛋白的最低结合能
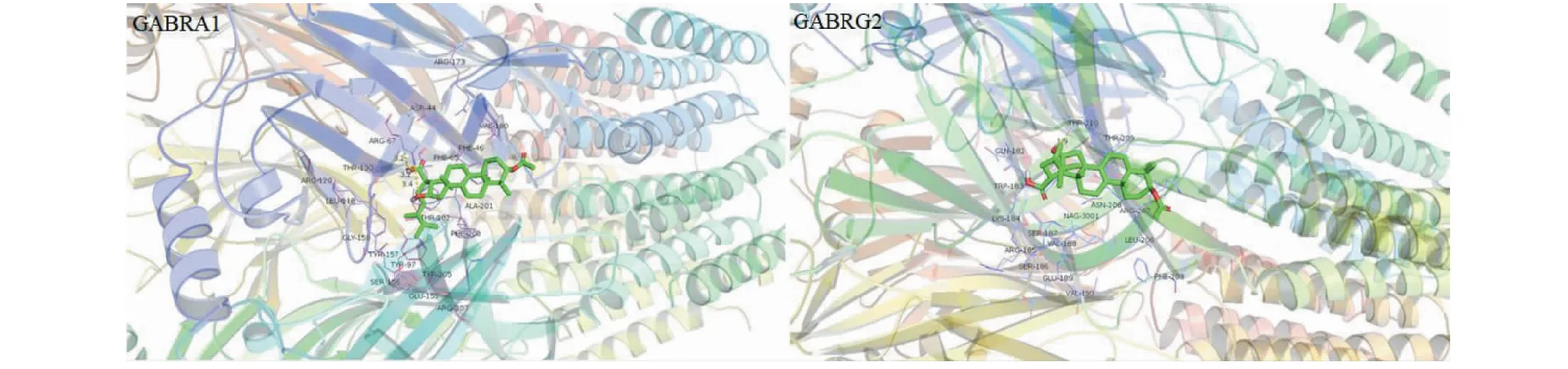
图7 茯苓酸(5484385)与两种受体蛋白的分子对接可视化结果Fig.7 The visualization results of molecular docking between pachymic acid (5484385) and two receptor proteins
2.8 朱茯苓对小鼠脑组织 GABRA1和GABRG2蛋白表达的影响
Western blot结果见图8和图9。与生理盐水组比较,朱茯苓中、高剂量组小鼠脑组织中GABRA1和GABRG2蛋白表达明显增加(P<0.01)可以说明朱茯苓在一定剂量时可以促进GABRA1和GABRG2蛋白的表达。

图8 各组小鼠脑组织中GABRA1和GABRG2蛋白表达电泳Fig.8 The expression electrophoresis of GABRA1 and GABRG2 in brain tissue of mice in each group注:1~5分别为生理盐水、艾司唑仑、朱茯苓水煎液低、中、高剂量组。Note:1-5 are saline,estazolam,Zhufuling water decoction low,medium and high dose groups,respectively.
3 讨论
朱茯苓具有镇静安神的功效,是治疗失眠不寐的常用中药,临床上应用广泛且疗效显著。本研究基于多成分、多靶点作用的研究思路,应用网络药理学技术,分析朱茯苓治疗失眠的靶点,阐述朱茯苓治疗失眠的机制,为朱茯苓的实验研究及临床应用提供科学依据。
茯苓主要含三萜类和多糖类两种化合物,此外还含有其他成分如甾体类、氨基酸、挥发油、胆碱、腺嘌呤及钾盐等微量元素[10]。在化合物-靶点网络中高度值、含有多个作用靶点的核心活性成分多为三萜类化合物及其衍生物,如茯苓酸(5484385)、土莫酸(12314446)、齿孔酸(73402)、去氢齿孔酸(15250826)等。三萜类化合物具有广泛的药理活性,如利尿、抗氧化、抗肿瘤、抗炎、镇静等[11]。有研究表明,茯苓总三萜能对抗电休克及戊四唑惊厥发作,其机制与降低海马区门冬氨酸(Asp)和谷氨酸(Glu)含量有关,具有镇静兴奋性神经元和抗惊厥等作用[12]。Gao等[13]研究发现茯苓总三萜具有显著的镇静作用,并能调节大脑中GABA和Glu的含量。朱砂是一种矿物药,归心经,中医以其为安神要药,临床上主要用于失眠多梦,心悸易惊,小儿惊风等,具有解毒安神、清心镇惊的功效,效果较好。Li等[14]对朱砂进行的研究结果显示,朱砂的抗心律失常作用可能是其镇心安神功效的主要基础之一。朱砂含有HgS、MgS、Bi、Fe、Ba、Mn、Sb、As、Hg2+、HgCl2等[15],HgS 不溶于水,在机体内很难吸收,但它是朱砂的主要活性成分,可在人体内酸效应及络合效应的作用下发生解离,并与体内的氨基酸等生物分子发生络合反应后生成具有强烈生理活性及毒性较小的络合物从而发挥药效[16]。朱砂所含的可溶性汞盐溶于水,游离汞和微量金属元素不溶于水,朱砂的主要毒性成分是可溶性汞盐[17],由于朱砂有毒,因此临床上使用朱砂时一般需将其采用水飞法炮制后再使用,水飞可降低朱砂中的可溶性汞盐含量,从而达到减毒增效的作用。朱茯苓,其实就是朱砂均匀拌于茯苓的表面而制得的,因此朱茯苓含有朱砂和茯苓两种中药,其中朱砂用量较少,因此笔者猜测朱茯苓发挥镇静安神作用的成分主要来源于茯苓,而朱砂可能是通过与茯苓相协同,达到增强宁心安神的效果。在进行网络药理学的研究时,朱茯苓同时具有朱砂和茯苓两种中药的化学成分,然而TCMID和BATMAN-TCM等数据库中所对应的朱砂的成分只提供了HgS的信息,因此在活性成分的选择上,选取了茯苓的比较常用的活性成分和朱砂中的主要成分HgS。在活性成分筛选时考虑活性成分的OB值和DL值,并结合文献报道,纳入某些OB和DL值很低但文献报道其活性较好的活性成分。

图9 朱茯苓水煎液不同剂量对小鼠脑组织GABRA1和GABRG2 蛋白表达的影响(n=3)Fig.9 Effect of Zhufuling decoction on protein expression of GABRA1 and GABRG2 in brain tissue of mice (n = 3)注:与生理盐水组比较,**P<0.01。Note:Compared with the normal saline group,**P<0.01.
基于BioGPS数据库进行的交集靶点器官定位分析结果显示,朱茯苓主要通过作用于脑、心、肺、肝、淋巴等器官实现对失眠的干预效果。中医认为脑为“元神之府”,主生命活动、精神意识及感觉运动,脏象学说将脑的生理病理统归于心而分属于五脏中。心为“君主之官”,主藏神,与脑协同作用调控人的精神、意识、思维等;主血脉,将血上供于脑,血足则脑髓充盈。心脑相通,则神志活动正常,睡眠良好。同时朱茯苓潜在靶点的多器官分布体现了中医理论的整体观,即各脏器间互相影响、互相联系、协同作用,实现对整个机体的调节[18]。
利用Autodock_Vina对GABRA1和GABRG2两个靶点与10个核心活性成分进行分子对接验证,结果显示上述两个靶点的受体蛋白均能与核心活性成分较稳定的自发结合,而且大部分活性成分与靶点蛋白的最低结合能高于阳性对照的最低结合能。由此可以推测,朱茯苓可能通过茯苓酸等活性成分作用于GABA受体,从而达到治疗失眠的效果。
在Western blot实验验证部分结果显示,相对于空白组,艾司唑仑组、朱茯苓中、高剂量组小鼠脑组织中GABRA1和GABRG2蛋白表达明显增加(P<0.01),说明朱茯苓能够提高脑内GABRA1和GABRG2两种受体蛋白的表达,证实了朱茯苓是通过对GABRA1、GABRG2两个核心靶点的基因及蛋白的直接作用,从而发挥其药理作用的。同时,Shah等[19]的研究发现,茯苓酸可通过介导GABA能系统增强戊巴比妥的催眠作用,茯苓酸可以改变GABA-A受体各亚基的水平从而达到镇静催眠的效果,与Western blot实验结果共同印证了分子对接结果的合理性。
GO功能和KEGG通路富集分析结果中,GABA信号通路、5-HT信号通路、5-HT神经突触、GABA受体神经突触、DA突触传递等条目P值较小且富集基因较多。GABA是一种抑制性神经递质,具有催眠、镇静和抗焦虑等功能。GABA的调控通过GABA受体发挥作用,α1与β2和γ2组成的GABA-A受体亚型在脑内数量最多,约占全部GABA-A受体的43%[20]。Jiang等[21]发现内因性失眠症患者中枢重要的抑制性神经递质GABA显著降低。Winkelman等[22]从质子磁共振谱得出,原发性失眠患者GABA水平较对照组低30%。大多数镇静催眠药物共有的主要药理作用机制是通过神经递质GABA或通过刺激GABA-A受体、抑制5-HT的1A受体发挥镇静作用,GABRA等基因所参与的神经活性配体-受体相互作用通路与神经递质的传递在失眠的治疗过程中发挥着重要的作用[23]。5-HT和DA是大脑内单胺类神经递质,5-HT的各受体亚型具有调节睡眠、觉醒周期的作用,激动突触前5-HT1A自身受体,可延长慢波睡眠,减少觉醒;激动突触后5-HT1A受体,可抑制睡眠并促进觉醒[24]。DA起着维持觉醒和行为兴奋的作用。当各种原因使其维持觉醒和行为兴奋的作用受到抑制时,亦可影响睡眠、觉醒周期。相关研究证明[25],失眠患者的5-HT、DA水平与健康人群存在明显差异,而通过药物改善患者的5-HT、DA水平,可以有效地改善患者的失眠症状。由此可见,朱茯苓对GABA、5-HT和DA等神经递质的调节可能是朱茯苓治疗失眠的重要机制。
综上所述,本研究应用网络药理学方法对朱茯苓治疗失眠的靶点进行了分析,对36个交集靶点进行了器官定位分析,对GABRA1和GABRG2两个靶点进行了分子对接模拟,验证了GABA能系统机制的重要作用及核心活性成分筛选的合理性,为实验验证提供依据。化合物-靶点-通路网络体现了朱茯苓多成分、多靶点、多途径的作用特点。富集分析结果提示GABA信号通路、5-HT信号通路、DA突触传递等通路和生物过程的重要作用。本研究为朱茯苓治疗失眠机制的进一步研究提供了新思路和新方法,为朱茯苓的临床应用提供了科学依据。

