伊马替尼治疗慢性髓性白血病患者早期分子学反应的危险因素分析
张淳嘉,吴爱玲,郑小玲,郑丹钿,夏维林
慢性髓性白血病(CML)是一种造血干细胞的恶性克隆增殖性疾病,具有特征性的费城染色体和(或)BCR/ABL融合基因,其编码产物导致酪氨酸激酶活性失控,诱导细胞恶性转化和增殖,是疾病的发病机制[1-2]。酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)是针对酪氨酸激酶靶向治疗的小分子抑制剂,自21世纪初第一个TKI伊马替尼(imatinib,IM)面世以来,CML患者的疗效得到明显的改善,但仍然有部分患者在治疗过程中出现激酶突变、病情进展甚至疾病相关死亡,而更大一部分的患者虽然可长期生存,却因为长期服药及药物相关不良反应而生活质量明显下降。如何使患者更快获得更深的分子学缓解,达到无治疗缓解的治疗目标,是目前CML的前沿研究领域。近年来有大量临床研究证实,获得早期的分子学缓解,即TKI治疗后3个月的BCR/ABL融合基因转录水平≤10%,可使患者更快、持久达到深度分子学缓解,不仅使患者获得更持久的无进展生存(progress free survival,PFS)和8年总生存(overall survival,OS),甚至更有机会达到无治疗缓解。研究证实,以第2代TKI作为一线治疗,可更快达到更深度缓解,即更高几率达到早期分子学反应(EMR),然而第2代TKI比第1代价格更昂贵,致命性的严重不良事件更多,选择第2代TKI作为CML的一线治疗,目前仍然是存在争议的问题。既然EMR对CML的预后有如此重要的作用,将部分存在影响EMR危险因素的患者进行早期干预,如将第2代TKI作为一线治疗方案是否也是改善疗效的方法。本研究通过回顾性研究的方法,分析近年来在我院就诊CML患者使用TKI作为一线治疗的情况,研究可能存在的影响EMR的危险因素,为该领域提供一些临床数据,并指导以后的临床工作。
1 资料与方法
1.1 一般资料 回顾性研究2018年1月-2019年9月于广东省揭阳市人民医院就诊的CML患者72例,其中男39例,女33例,年龄10~81岁,中位年龄45岁。入组标准:(1)诊断均符合《中国慢性髓性白血病诊断与治疗指南(2016年版)》CML慢性期的诊断标准[3];(2)以第1代TKI伊马替尼作为一线治疗,初始治疗剂量为 400 mg,每天1次;(3)具有完整初诊资料及TKI治疗后中位3个月BCR/ABLIS水平。
1.2 研究方法 分析患者初诊时年龄、性别、外周血白细胞、血红蛋白、血小板计数、外周血嗜碱性粒细胞比例、外周血有无原始细胞、脾肋下长度、乳酸脱氢酶、附加遗传学异常(ACA)。以45岁作为年龄分界,以150×109/L作为患者是否存在明显白细胞升高的分界,将血红蛋白100 g/L及血小板计数350×109/L作为血红蛋白和血小板因素的分界,将脾肋下长度7 cm作为是否巨脾的分界,将乳酸脱氢酶1 000 U/L作为乳酸脱氢酶是否明显升高的分界,ACA定义为Ph染色体外的遗传学异常。
1.3 观察指标与方法 EMR定义为即TKI治疗后中位3(2.5~4.5)个月的BCR/ABLIS水平,BCR/ABLIS≤10%为达到EMR。采用国际标准化RQ-PCR进行BCR-ABL分子转录水平检测,符合《中国慢性髓性白血病诊疗监测规范(2014年版)》[4]的监测标准,以BCR-ABLIS表示。将各参数进行分组研究,比较每组患者治疗中位3个月时BCR/ABLIS水平,计算达到早期分子缓解(BCR/ABLIS水平≤10%)的比率。随访资料来源于住院病历和门诊病历,随访截止日期为2019年12月31日。
1.4 统计学方法 应用SPSS 21.0统计软件分析数据。单因素分析采用卡方检验,多因素分析采用多变量二分类logistic回归分析模型,P<0.05设定为差异有统计学意义。
2 结 果
2.1 单因素分析 72例患者治疗第3个月BCR/ABLIS水平≤10%为50例,>10%为22例,EMR率为69.44%(50/77)。ACA患者5例,发生率为6.94%,其中3例存在复杂染色体,包括t(9;22;17)(34;q11;q21),t(2;9;22)(q33;q34;q11),der(7;9)(q10;q10)及+22,der(22);1例患者存在-8异常,1例患者存在-16异常。外周血白细胞计数<150×109/L组早期缓解率高于白细胞计数≥150×109/L组(P=0.025);血红蛋白<100 g/L组早期缓解率明显低于血红蛋白≥100 g/L组(P=0.006);非巨脾组(脾肋下长度<7 cm)早期缓解率明显高于巨脾组(脾肋下长度≥7 cm)(P=0.001);外周血无原始细胞组早期缓解率明显高于外周血有原始细胞组(P=0.000);乳酸脱氢酶1 000≥U/L组早期缓解率低于乳酸脱氢酶<1 000 U/L组(P=0.016);ACA组早期缓解率明显低于无ACA组(P=0.001)。而不同年龄、性别、血小板计数、外周血嗜碱细胞比例组间比较差异均无统计学意义(P>0.05)。见表1。外周血白细胞计数明显升高、贫血、巨脾、外周血有原始细胞、乳酸脱氢酶明显升高、附加遗传学异常可能是影响伊马替尼作为一线治疗的CML慢性期患者EMR的危险因素。
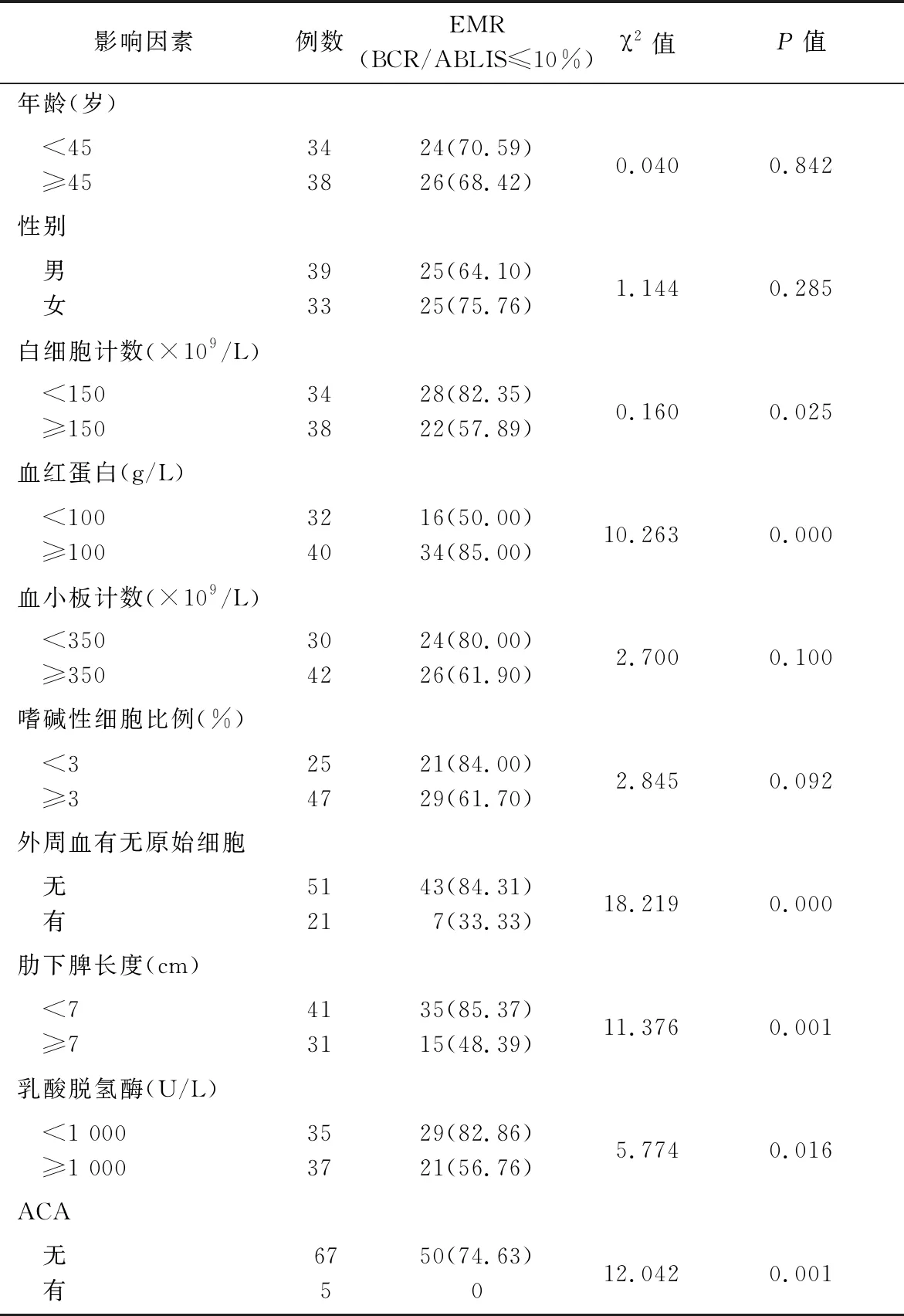
表1 影响EMR的单因素分析 [例(%)]
2.2 多因素分析 将单因素分析有统计学意义的因素,包括白细胞计数、血红蛋白、外周血有无原始细胞、脾肋下长度、乳酸脱氢酶、ACA引入多因素二分类logistic回归分析模型,结果提示外周血无原始细胞组早期缓解率明显高于外周血有原始细胞组(P=0.000);脾肋下长度≥7 cm组早期缓解率明显低于脾肋下长度<7 cm(P=0.009)。其他因素无统计学意义(P>0.05)。多因素分析提示,外周血有原始细胞、巨脾可能是患者EMR的独立危险因素。
3 讨 论
EMR对CML预后的重要性最初由Marin等[5]在2012年提出,该研究分析282例以伊马替尼作为一线治疗CML慢性期患者,发现在3个月BCR-ABLIS水平>9.84%的患者8年OS为56.9%,低于此临界值的患者8年OS为93.3%,差异有统计学意义(P<0.001),而第6、12个月按同样截止值分组的患者在OS、PFS及MMR上并无统计学差异。
关于CML的预后因素研究很多,最经典的Sokal、EURO、EUTOS三大积分预后系统,三个积分系统均认为外周血嗜碱性粒细胞升高及巨脾是CML的不良预后因素[6-8]。本研究纳入嗜碱性粒细胞及肋下脾长度两个因素,单因素及多因素结果都显示巨脾为获得EMR的不良预后因素,但嗜碱细胞比例均无统计学意义,考虑可能嗜碱性细胞比例对EMR预后不如对OS、PFS及深度缓解率的预后价值高,本研究为二分类变量研究可能存在一定局限,在以后扩大样本研究后,可考虑进行连续变量研究。
Ko等[9]认为贫血是独立于Sokal、Euro和EUTOS预后积分系统之外的重要的CML预后的独立危险因素,在一项入组154例患者、中位研究时间为54个月的前瞻性研究中,贫血组(Hb<100 g/L)达到第3个月EMR的比例明显低于非贫血组(Hb≥100 g/L)(50.0%vs.69.1%,P=0.006),且不管是在6个月的EMR,还是12个月的细胞遗传学反应,贫血均显示更高的风险。本研究单因素分析显示贫血为达到EMR的不良预后因素。
ACA是指Ph染色体之外的遗传学异常,研究显示,约5% CML患者初诊时存在ACA,普遍认为这是一类预后不良因素,O′Brien等[10]研究认为,存在ACA的患者对甲磺酸存在天然耐药,故对第一代TKI甲磺酸伊马替尼治疗反应欠佳,有研究认为该类患者更容易发生急变,欧洲白血病协会[11]将ACA定义为“警告”级别,建议该类患者在治疗过程中要进行更严密的监测。本研究入组72例患者,5例患者存在ACA,占比6.94%,全部未能达到EMR,缓解率明显低于非ACA组,由于本研究样本量少,仅有5例患者出现ACA,故结果尚欠缺说服力,有待后续增加样本量。
乳酸脱氢酶在许多血液系统疾病均明显升高,在淋巴瘤、多发性骨髓瘤中也是比较明确的预后不良因素,急性、慢性白血病中乳酸脱氢酶普遍升高,可能与细胞的破坏相关,CML患者普遍存在初诊时乳酸脱氢酶明显升高,本研究将1 000 U/L作为界限将患者分为两组,单因素分析提示乳酸脱氢酶是导致患者未能达到EMR的不良因素,但未找到相关文献,有待后续扩大样本再次验证。
骨髓和外周血原始细胞的比例是CML患者分期的主要依据,CML慢性期患者外周血及骨髓的原始细胞均应小于10%,在10%范围内,外周血原始细胞比例是否影响患者的预后,TKI时代的预后积分系统EUTOS已经不包括原始细胞比例,本研究显示在慢性期患者,外周血原始细胞比例是EMR的独立危险因素[12-13]。
综上所述,外周血白细胞计数明显升高、贫血、巨脾、乳酸脱氢酶明显升高、ACA可能是影响伊马替尼作为一线治疗的CML慢性期患者获得EMR的危险因素;巨脾、外周血存在原始细胞可能是患者达到EMR的独立危险因素。由于研究样本量太少,存在一定局限性,有待于以后扩大样本、延长观测时间、增加观测指标如深度缓解率、完全遗传学缓解率等改善。

