聚乙二醇引发对盐胁迫下棉种萌发及生理特性的影响
肖 爽 韩雨辰 号宇然 王晓蕾 刘连涛 孙红春 张永江 李存东
(河北农业大学农学院/省部共建华北作物改良与调控国家重点实验室/河北省作物生长调控重点实验室,河北 保定 071001)
土壤盐渍化是农作物生产中面临的主要胁迫因素之一,土壤盐分是影响作物出苗率的重要因素[1]。据联合国粮农组织统计,全球盐碱化土地约9.5亿hm2,占全球陆地面积的10%,且土壤次生盐碱化面积还在不断增加[2]。第二次全国土壤普查资料显示,我国盐渍土面积为9 913万hm2,常规作物在盐分较高的土壤中无法正常生长,严重制约我国种植业的发展[3]。
棉花(GossypiumhirsutumL.)是世界性的重要经济作物,耐盐性较强,被誉为盐碱地上的“先锋植物”[4]。据报道,土壤中存在适度的盐可以促进棉种萌发、棉苗生长,以及产量的提高和品质的改善,虽然棉花对盐碱有一定的忍耐力,但当土壤中盐分过高时则会给棉花的生长带来不可逆的危害,导致棉花出苗率降低,甚至引起产量下降[5]。种子萌发作为种子植物生命周期的起始和关键阶段,其优劣将直接影响棉花的正常生长,最终决定其产量和品质[6-8]。且萌发阶段也是作物对盐胁迫最敏感的时期,盐胁迫可引起渗透胁迫、离子失衡和氧化损伤等[9],阻碍种子渗透吸水,进而影响种子萌发,并对作物生长和产量产生影响[10]。因此,种子萌发阶段的耐盐性是表征棉花抗盐能力的重要依据之一[4]。
目前有大量研究通过一些物理、化学方法处理种子,以达到促进作物生长、种子萌发,进而提高种子抗逆性和种子活力的目的[11-13]。其中,种子引发是一项有效提高种子活力的处理技术,该技术又称为渗透调节,由Heydecker等[14]首次提出,是一种可以提高种子抗逆性的处理方法[15]。目前该方法已经发展成一种不可或缺的增强植物抗逆性的方法[16],在种子萌发前用天然或合成物质对种子进行处理,使其产生特异生理反应,是一种对其不造成伤害的预处理技术[17]。目前大量研究发现种子引发可以增强种子在胁迫环境下的活力,改善种子发芽情况,加快种子出苗速度,使出苗整齐一致[18]。种子的引发效果通常会因引发温度、引发时间、种子类型和引发剂种类的不同而异[19-20]。
本研究以种子引发的方式处理棉花种子,以聚乙二醇(polyethylene glycol,PEG-6000)作为引发剂,分析种子引发对盐胁迫下棉种萌发的影响,旨在探究PEG作为引发剂提高种子活力的机理,为农业生产利用提供参考依据,为进一步提高盐渍化土壤中棉花的出苗率提供参考。
1 材料与方法
1.1 试验材料与试剂
试验于2018—2019年于河北农业大学棉花生理生态实验室进行。供试棉花品种为国欣棉9号,由河北河间国欣农研会提供。PEG-6000购于北京索莱宝科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢(H2O2)、丙二醛(malondialdehyde,MDA)测定试剂盒购于南京建成生物工程研究所;根系活力测定试剂盒购于北京雷根生物技术有限公司。
1.2 最佳引发条件筛选
1.2.1 引发方法 种子引发与回干处理参照闵丹丹等[21]的方法。使用5%次氯酸钠对棉花种子消毒15 min,流水冲洗2min,然后用不同质量浓度(0、50、100、150 g·L-1)的PEG-6000于15℃黑暗环境下各引发6、12、24 h。待达到相应的引发时间后将种子取出,用蒸馏水快速冲洗种子数次后用吸水纸将种子表面的水分吸干,于室内通风处(20~25℃,相对湿度40%~45%)回干,通过称重法确定种子含水量达到初始含水量后即可用于后续发芽试验。
1.2.2 发芽试验 在25℃黑暗条件下对不同引发处理回干后的种子进行发芽试验。采用纸上萌发法,培养皿和滤纸经121℃高温灭菌20min。将供试种子均匀排放于两层滤纸上,种子上部再加盖一层滤纸,之后分次均匀地滴入10 mL蒸馏水,使上下层滤纸全部润湿,每皿放置50粒,每处理设置6个重复,以未经引发的种子作为对照(CK)。每24 h视情况补充培养皿内蒸馏水。
1.2.3 测定项目 以芽长超过种子长度1/2记为发芽,2 d内无种子发芽视为发芽试验结束(本试验为7 d),根据公式计算发芽势(germination potential,GP)与发芽率(germination rate,GR)[22]:
1.3 盐胁迫对引发和未引发种子萌发特性的影响
1.3.1 试验设计 利用1.2中筛选出的最佳引发条件对种子进行引发(引发和回干操作同1.2.1)。使用未引发和引发后经过回干的种子在前期预试验确定的0、50、100、150 mmol·L-1NaCl溶液中进行发芽试验,每处理设置6次重复,每重复50粒种子,以未经引发的种子作为对照(CK)。
1.3.2 测定指标 发芽试验期间每天记录发芽种子数,除计算GP、GR外,按照公式计算发芽指数(germination index,GI)[23]、活力指数(vital index,Ⅵ)[24]和平均发芽时间(mean germination time,MGT)[25]:
于萌发试验的第2、第4、第6天将棉种种皮剥除后,按照试剂盒说明测定各处理种子SOD、POD活性和MDA含量。并于萌发试验7 d切取各处理的棉花幼根,使用氯化三苯基四氮唑(2,3,5-triphenytetrazoliumchloride,TTC)比色法测定根系活力,具体测定方法按试剂盒说明操作,每处理设置3次重复;使用Epson Perfection V330扫描仪(日本Suwa公司)对萌发7 d后的棉种幼根进行扫描,以TIF图像文件存档,用WinRHIZOTron MF 2012a根系分析软件(Regent Instruments Inc.,Quebec,Canada)对幼根的形态数据进行分析,每处理设置5次重复。
1.4 数据统计方法
试验数据通过使用SPSS 22.0进行单因素方差分析(ANOVA)后做平均值多重比较(Duncan),显著性检验水平为5%。所有数据均以平均值±标准差表示。
2 结果与分析
2.1 种子引发条件筛选
由表1可知,与CK相比,PEG-6000浓度为0(即蒸馏水)引发6、12、24 h对棉种的发芽势几乎没有影响,蒸馏水引发12 h后反而使发芽率发生了显著下降。使用5%PEG-6000对种子进行6、12、24 h的引发均会造成棉种发芽势显著提升,分别比CK提高了13.34、20.67和16.67个百分点;但到种子萌发的最后阶段,唯有引发12 h棉种的发芽率与CK相比达到了显著性水平,说明不同浓度的PEG-6000可能是通过促进种子萌发前期的发芽速度来提高种子发芽率的。当PEG-6000浓度提高至10%后,引发6 h和12 h种子的发芽势与CK相比显著提高了7、67和19.67个百点,仅引发12 h种子的发芽率较CK显著提升。当PEG-6000浓度提高至15%之后,引发处理对种子发芽势、发芽率呈现出显著的抑制作用。综合上述结果可知,以5%PEG-6000引发12 h为最佳的棉种引发条件。
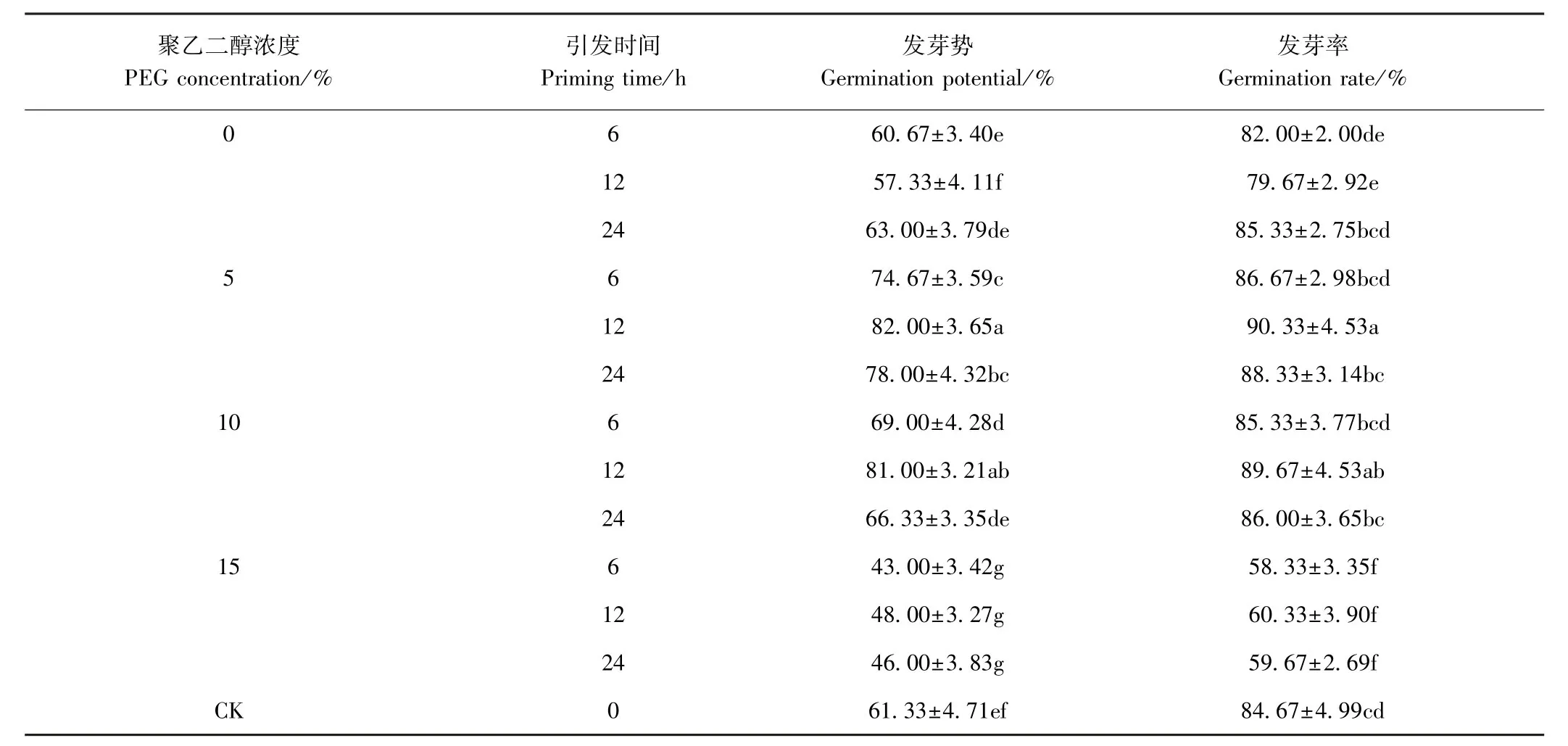
表1 不同引发剂和引发时间对种子发芽势和发芽率的影响Table1 Effect of different primer and priming time on GP and GR
2.2 盐胁迫下引发和未引发处理对棉种萌发特性的影响
由图1可知,不同浓度NaCl胁迫对棉种萌发均具有抑制作用,且随着NaCl浓度的升高,引发和未引发种子的发芽率与发芽势均呈现下降的趋势。在0、50、100、150 mmol·L-1NaCl胁迫下,经过引发种子的发芽势较未引发种子分别提高了32.67、25.67、30.33和18.00个百分点,均达到了显著水平(图1-A)。虽然引发处理对盐胁迫下种子发芽率的影响幅度没有发芽势明显,但仍显著促进了不同盐浓度下种子的萌发,与未引发种子相比,引发后种子的发芽率在0、50、100 mmol·L-1的NaCl胁迫下提高了19.20、19.33、34.80和23.00个百分点,至NaCl浓度达到150 mmol·L-1,其发芽率是未引发种子的2倍多(图1-B)。
棉种发芽指数和活力指数的变化趋势均与NaCl浓度的变化趋势大体表现出负相关,即随着NaCl浓度的提高呈逐渐降低的趋势(图2),说明50~150 mmol·L-1NaCl会抑制棉种的萌发。在不同浓度的盐胁迫下,引发后的种子发芽指数是未引发种子的2.08~3.95倍(图2-A)。在0、50、100、150mmol·L-1NaCl胁迫下,活力指数分别较未引发的种子提高了161.83%、135.21%、310.83%和444.53%(图2-B)。而引发处理仅在0、150 mmol·L-1NaCl胁迫下显著缩短了平均发芽时间(图2-C)。
2.3 盐胁迫下引发和未引发处理对棉种形态特性的影响
由表2可知,引发、未引发的棉花种子在0~150 mmol·L-1NaCl胁迫下其下胚轴长和根长均呈现出先升高后降低的趋势,且高峰皆在50 mmol·L-1NaCl处理,说明低浓度的NaCl对棉花种子的下胚轴长和根长具有一定的促进作用。经过引发处理的种子在0、50、100、150 mmol·L-1NaCl处理下,下胚轴长分别较未引发棉种提高了17.95%、30.37%、19.92%和39.05%,根长分别提高了16.60%、12.93%、20.87%和36.78%。但根表面积和平均根系直径并未随之增加,反而使主根更加细长。
2.4 盐胁迫下引发和未引发处理对棉种根系活力的影响
由图3可知,无论种子是否经过引发处理,在不同浓度NaCl胁迫下进行发芽试验7 d后,其根系活力均随着NaCl浓度增加呈逐渐降低的趋势,同时也可以看出种子引发处理能够增强盐胁迫下的根系活力,在0、50、100、150 mmol·L-1NaCl胁迫下,引发处理后的根系活力较未引发处理增加了6.84%~39.32%,并在NaCl浓度为0、50、150 mmol·L-1时达到显著水平。
2.5 盐胁迫下引发和未引发处理对棉种SOD、POD活性的影响
由图4-A可知,随着NaCl浓度的升高,萌发2、4、6 d种子的SOD活性整体均呈降低趋势,且随着萌发时间的延长SOD活性呈下降趋势。萌发2 d时,在0、50、100、150mmol·L-1NaCl浓度胁迫下,引发处理种子的SOD活性较未引发种子分别提高了18.27%、7.81%、4.39%和15.43%,且差异均达到了显著性水平。萌发4 d时,在0、50、100 mmol·L-1NaCl浓度下,引发处理种子的SOD活性分别较未引发种子提高了25.62%、21.38%和0.92%。进入萌发6 d,虽然SOD的整体活性较萌发试验前期下降,但是引发处理的种子在0~150mmol·L-1NaCl胁迫下的SOD活性仍较未引发种子提高了8.62%、30.71%、35.81%和38.85%。由图4-B知,无论种子是否经过引发处理,POD活性均随着萌发时间的延长而下降。萌发2 d时,引发种子的POD活性仅在50 mmol·L-1NaCl下显著高于未引发种子。至萌发4 d,种子内部的POD活性发生骤降,在0、50、100 mmol·L-1NaCl浓度下,引发种子较未引发种子降低了0.75%、34.50%和1.74%,仅在高浓度盐胁迫下(150 mmol·L-1)引发处理对种子内部的POD活性表现出了促进作用。萌发6 d时,种子POD活性继续下降,但引发处理对种子POD活性的促进作用愈发明显,在0、100、150 mmol·L-1NaCl胁迫下,引发种子的POD活性较未引发种子分别提高了41.56%、9.51%和15.42%。
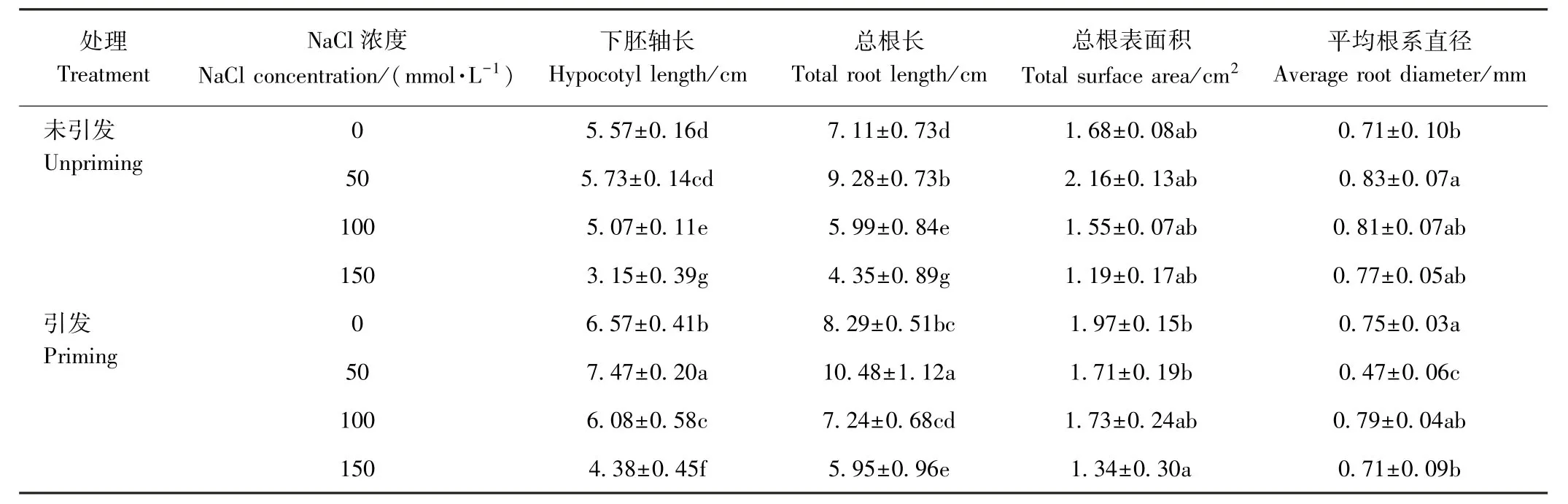
表2 引发与未引发处理对盐胁迫下种子形态特征的影响Table2 Effect of seed priming and unpriming under salt stress on seed morphological characteristics
2.6 盐胁迫下引发和未引发处理对棉种H2O2、MDA含量的影响
由图5-A可知,在种子萌发的过程中,引发处理对种子内部H2O2积累有明显的抑制作用。在萌发2、4、6 d时,不同浓度NaCl胁迫下,经过PEG-6000引发的棉花种子内部H2O2较未引发种子分别降低1.22%~32.34%、5.14%~29.57%、11.68%~27.14%,除在萌发2 d时50mmol·L-1NaCl浓度胁迫下差异不显著,其余各处理组间差异显著。由图5-B可知,不同浓度NaCl胁迫下,各萌发时期引发种子的MDA含量均显著低于未引发种子(除150 mmol·L-1NaCl浓度胁迫下萌发4 d时),在萌发2、4、6 d时,分别降低了8.00%~39.06%、0.26%~33.15%、7.92%~22.32%。
3 讨论
棉花作为一种“耐盐喜钠”作物,具有较强的耐盐性[26],而我国植棉区大多位于旱地、轻度盐碱地等贫瘠土地[27]。棉花对盐胁迫的忍耐能力在不同生育时期存在一定的差异,但以萌发期和苗期对盐分最为敏感[28]。本研究对棉花种子进行PEG引发处理后在不同浓度NaCl胁迫下进行萌发试验,通过衡量种子萌发指标,幼根形态发育情况,种子内部抗氧化酶活性及膜脂过氧化水平分析引发处理对盐胁迫下棉种萌发过程的影响。
3.1 PEG引发处理对盐胁迫下棉种萌发的影响
虽然棉花感受盐害的外部表现因胁迫的强度、时间的不同而异,但大多表现为种子吸胀困难,进而造成萌发缓慢和发芽率低的现象[29]。目前有大量研究认为盐胁迫对种子萌发有显著的抑制作用[30]。本研究证实了该观点,发现50~150 mmol·L-1NaCl胁迫对棉种萌发具有显著的抑制作用,且发芽势、发芽率均随NaCl浓度的升高而下降。
发芽势、发芽率、发芽指数、活力指数、平均发芽时间是评价种子发芽的常用指标,可以反映种子的发芽速度、整齐度和幼苗健壮的潜势[31]。但在自然贮藏条件下,棉种的发芽率、发芽势及种子活力易发生下降,导致棉籽利用价值降低[32]。有报道显示,成功进行引发的种子其抗性、活力、萌发率、出苗整齐率、成活率等均可得到有效改善[33]。
经筛选试验后,使用5%PEG-6000对棉种引发12 h后开展发芽试验,发现引发种子的发芽势、发芽率较未引发种子得到了显著的提升。为了衡量引发处理对种子耐盐性的影响,将引发后的种子在0、50、100、150 mmol·L-1NaCl胁迫下进行发芽试验,以未引发种子作为对照,发现除平均发芽时间外,其余可衡量种子萌发性能的指标均随着盐浓度的提高呈逐渐下降的趋势;使用PEG-6000引发后种子的发芽势、发芽率、发芽指数和活力指数均较对照显著提高,说明引发处理能够提升棉花种子的萌发特性。
有研究显示低浓度盐胁迫能够促进种子萌发,陈火英等[34]在番茄种子萌发的研究中发现低浓度盐胁迫处理的发芽率均高于对照;张利霞等[35]对夏枯草种子的研究也得到了相似结论,说明适当浓度的盐胁迫对棉花种子萌发具有促进作用,当盐胁迫浓度高于临界值时则会受到抑制。本研究在低浓度盐胁迫下未发现棉种发芽率的提升,但在萌发7 d时发现棉花幼根的下胚轴长及根长在50 mmol·L-1NaCl胁迫下会盐胁迫出现显著的增长,可能是由于低浓度盐胁迫对种子萌发的促进作用。
3.2 PEG引发处理对盐胁迫下幼根根系活力的影响
种子萌发是植物世代循环中最重要、最脆弱的阶段,也是多因素参与的复杂调控过程[36]。根系活力是作物耐盐性的重要参考指标之一,常用于衡量植物根系的吸收、合成能力[37]。还有报道显示根系活力同样是衡量植物根系抗逆能力的重要指标,可以反映植物的抗盐能力[38]。本研究结果同样印证了该结论,发现经过5%PEG-6000引发12 h后,萌发7 d后的根系活力发生了不同程度的提高。
3.3 PEG引发处理对盐胁迫下抗氧化酶活性的影响
植物在不利条件下生长会导致ROS过度积累进而引起脂质过氧化,损害细胞膜结构[39],而植物体内的保护酶系能有效清除膜脂过氧化过程中产生的氧自由基等有害物质,对增强抗逆性、维持植物体正常生长发育发挥着重要作用[40]。SOD可将组织中的O2-转化为H2O2和O2,再由POD将H2O2转化成H2O和O2,从而有效地降低自由基对植物体的伤害,因此在逆境条件下,SOD和POD等保护酶能否维持较高的活性对植物具有重要意义[41]。本研究发现种子内部的SOD活性随着盐浓度的不断升高呈下降趋势,说明盐胁迫会抑制种子内部的SOD活性,且随着胁迫浓度的增强,抑制效果愈加明显;而经过引发处理的种子在盐胁迫下的SOD活性较未引发处理出现了不同程度的增加。POD活性在不同浓度盐胁迫下的变化趋势与SOD类似,但是随着胁迫时间的推进POD活性呈现出明显的下降,且引发处理对POD活性的促进作用并没有SOD明显,说明相对于POD,SOD可能对PEG-6000引发处理更为敏感,这与杨振亚等[42]在干旱胁迫下毛竹种子萌发研究中的结果相似。
3.4 PEG引发处理对缓解盐胁迫下棉种膜脂过氧化水平的影响
随着胁迫强度的增加和胁迫时间的延长,膜脂过氧化会进一步加重,同时SOD和POD活性降低,致使H2O2过多积累而导致膜脂过氧化,从而破坏细胞膜的稳定性[43-44]。MDA是膜脂过氧化的主要副产物,通常被作为植物细胞膜损伤程度的指示物[45],H2O2含量能够反映NaCl胁迫对细胞膜结构完整性的破坏程度[46]。本研究结果发现,与未引发相比,引发后处于萌发各时期的棉种MDA与H2O2含量均发生了不同程度的降低,推测PEG引发处理可能是通过直接清除或抑制二者的合成途径来缓解膜脂过氧化水平,进而促进了棉种萌发,然而其降低膜脂过氧化水平的具体调控机理还需要进一步深入研究。
4 结论
本研究结果表明,在0~150 mmol·L-1NaCl胁迫下,使用5%PEG-6000对棉花种子进行引发处理可以提高发芽势和发芽率,缩短平均发芽时间,并使种子发芽指数与活力指数出现了不同幅度的增长;此外,引发处理对萌发7 d种子幼根的外部形态(下胚轴、根长)同样产生了促进作用。引发处理在种子生理特性的影响方面,除了对根系活力产生积极作用外,还增强了种子内部SOD和POD的活性,并通过减少H2O2和MDA的积累,缓解膜脂过氧化水平以增强棉花种子萌发过程中的耐盐性。然而,种子引发技术对盐胁迫条件下大田栽培棉花植株的生长发育、产量及品质的影响还有待于进一步研究。

