利什曼原虫感染树突状细胞早期基因表达差异分析及关键基因筛选①
余 鹏 宋咏刚 黄 卓 闵 海 黄江涛 张世超 陈 晋 胡祖权 王 赟 曾 柱
(贵州医科大学基础医学院,贵阳 550025)
利什曼病是虫媒介导的由利什曼原虫感染引起的人畜共患病,主要分为内脏利什曼病(又称黑热病)、皮肤利什曼病以及皮肤黏膜利什曼病,其中以内脏利什曼病最为严重,主要表现为长期不规则发热、脾脏肿大、贫血、消瘦、白细胞计数减少和血清球蛋白增加[1]。目前利什曼病的防治尚无有效措施,化疗是唯一的治疗方法,临床一线药物仅有以葡萄糖酸锑钠为主的少数几种,用药成本高,且具有较为严重的以细胞毒性为主的副作用,导致治疗效果不理想。多个疾病流行国家研究发现,原虫耐药性逐年提高是影响利什曼病治疗的潜在不利因素[2]。关于利什曼病发病机制及其治疗的研究中,研究人员尝试采用细胞因子、免疫调节剂作用于免疫系统,激活Th1细胞反应,进而触发免疫系统中各种免疫因子,发挥治疗作用[3]。免疫治疗有望成为治疗利什曼病的重要方法[4]。
树突状细胞(dendritic cells,DCs)是目前已知功能最为强大的抗原提呈细胞(antigen presenting cells,APCs),可向幼稚T细胞呈递抗原激活免疫系统,从而诱导免疫应答,是连接天然免疫应答与适应性免疫应答的桥梁[5]。DCs在机体抗感染、抗肿瘤等免疫反应中发挥重要作用,在寄生虫感染中的作用逐渐被重视。研究发现,利什曼原虫可抑制DCs成熟并改变CCR7表达,从而干扰其迁移,并抑制DCs抗原提呈,下调DCs表面分子CD40、CD86、HLA-DR表达[6-8]。DCs对利什曼原虫感染后机体免疫应答的产生发挥重要作用,DCs 的任何生物学行为信息都可能在临床上开发出新的治疗方法[9]。FAVILA等[10]研究发现,利什曼原虫感染DCs 4 h后,DCs基因表达谱明显变化,因此认为利什曼原虫感染DCs 4 h是DCs启动相应信号通路从而改变基因表达、启动针对利什曼原虫抗原提呈反应,进而影响机体免疫学功能的关键时期,早期DCs对病原体的识别捕获对其免疫功能发挥以及后续启动机体免疫应答具有重要意义。综上,本研究采用生物信息学技术方法分析利什曼原虫感染DCs早期相关差异表达基因(differentially expressed genes,DEGs),筛选关键基因,探索DCs在感染早期的应答、相关信号通路及其分子机制,为寻找利什曼原虫感染后基于DCs的免疫治疗方法提供新的思路。
1 材料与方法
1.1数据来源 通过美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)的GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)检索并下载GSE42088芯片数据,比较分析利什曼原虫感染DCs后4 h样本数据与未感染组数据。
1.2方法
1.2.1差异基因分析 采用RStudio软件对芯片原始数据进行标准化处理及归一化处理。通过limma Package筛选,以显著差异表达基因DEGs|log2FC|≥1且P<0.05为筛选标准进行统计学分析。
1.2.2蛋白质相互作用网络(protein-protein interaction network,PPI)构建 采用STRING在线工具构建DEGs PPI,Cytoscape的“MCODE”插件对PPI结果进行K-核解析(K-core decomposition,KO),以自带算法筛选出DEGs。
1.2.3GO及KEGG功能富集分析 对DEGs核心模块进行GO功能富集分析,采用RStudio软件的Cluster Profiler Package进行数据统计和可视化呈现,以P<0.05且基因数>2为筛选标准。
2 结果
2.1差异基因分析 RStudio软件对GSE42088芯片数据分析结果显示,利什曼原虫感染4 h前后DCs共有129个基因出现差异表达(|log2FC|≥1,P<0.05),见图1,其中上调基因49个,下调基因80个。按照|log2FC|大小分别从上调基因和下调基因中筛选变化倍数最大的10个基因,见表1、2。
2.2PPI及核心模块分析 PPI结果见图2。共分析出核心模块中17个关键节点基因(图3),其中RSAD2、IFI44L、IFI44、IFIT3、IFIT2、IFIT5、MX1、IRF7、CMPK2与IFN表达调控相关,且在利什曼原虫感染后表达上调(表3)。
2.3GO分析和KEGG富集分析 GO富集分析结果显示有23个富集结果(图4),多数涉及病毒感染过程的相关细胞反应,包括对病毒的响应(GO∶0009615)、对病毒的防御反应等细胞反应(GO∶0051607)以及Ⅰ-IFN相关免疫反应(GO∶0060337、0071357、0034340)。KEGG富集分析结果显示存在3个通路富集(图5),分别涉及甲型流感(hsa05164,图6)、麻疹(hsa05162,图7)及DNA复制(hsa03030)。

表1 利什曼原虫感染早期DCs部分DEGs(上调基因)

表2 利什曼原虫感染早期DCs部分DEGs(下调基因)

表3 核心模块分析与IFN相关基因表达情况
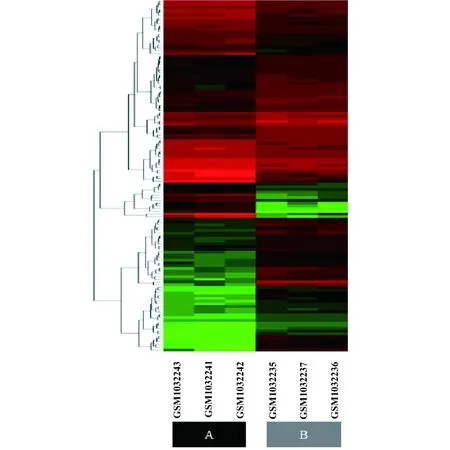
图1 差异基因分析聚类图Fig.1 Cluster diagram of differential gene analysisNote:A.Experiment group;B.Control.Red represents up-regulated expression;green represents down-regulated expression.

图2 差异表达蛋白PPI网络Fig.2 PPI networks of differentially expressed proteins

图3 核心模块分析Fig.3 Core module analysis
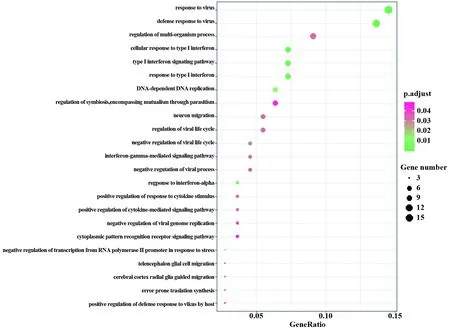
图4 DEGs GO富集分析Fig.4 GO enrichment analysis of DEGs
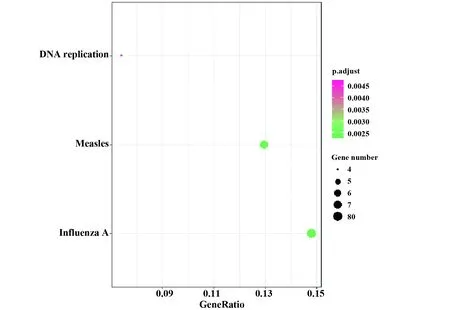
图5 DEGs KEGG富集分析Fig.5 KEGG enrichment analysis of DEGs

图6 KEGG富集分析-甲型流感Fig.6 KEGG enrichment analysis-Influenza A

图7 KEGG富集分析-麻疹Fig.7 KEGG enrichment analysis-Measles
3 讨论
WHO统计数据显示,利什曼病全球每年约有70万~100万新发病例,死亡人数达2.6万~6.5万,主要集中于非洲东部地区、南美洲及东地中海地区[11]。目前利什曼病治疗尚无特效药。利什曼病治疗药物主要杀伤利什曼原虫,如锑剂、米替福辛、巴龙霉素、两性霉素B等,但总体疗效并不理想[2,12-15]。随着研究的深入,免疫治疗有望成为攻克利什曼病的重要治疗方式。GUPTA等[16]研究发现,利什曼原虫感染机体后,会出现免疫逃逸行为,主要表现为通过阻止C5-C9膜攻击复合物形成阻断补体系统激活、改变TLR2/TLR4信号通路抑制细胞因子级联反应、防止巨噬细胞内吞小体与溶酶体的融合、降低B7和CD40表达从而抑制T细胞抗寄生虫效应、抑制JAK/STAT通路抑制巨噬细胞细胞因子激活信号激活以及改变细胞因子和趋化因子表达水平等。SCOTT等[3]发现,机体Th1/Th2平衡是利什曼病患者治疗及预后的重要指标,通过细胞因子调节其平衡于利什曼病治疗可能具有积极作用,且DCs在维持利什曼原虫感染后机体Th1/Th2平衡中发挥重要作用[17]。通过改善感染后体内相应细胞因子水平、阻断不利的信号途径以及化疗与免疫治疗联用等方式治疗利什曼病已取得一定进展[18-19]。DCs作为目前已知体内功能最为强大的APCs,在抗细菌、抗病毒、抗寄生虫感染机体的早期及抗感染免疫反应的整个过程中发挥重要作用。因此,阐明病原体感染过程对DCs生物学行为的影响有利于理解其免疫学过程发生发展,为基础及临床研究发掘出新的更有针对性的免疫疗法提供参考。
本研究采用生物信息学技术方法筛选出利什曼原虫感染DCs早期的差异基因,以期为准确理解该免疫学过程、寻找相关靶点、寻找利什曼原虫感染的免疫治疗方法提供思路。结果表明,感染前后共有129个基因出现差异表达(|log2FC|≥1,P<0.05),其中上调基因49个,下调基因80个,进一步筛选出变化最为显著的10个上调基因(IL12B、CXCL10、RSAD2、CSRP2、IFIT2、CMPK2、GALNT3、IFIT3、IFI44L、MX1)和10个下调基因(EGR3、NR4A2、EGR1、SNORD3、DEPTOR、MEF2C、LRRC25、DDIAS、CDCA7L、NUDT7),其中IL12B、CXCL10差异最为显著。IL12B是编码IL12的亚单位,IL12主要由受抗原刺激的炎症细胞(如DCs)产生,可作用于T细胞和NK细胞,具有广泛的生物学活性,细菌、寄生虫、真菌等病原体均是强有力的刺激因素。IL12诱导Th1细胞免疫应答,促进Th1类细胞因子如IFN-γ产生,又可抑制Th2类因子如IL-4、IL-13产生,从而抑制Th2细胞免疫应答,引发机体抗寄生虫感染的免疫反应[20]。利什曼原虫感染可刺激DCs产生IL12,且IL12可使机体免疫系统启动Th1细胞介导的免疫反应[21-24]。由此猜测IL12B在利什曼原虫感染DCs后IL12的产生过程中发挥重要作用,可能是潜在的治疗靶点。CXCL10参与多种疾病的免疫调控过程,如肿瘤、自身免疫性疾病、感染性疾病等,主要参与T细胞趋化迁移,当DCs受到抗原刺激后分泌CXCL10,从而趋化效应T细胞向炎症部位迁移,进而发挥免疫学效应[25-27]。在寄生虫感染过程中,CXCL10对于维持T细胞免疫学功能具有重要作用[28]。CXCL10可降低宿主肝脏及脾脏的利什曼原虫负载,抑制局部脏器感染加重,对感染宿主具有部分保护作用,但具体机制尚未明确[29-30]。最新研究发现,包括利什曼原虫在内的多种病原体感染机体后可抑制CXCL10表达,引发免疫逃逸或免疫抑制反应,进而导致病原体与宿主免疫系统相互作用削弱以提高病原体存活率[31]。因此认为对抗CXCL10的抑制作用可能是针对病原体感染新的治疗策略,值得进一步研究。
通过对筛选出的上下调DEGs进行PPI网络构建,并筛选核心模块,共分析出17个关键基因,其中RSAD2、IFI44L、IFI44、IFIT3、IFIT2、IFIT5、MX1、IRF7、CMPK2与IFN调控相关,且表达均上调。GO分析结果显示DEGs涉及的生物学过程主要包括对病毒的防御反应(GO∶0051607)、对病毒的响应(GO∶0009615)、Ⅰ-IFN信号通路(GO∶0060337)、细胞对Ⅰ-IFN的反应(GO∶0071357)、对Ⅰ-IFN的反应(GO∶0034340),说明利什曼原虫感染DCs可引起强烈的免疫学效应,猜测利什曼原虫感染可能呈现类似病毒感染的现象,抗病毒疗法尤其是Ⅰ-IFN可能对利什曼原虫感染有一定治疗效果。IFN可分为3类:Ⅰ型、Ⅱ型、Ⅲ型,具有抗肿瘤、抗病毒等作用。既往研究认为Ⅱ型IFN主要参与抗寄生虫感染,但随着研究的深入,发现Ⅰ-IFN在机体抗锥虫、疟原虫、弓形虫、利什曼原虫等原虫感染中也发挥重要作用[32-35]。机体在利什曼原虫感染过程中,可激活Ⅰ-IFN信号通路,且通过刺激DCs促进IFN-α和IFN-β表达[36-37]。利什曼原虫感染后刺激DCs产生IL-12,该过程受Ⅰ-IFN信号通路调控[10]。动物实验发现,给予感染利什曼原虫的BALB/c小鼠低剂量IFN-β可使小鼠NK细胞活力得到一定恢复,并促进淋巴细胞增殖及IL-12产生[38]。综上,猜测Ⅰ-IFN及Ⅰ-IFN信号通路介导的DCs IL12产生在抗利什曼原虫感染过程中发挥重要作用。
KEGG分析富集到甲型流感通路(hsa05164)、麻疹感染通路(hsa05162)、DNA复制信号通路(hsa03030),甲型流感通路及麻疹感染通路均与IL12密切相关,且2条通路均涉及TLR4/NF-κB调控。Toll样受体(toll-like receptors,TLR)是单个跨膜非催化性蛋白质,属于跨膜模式识别受体,参与机体非特异性免疫,是连接非特异性免疫和特异性免疫的桥梁,可识别病原体相关分子等外源性配体,激活机体免疫应答,广泛存在于髓源性细胞、DCs、单核细胞等免疫细胞细胞膜与细胞器膜表面[39]。目前发现的13个TLR中,有9个与寄生虫感染相关,分别为TLR1、TLR2、TLR3、TLR4、TLR6、TLR7、TLR9、TLR11和TLR12[40]。TLR信号通路涉及多种信号分子,包括MyD88、TRAF6 MAPKs、NF-κB、IRFs等[41]。针对利什曼原虫感染,WHITAKER等[42]研究发现,可通过表面P8蛋白集落复合体激活免疫细胞膜表面TLR4,进而产生炎症细胞因子和趋化因子。此外,TLR4还可通过识别利什曼原虫的脂磷聚糖激活NF-κB,诱导TNF-α和趋化因子表达[43-44]。利什曼原虫感染机体后,刺激DCs产生IL12也受NF-κB调控[21]。研究发现利什曼原虫的糖基磷脂酰肌醇可激活TLR4,从而诱导IFN-α/β分泌,增强一氧化氮合酶表达并合成NO杀伤利什曼原虫[45]。由此猜测,利什曼原虫感染DCs可能通过甲型流感、麻疹通路影响TLR4表达,进而影响IL-12表达,且TLR4变化可能影响Ⅰ-IFN分泌。
本文采用生物信息学技术分析利什曼原虫感染DCs的早期分子机制,以期为基础和临床研究提供新的思路。本研究结果提示利什曼原虫感染早期差异表达最为显著的基因为IL12B与CXCL10,IL12B的差异表达可影响IL12分泌,而CXCL10有望成为新的治疗靶点。GO分析和KEGG分析结果显示,IL12分泌受Ⅰ-IFN信号通路和TLR4/NF-κB信号通路影响,2条通路协同作用,由此猜测Ⅰ-IFN/IL12信号通路与TLR4/NF-κB/IL12信号通路可能成为利什曼原虫感染治疗的靶点。另一方面利什曼原虫感染DCs后,根据富集分析结果猜测可能会出现类似病毒感染的现象,结合既往研究推测抗病毒免疫疗法可能对利什曼原虫感染具有一定疗效。

