长链非编码RNA牛磺酸上调基因1通过激活TGF-β1/Smad信号通路发挥促大鼠肝纤维化的作用①
赵 刚 徐贵颖
(吉林大学公共卫生学院,国家卫生健康委员会放射生物学重点实验室,长春 130021)
肝纤维化属于可逆性病变,是进一步发展为肝硬化的关键环节,也是慢性肝病共同的病理特征。肝纤维化的特征为细胞外基质(尤其是胶原)在肝脏内的大量沉积。肝星状细胞的活化在肝纤维化的发生过程中发挥关键作用,活化的肝星状细胞可分泌α-SMA、collagenⅠ、TIMP-1等[1,2]。长链非编码RNA(long non-coding RNA,lncRNA)是近年来RNA领域的研究热点之一,其可通过多种机制调控基因表达,牛磺酸上调基因(taurine up-regulated gene 1,TUG1)是lncRNA的重要成员之一,是缺氧引起的肺纤维化调节因子,也是心肌成纤维细胞-肌成纤维细胞转化的重要调节因子,但其在肝纤维化中的作用尚不清楚[3,4]。本文对肝纤维化组织和活化肝星状细胞中TUG1的表达情况及其在肝纤维化中的可能作用机制进行研究,以期为临床治疗提供依据。
1 材料与方法
1.1材料
1.1.1实验动物 健康清洁级SD大鼠75只,雄性,体质量160~190 g,购自上海斯莱克实验动物有限公司,动物许可证号:SCXK(沪)2008-0016。
1.1.2主要试剂与仪器 肝星状细胞株HSC-T6(复旦IBS细胞资源中心);兔抗α-SMA单克隆抗体、兔抗collagenⅠ单克隆抗体、兔抗MMP-2单克隆抗体,兔抗TIMP-1单克隆抗体、兔抗Smad2单克隆抗体、兔抗Smad3单克隆抗体、HRP标记的山羊抗兔抗体、β-actin单克隆抗体(美国Epitmics公司);BCA试剂盒、RT-PCR试剂盒、TRIzol试剂盒(美国Tocris公司);TUG1 siRNA和阴性对照siRNA(广州锐博生物科技有限公司);转染试剂LipofectamineTM2000(美国Invitrogen公司);胎牛血清、DMEM培养基(美国Gibco公司);α-SMA、TUG1、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3和GAPDH引物(英潍捷基公司,引物序列见表1)。

表1 PCR引物序列Tab.1 PCR primer sequences
1.2方法
1.2.1大鼠肝纤维化模型的制备 将75只大鼠分为对照组和肝纤维化组,对照组15只,肝纤维化组60只,肝纤维化组大鼠腹腔注射1%DMN[1 ml/(kg·d)],每星期连续用药3 d,共4周;对照组大鼠腹腔注射等量生理盐水,方法同肝纤维化组大鼠,共4周。建模结束后,肝纤维化组大鼠存活59只,死亡1只,对照组大鼠无死亡,取肝纤维化组大鼠14只和对照组大鼠肝脏组织进行HE染色,测定肝组织中α-SMA、TUG1 mRNA水平。
1.2.2大鼠体内转染TUG1 siRNA 将剩余的45只肝纤维化模型大鼠根据随机数字法分为空白对照组、阴性对照组、siRNA干扰组,15只/组。siRNA干扰组大鼠在建立模型的同时给予尾静脉注射100 μg TUG1 siRNA,1次/周,阴性对照组大鼠在建立模型的同时给予尾静脉注射阴性对照siRNA,1次/周,空白对照组大鼠建模时尾静脉注射等量生理盐水,1次/周,共4周。4周后空白对照组大鼠无死亡,阴性对照组和siRNA干扰组大鼠各死亡1只。处死各组大鼠取肝脏组织进行肝组织TUG1、α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3水平测定。
1.2.3大鼠肝脏HE染色 大鼠的肝脏组织标本经福尔马林固定、石蜡包埋后切成4 μm切片,进行常规HE染色。
1.2.4肝星状细胞活化 取对数生长的肝星状细胞HSC-T6细胞(5×105个/孔)接种于6孔板,加入含5 ng/ml TGF-β1的培养液培养活化肝星状细胞,并设立对照组,对照组加入不含TGF-β1的等体积培养液,每组设7个复孔。培养24 h后,取部分活化肝星状细胞作为活化肝星状细胞组,测定活化肝星状细胞组和对照组细胞中α-SMA和TUG1 mRNA水平。
1.2.5活化肝星状细胞转染TUG1 siRNA 将上述剩余部分的活化的HSC-T6细胞分为空白对照组、阴性对照组和siRNA干扰组,每组设7个复孔,在活化HSC-T6细胞的同时,siRNA干扰组细胞中加入1.25 μl TUG1 siRNA(20 μmol/L),阴性对照组细胞加入等量siRNA阴性对照,空白对照组不转染,培养6 h后移去含siRNA培养基,更换新鲜培养基培养48 h,收集细胞用于细胞中TUG1、α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3水平测定。
1.2.6RT-PCR法检测大鼠肝组织和肝星状细胞中α-SMA、TUG1、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 mRNA水平 TRIzol试剂盒提取各组大鼠肝脏组织和肝星状细胞总RNA,检测肝脏组织和肝星状细胞RNA纯度,RT-PCR法测定大鼠肝组织和肝星状细胞中α-SMA、TUG1、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 mRNA水平。以GAPDH为内参照,PCR反应条件为95℃ 30 s;95℃ 5 s,60℃ 30 s,共40个循环。α-SMA、TUG1、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 mRNA的相对表达量以2-ΔΔCt表示。
1.2.7Western blot法检测大鼠肝组织和肝星状细胞α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 蛋白水平 取各大鼠匀浆肝脏组织和肝星状细胞,加入细胞裂解液裂解30 min提取肝脏组织和肝星状细胞总蛋白,BCA法测定肝脏组织和肝星状细胞蛋白浓度,Western blot测定肝组织和肝星状细胞α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 蛋白水平,β-actin单克隆抗体为内参照,目标蛋白的相对表达量=目标蛋白条带灰度值/β-actin条带灰度值。

2 结果
2.1两组大鼠肝脏HE染色 对照组大鼠肝脏组织未见明显异常,肝纤维化组大鼠肝脏组织见肝小叶结构破坏,小叶间汇管区有大量纤维增生,形成假小叶。见图1。
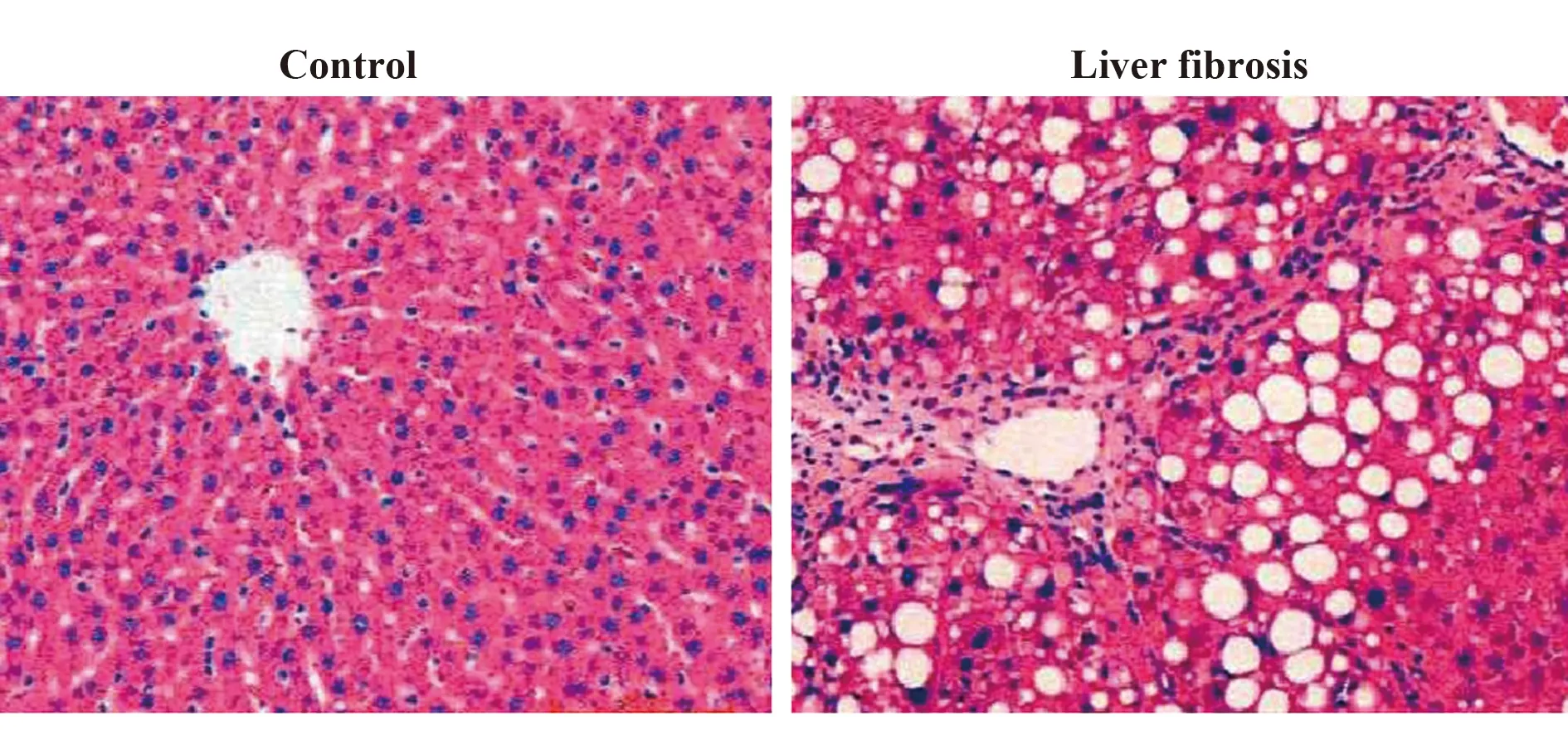
图1 两组大鼠肝组织HE染色(×200)Fig.1 HE staining of liver tissue of two groups of rats (×200)
2.2两组大鼠肝组织中α-SMA和TUG1 mRNA水平 与对照组相比,肝纤维化组大鼠肝组织中α-SMA和TUG1 mRNA水平升高(P<0.05,图2)。

图2 肺组织中α-SMA和TUG1 mRNA相对表达水平Fig.2 Relative expressions of α-SMA and TUG1 mRNA levels in liver tissuesNote:**.P<0.01 vs Control group.
2.3两组肝星状细胞中α-SMA和TUG1 mRNA水平 与对照组相比,活化肝星状细胞组肝星状细胞中α-SMA和TUG1 mRNA水平升高(P<0.05,图3)。
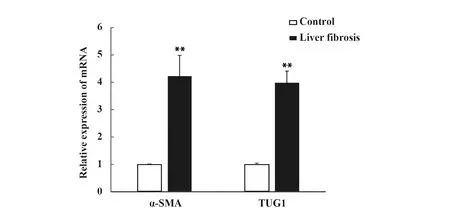
图3 活化肝星状细胞中α-SMA和TUG1 mRNA相对表达水平Fig.3 Relative expressions of α-SMA and TUG1 mRNA levels in activated hepatic stellate cellsNote:**.P<0.01 vs Control group.
2.4沉默TUG1对肝纤维化大鼠肝组织TUG1、α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 mRNA表达水平的影响 与空白对照组和阴性对照组相比,siRNA干扰组大鼠肝组织TUG1、α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 mRNA水平均降低(P<0.01),空白对照组和阴性对照组大鼠肝组织各指标mRNA水平差异无统计学意义(P>0.05)。见图4。

图4 3组大鼠肿组织中 TUG1、α-SMA、collagenⅠ,MMP-2,TIMP-1,Smad2及Smad3 mRNA水平Fig.4 mRNA levels of TUG1,α-SMA,collagenⅠ,MMP-2,TIMP-1,Smad2 and Smad3 of rat liver tissues in three groupsNote:**.P<0.01 vs Blank control group;##.P<0.01 vs Negative control group.
2.5沉默TUG1对肝纤维化大鼠肝组织α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3蛋白表达水平的影响 与空白对照组和阴性对照组相比,siRNA干扰组大鼠肝组织α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3蛋白水平均降低(P<0.01),空白对照组和阴性对照组大鼠肝组织各指标蛋白水平差异无统计学意义(P>0.05)。见图5。

图5 3组大鼠肝组织中 TUG1、α-SMA、collagenⅠ,MMP-2,TIMP-1,Smad2及Smad3 mRNA蛋白水平Fig.5 Protein levels of α-SMA,collagenⅠ,MMP-2,TIMP-1,Smad2,and Smad3 mRNA in liver tissues of three groups of ratsNote:1.Blank control group;2.Negative control group;3.mRNA interference group.**.P<0.01 vs Blank control group;##.P<0.01 vs Negative control group.
2.6沉默TUG1对活化肝星状细胞中TUG1、α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 mRNA表达水平影响 与空白对照组和阴性对照组相比,siRNA干扰组活化肝星状细胞TUG1、α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3 mRNA水平均降低(P<0.01),空白对照组和阴性对照组活化肝星状细胞各指标mRNA水平差异无统计学意义(P>0.05)。见图6。

图6 3组活化肝星状细胞中TUG1、α-SMA、collagenⅠ,MMP-2,TIMP-1,Smad2及Smad3 mRNA水平Fig.6 TUG1,α-SMA,collagenⅠ,MMP-2,TIMP-1,Smad2,Smad3 mRNA levels of activated hepatic stellate cells in three groupsNote:**.P<0.01 vs Blank control group;##.P<0.01 vs Negative control group.
2.7沉默TUG1对活化肝星状细胞α-SMA、colla-genⅠ、MMP-2、TIMP-1、Smad2、Smad3 蛋白表达水平影响 与空白对照组和阴性对照组相比,siRNA干扰组活化肝星状细胞α-SMA、collagenⅠ、MMP-2、TIMP-1、Smad2、Smad3蛋白水平均降低(P<0.01),空白对照组和阴性对照组活化肝星状细胞各指标蛋白水平差异无统计学意义(P>0.05)。见图7。
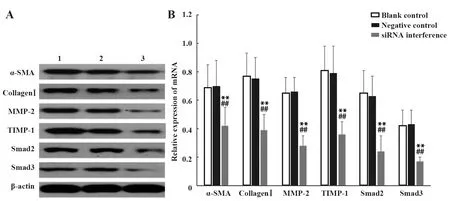
图7 3组活化肝星状细胞中TUG1、α-SMA、collagenⅠ,MMP-2,TIMP-1,Smad2及Smad3蛋白水平Fig.7 Levels of α-SMA,collagen I,MMP-2,TIMP-1,Smad2,and Smad3 proteins of activated hepatic stellate cells in three groupsNote:1.Blank control group;2.Negative control group;3.mRNA interference group.**.P<0.01 vs Blank control group;##.P<0.01 vs Negative control group.
3 讨论
lncRNA长度大于200 nt,可以和miRNA相互作用发挥生物学功能,如lncRNA可作为增强子RNA和前体miRNA结合调节转录[5];可通过调节抑癌基因影响抑癌信号通路;为染色质修饰复合物提供支架;充当miRNA调节基因表达;与相应的mRNA剪接前体形成双链RNA,并被剪切酶切割形成小干扰RNA调节基因表达;和其他lncRNA之间相互作用调节基因表达等,在肝纤维化中发挥重要作用[6,7]。TUG1为lncRNA的一种,具有多种生物学特性,在恶性肿瘤的发生发展中具有重要作用,高表达于多种恶性肿瘤,与恶性肿瘤细胞的增殖、侵袭和迁移关系密切[8-11];TUG1在组织纤维化中也发挥重要作用,为肺部纤维化的调节因子之一,在心脏纤维化中也具有重要作用[12]。Zhu等[4]研究发现TUG1和心肌纤维化程度呈正相关,敲低TUG1可改善缺氧诱导的心肌纤维化。但TUG1在肺纤维化中的表达尚不明确,本研究发现在大鼠肝纤维化组织中及活化的肝星状细胞中TUG1水平升高,提示TUG1可能参与肝纤维化的发生发展。
肝纤维化发生的关键为肝星状细胞的活化,肝星状细胞的活化也是肝纤维化时细胞外机制的主要来源细胞,正常情况下,肝星状细胞合成一定量的细胞外基质(以胶原Ⅲ和胶原Ⅳ为主),当肝脏受到刺激时,肝星状细胞被激活,转变为肌成纤维细胞,表达α-SMA,合成大量胶原等细胞外基质,导致肝脏内细胞外基质增多,以collagenⅣ为主的基底膜改变为以collagenⅠ和collagenⅢ胶原为主的基底膜,并进一步激活肝星状细胞,启动肝纤维化,肝星状细胞分泌α-SMA为肝星状细胞激活的标志[7,13];MMP-2在正常肝组织中鲜有表达,主要由肝星状细胞活化产生,在肝纤维化过程中MMP-2水平升高[14];TIMP-1可以特异性抑制间质胶原酶、基质降解酶等,在降解细胞外基质主要成分collagenⅠ中发挥关键作用[15]。肝星状细胞活化后分泌α-SMA、collagenⅠ、MMP-2、TIMP-1是肝纤维化进展的关键步骤[16]。本研究沉默TUG1后,肝纤维化组织及活化肝星状细胞中TUG1、α-SMA、collagenⅠ、MMP-2、TIMP-1水平均降低,提示降低TUG1水平可逆转肝星状细胞活化,抑制肝纤维化。
活化的肝星状细胞受多种细胞因子调节,TGF-β1是最有效的促肝纤维化的细胞因子,其可通过多种途径调节细胞外基质的基因表达,Smad蛋白依赖途径是最经典的途径,Smad2和Smad3是细胞内TGF-β1/Smad信号通路的下游信号蛋白,在TGF-β1/Smad信号通路中发挥重要作用,可间接反映TGF-β1/Smad信号通路的激活情况,在肝纤维化过程中,TGF-β1/Smad信号通路被激活,从而促进肝纤维化的发展[17-19]。本研究沉默TUG1后,肝纤维化组织及活化肝星状细胞中Smad2和Smad3水平下降,提示沉默TUG1可通过抑制TGF-β1/Smad信号通路的激活在抗肝纤维化中发挥作用。
综上所述,肝纤维化时肝组织中TUG1水平升高,下调TUG1水平可通过逆转肝星状细胞活化抑制肝纤维化,其机制为沉默TUG1后,抑制了TGF-β1/Smad信号通路的激活,从而发挥抗肝纤维化作用。TUG1有望成为肝纤维化的治疗靶点之一。

