Nesfatin-1在雌性大鼠生殖轴上的表达及对其初情期的影响
康铁柱,王尧尧,李海玲,叶菁,李福宝,方富贵
(安徽农业大学动物科技学院/安徽省动物遗传资源保护与育种实验室,安徽 合肥 230036)
Nesfatin-1是一种下丘脑摄食抑制肽,由其前体核组蛋白2(nucleobindin 2,Nucb2)加工而成[1],主要由脑部核团及胃X/A样细胞、胰岛β细胞分泌,相对分子质量9.7×103,可在下丘脑透过血脑屏障后进入脑脊液,进入血循环发挥作用[2],并广泛表达于哺乳动物中枢神经系统和胃黏膜、胰腺以及睾丸等外周组织[3-4]。Nesfatin-1此前一直被认为在下丘脑参与控制食物摄入、体重和能量平衡[5],可以通过刺激室旁核(paraventricular nucleus,PVN)释放催产素,还参与控制食欲下降[6],起着厌食作用,并且可以促进葡萄糖代谢和胰岛素释放[7]。脑室注射Nucb2重组蛋白可以抑制大鼠夜间摄食量和体重的增加,而注射 Nucb2抗体亦可显著增加体重和摄食量[8]。在胰腺中,Nesfatin-1广泛参与胰岛素和胰高血糖素介导的葡萄糖代谢[9]。以上研究表明Nesfatin-1在能量平衡和神经内分泌相关功能以及编辑下丘脑的厌食信号方面具有负调节作用。能量平衡、代谢效率与初情期启动及生殖活动密切相关,初情期开始和发育进程中对能量的储备很敏感[10],这也提示了Nesfatin-1在生殖进程中可能发挥作用。在金鱼体内,Nesfatin-1可以与促性腺激素共表达,参与下丘脑-垂体-性腺轴(hypothalamus-pituitary-gonad axis,HPG)的调节[11];在奶牛的胎儿生长、能量储存中,Nesfatin-1也起到积极作用[12]。
目前对Nesfatin-1的研究和报道较多,但是均缺乏对Nesfatin-1从生殖轴的表达到初情期调控的系统研究。因此,本研究以雌性大鼠为试验动物,旨在探讨以下3个问题:1)Nesfatin-1在下丘脑-垂体-卵巢轴(HPOA)中是如何分布的;2)Nesfatin-1在雌性大鼠的不同发育阶段是如何表达的;3)Nesfatin-1是否影响雌性大鼠初情期。本研究结果将有助于我们进一步探明Nesfatin-1调控初情期启动的机制。
1 材料与方法
1.1 试验材料
1.1.1 试验动物从安徽医科大学实验动物中心购买200~220 g清洁级Sprague-Dawley(SD)大鼠30只,饲养在室温、12 h/12 h的明/暗循环(08:00—20:00开灯)的环境中,自由摄食与饮水,自由繁殖后取其子代进行后续试验。
1.1.2 主要试剂Nesfatin-1/Nucb2抗体购买于R&D System公司;重组 Nesfatin-1蛋白购买于PL Laboratories公司,临用前配制0.1 mg·mL-1Nesfatin-1 溶液;RNA 提取试剂 Trizol、DEPC购于美国Sigma 公司;实时荧光定量PCR(RT-qPCR)的反转录试剂盒、qPCR试剂盒和基因引物均购自上海闪晶分子生物科技公司;大鼠雌二醇(Estradiol,E2)ELISA检测试剂盒(CK-E30581R)购自上海傲集生物科技有限公司。
1.1.3 试验仪器半自动切片机(LS-2055+,沈阳龙首电子仪器有限公司);光学显微镜(YS2-H,日本 Nikon 公司);电子分析天平(JA2003,上海浦春计量仪器有限公司);超净工作台(SW-CJ-ID,苏州净化设备有限公司);多用电泳仪(DYY-6C,北京六一仪器厂);荧光定量 PCR仪(Rotor-Gene 6000,Corbett Life Science,Australia);数显脑立体定位仪(ZS-B-C,北京众实迪创科技发展有限责任公司);离心机(W3021HR,安徽嘉文仪器装备有限公司);全自动酶标仪(G5033A,南京华东电子集团医疗装备公司)。
1.2 试验设计
Nesfatin-1在生殖轴定位试验:选用6只体重为200~220 g成年雌性大鼠(80 日龄左右,未交配)进行生殖轴定位试验;Nesfatin-1mRNA在生殖轴上的转录水平试验:分别选取不同发育阶段幼年期(10 日龄)、初情期前(25 日龄)、初情期(阴门开启为标志,约40 日龄)、成年期(80 日龄,未交配)的雌性大鼠各6只,进行检测。其中成年雌性大鼠取样标准为建立2个连续的常规4 d发情周期[13]。大鼠侧脑室注射试验:选用24只初情期前(25 日龄)的雌性大鼠,随机均分为试验组和对照组,试验组侧脑室注射5 μL的50 pmol·μL-1Nesfatin-1溶液,对照组注射等体积生理盐水。侧脑室注射前先对25 日龄大鼠腹腔注射 50 mL·kg-1戊巴比妥钠注射液(10 mg·mL-1)进行麻醉,待其完全失去意识后对头顶部皮肤刮毛,75%乙醇消毒皮肤。注射部位及方法参照García-Galiana等[8]的报道。统计每只大鼠阴门开启日龄并采集下丘脑、垂体和卵巢,称量单侧卵巢后迅速置于液氮后于-80 ℃保存。采集血液,离心后取血清,于-20 ℃保存。
1.3 免疫组化定位试验
大鼠经腹腔麻醉后,经左心室插针管灌注200 mL的4%(体积分数)多聚甲醛固定30 min,迅速分离下丘脑、垂体、卵巢等组织,放入 4%多聚甲醛溶液中固定,72 h后进行常规石蜡包埋、切片(5 μm),切片经烘烤脱蜡后,用枸橼酸盐缓冲液(pH6.0)修复抗原并滴加 3%(体积分数)H2O2灭活内源酶。5 mg·mL-1BSA室温封闭1 h,在切片上滴加一抗 Nesfatin-1(1∶150稀释)后置于 4 ℃冰箱内孵育过夜。滴加二抗 2-辣根酶标记抗山羊 IgG 多聚体(poly-HRP anti-goat IgG)37 ℃孵育 30 min后,PBS洗3次(每次5 min)。避光条件下用3,3-二氨基联苯胺(diaminobenzidine,DAB)显色 5~20 s,终止反应并冲洗后用苏木素染色,中性树胶封片[14]。在光学显微镜下观察并拍照。Nesfatin-1/Nucb2免疫反应阳性物质呈深浅不一的棕黄色,阴性对照用PBS代替一抗,阴性对照呈蓝色,均无阳性物质的表达。
1.4 组织总RNA的提取
按照 Trizol 常规方法提取组织总RNA,将琼脂糖凝胶电泳检测到的高质量RNA用超微量分光光度计检测其浓度和纯度(D260/D280值为1.8~2.0),然后依据逆转录试剂盒操作说明,按20 μL反应体系进行逆转录(RT)合成cDNA第1条链,产物于-20 ℃冰箱保存待用。根据GenBank数据库的序列,使用Primer Premier 5.0和AlleleID 6.0软件设计引物,由上海闪晶分子生物科技公司合成并验证后使用。引物序列见表1。

表1 本试验RT-qPCR所用引物信息Table 1 RT-qPCR primers information in this study
1.5 组织中基因表达水平的RT-qPCR试验
反应体系:2 μL cDNA、2 μL Primers、25 μL Buffer 和 0.5 μL SybrgreenⅠ加DEPC水至终体积为 50 μL。qPCR条件:94 ℃ 4 min;94 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s,35个循环。内参选用β-actin基因。扩增各基因时,每个样本重复3次。用 2-ΔΔCT法计算样本中各基因的相对表达量。
1.6 血清中E2浓度的ELISA试验
采集大鼠血液于4 ℃冰箱静置4 h,在4 ℃条件下3 000 r·min-1离心15 min,取上清液。按照E2试剂盒说明书操作后,用全自动酶标仪测定每孔D450值。E2最低检测浓度小于1.0 pg·mL-1,试剂盒批内变异系数小于10%,批间变异系数小于15%。
1.7 数据的统计分析
2 结果与分析
2.1 Nesfatin-1在雌性大鼠生殖轴上的定位
在成年雌性大鼠下丘脑中,Nesfatin-1蛋白在弓状核(ARC)、室旁核(PVN)、视上核(SON)及下丘脑外侧区(LHA)等核团均出现免疫阳性神经元分布(图1-A);在垂体中,Nesfatin-1蛋白主要分布在细胞的胞质中,腺垂体胞体呈圆形、卵圆形、多角形等(图1-B);在卵巢的卵母细胞、间质细胞、黄体细胞及颗粒细胞中均有表达(图1-C)。神经元胞体呈棕色的反应颗粒位于胞质内,不同组织的阴性对照组均无目的蛋白着色(图1-A8、B4、C4)。
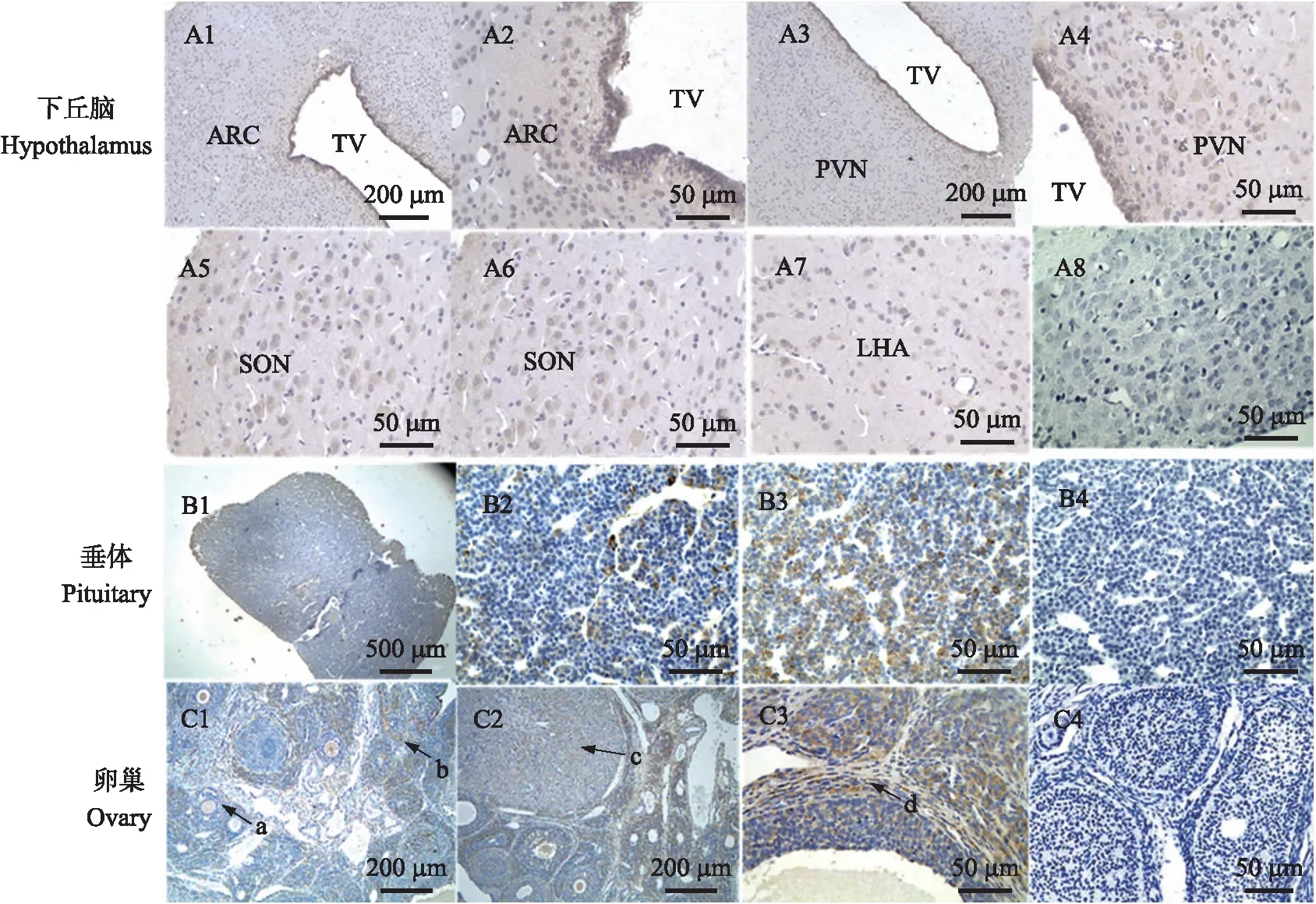
图1 Nesfatin-1 在成年雌性大鼠生殖轴上的定位Fig.1 Localization of Nesfatin-1 on reproductive axis in adult female ratsA1、A2. 弓状核Arcuate nucleus(ARC);A3、A4. 室旁核Paraventricular nucleus(PVN);A5、A6. 视上核Supraoptic nucleus(SON);A7. 下丘脑外侧区Lateral hypothalamic area(LHA);B1、B2、B3. 腺垂体Anterior pituitary;C1、C2、C3. 卵巢Ovary;A8、B4、C4. 阴性对照Negative control.ARC:弓状核 Arcuate nucleus;TV:第3脑室 Third ventricle;PVN:室旁核 Paraventricular nucleus;SON:视上核Supraoptic nucleus;LHA:下丘脑外侧区 Lateral hypothalamic area. a. 卵母细胞Oocytes;b. 间质细胞Interstitial cells;c. 黄体细胞Corpus luteum;d. 颗粒细胞Granulosa cells.
2.2 Nucb2、Tac2、Gnrh mRNA在大鼠不同发育阶段下丘脑中的表达
Nucb2、Tac2、GnrhmRNA在雌性大鼠幼年期(10日龄)、初情期前(25 日龄)、初情期(阴门开启)和成年期的下丘脑均有表达。Nucb2、Tac2和GnrhmRNA表达水平均呈先上升后下降趋势,且在初情期前达到最高(P<0.05)(图2)。对Nucb2与Tac2mRNA表达进行相关性分析,发现两者变化趋势大体一致,且呈极显著正相关(r=0.940,P<0.001)。
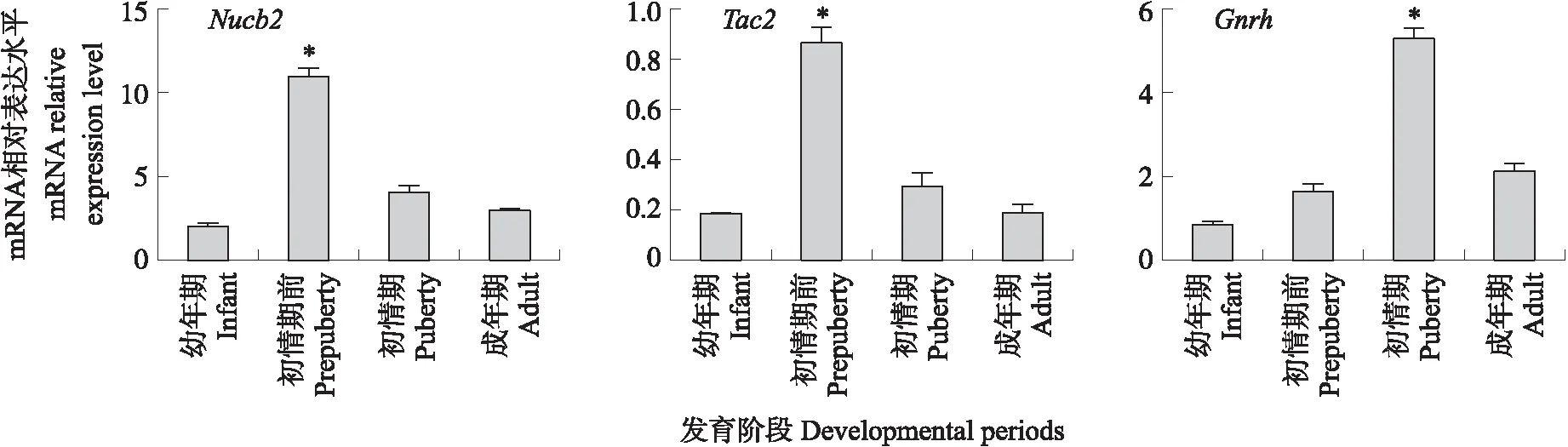
图2 Nucb2、Tac2、Gnrh mRNA在不同发育时期雌性大鼠下丘脑中的表达量Fig.2 The expression levels of Nucb2,Tac2,Gnrh mRNA in hypothalamus of female rats during different development periods*P<0.05. The same below.
2.3 Nesfatin-1对雌性大鼠初情期的影响
2.3.1 侧脑室注射Nesfatin-1对大鼠阴门开启时间、卵巢重及E2浓度的影响25日龄雌性大鼠侧脑室注射Nesfatin-1后阴门平均开启时间比对照组大鼠提前10 d 左右,初情期启动显著提前(P<0.05)。阴门开启时卵巢重比对照组显著增加(P<0.05),血清中E2浓度显著上调(P<0.05)。
2.3.2 侧脑室注射Nesfatin-1对大鼠生殖轴上生殖相关基因的影响对初情期前(25日龄)的雌性大鼠侧脑室注射Nesfatin-1蛋白,到达初情期时下丘脑中Gnrh和ERα,垂体中GnrhR、LHβ和FSHβ以及卵巢中LHRmRNA相对表达水平显著增加(P<0.05),但卵巢中FSHRmRNA相对表达水平差异不显著(P>0.05)。
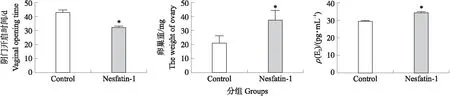
图3 Nesfatin-1对雌性大鼠阴门开启时间、单侧卵巢重和E2浓度的影响Fig.3 Effects of Nesfatin-1 on vaginal opening time,unilateral ovarian weight and the concentration of E2 in female rats
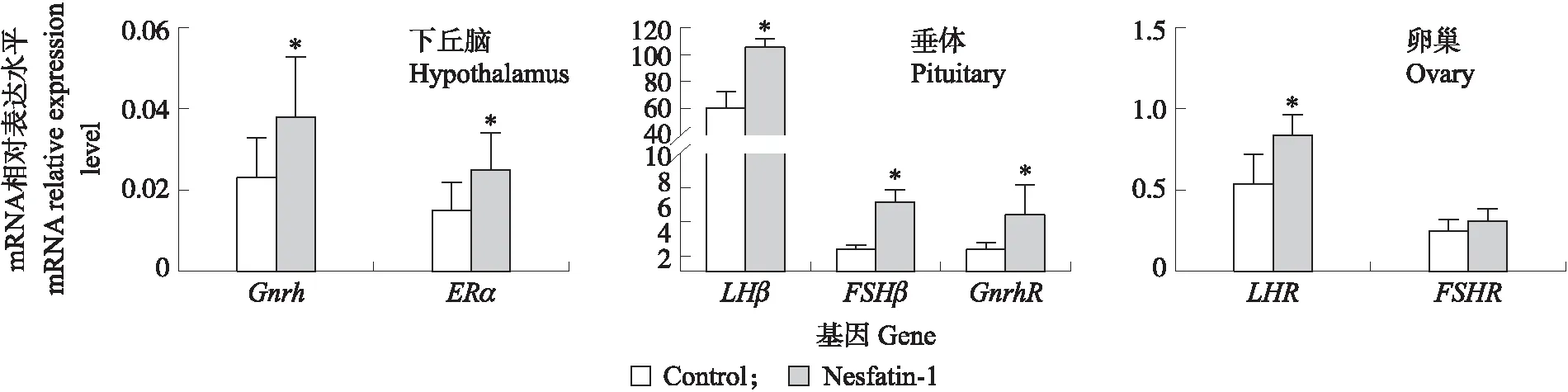
图4 Nesfatin-1对雌性大鼠生殖轴上生殖相关基因表达的影响Fig.4 Effects of Nesfatin-1 on expression of reproduction related genes in reproductive axis of female rats mRNA
3 讨论
3.1 Nesfatin-1在雌性大鼠生殖轴上的表达
Nesfatin-1在雌性SD大鼠下丘脑的ARC、PVN、LHA和SON等部位表达丰富,与前人在猪[15]和雄性大鼠[16]下丘脑上的研究结果一致。形态学研究表明在下丘脑多个核团分布着 GnRH 神经元胞体及纤维,而与动物摄食、能量平衡以及生殖内分泌功能调节相关的神经元大部分也分布于此[17],Nesfatin-1/Nucb2 免疫阳性神经元在下丘脑的分布提示其可能在动物的能量代谢和生殖调节中起桥梁作用。Nesfatin-1免疫阳性细胞表达于腺垂体,而神经垂体未见其表达,腺垂体分泌生长激素、催乳素、促性腺激素,由此推测Nesfatin-1可能作用于GnRH神经元,或者直接作用于脑垂体,进而通过调控FSH和LH的释放来参与生殖调控。在卵巢中Nesfatin-1主要定位于卵母细胞、间质细胞、黄体细胞及颗粒细胞,表明其可能直接参与卵巢的功能。本试验中Nesfatin-1在雌性大鼠生殖轴的定位结果提示,Nesfatin-1可能在生殖轴具有系统性的调控作用,这为进一步研究其调控生殖的作用机制在形态学上提供了参考依据。
3.2 Nesfatin-1/Nucb2、Tac2、Gnrh mRNA在不同发育阶段的雌性大鼠下丘脑的表达
本试验结果显示,在雌性大鼠的不同发育阶段中Tac2与Nucb2mRNA表达呈正相关,这与García-Galiana等[8]对大鼠的研究结果相一致,提示两者对初情期的调控可能具有相似的效应。而GnrhmRNA与Nucb2、Tac2mRNA 表达不一致的原因可能是GnrhmRNA激活晚于Nucb2、Tac2mRNA,并作为一个下游的调控因子。在大鼠中,神经激肽B(Neurokinin B,NKB)由Tac2基因编码表达,初情期雌性大鼠NKB-NK3R信号能够增加 GnRH、LH 分泌,作为初情期启动因子,与kisspeptin等一起可刺激 GnRH 的释放,这在不同物种上也得到了证实[18-21]。研究表明雌性大鼠外源性注射NKB蛋白可使阴门开启时间显著提前,GnrhmRNA表达水平显著提升[22]。因此,初情期前Nucb2mRNA 的高表达可能通过某种机制促进 GnRH神经元的活化,从而激发性腺轴进而促进初情期启动,这也暗示Nesfatin-1的表达与初情期启动有潜在联系。
3.3 侧脑室注射Nesfatin-1对雌性大鼠初情期的影响
初情期启动是由下丘脑-垂体-性腺轴(HPGA)活化引起的[23-24],当HPGA活化引起GnRH脉冲分泌频率和振幅增加[25],作用于垂体前叶FSH和LH分泌细胞上的 GnRH受体促进垂体LH和FSH的分泌,后两者作用于性腺,刺激卵巢分泌E2,从而促进生殖器官快速发育及性征的快速出现,启动初情期。本试验中侧脑室注射Nesfatin-1 后大鼠血清E2浓度及下丘脑ERαmRNA表达水平显著升高,阴门开启时间提前,说明Nesfatin-1促进大鼠初情期启动,这与对大鼠侧脑室持续存在抗Nesfatin-1的as-MONs使其下丘脑Nucb2含量下降,阴道开放延迟,卵巢重下降的结果相互验证[8]。侧脑室注射Nesfatin-1后大鼠下丘脑GnrhmRNA与垂体中的GnrhRmRNA表达水平均显著提升,表明Nesfatin-1可通过调节GnrhmRNA来调控初情期,与体外用Nesfatin-1刺激下丘脑神经元释放GnRH的结果相吻合[26]。侧脑室注射Nesfatin-1后垂体FSHβ、LHβmRNA及卵巢中LHRmRNA表达水平均显著上调,这可能与Nesfatin-1/Nucb2显著增加雌性大鼠下丘脑GnrhmRNA 水平从而调控垂体FSHβ、LHβmRNA有关;而卵巢中FSHRmRNA的表达水平没有差异,说明Nesfatin-1对FSHR与LHR的调控并不完全一致。本试验结果提示:Nesfatin-1可能提前激活下丘脑GnRH神经元脉冲性的释放,从而激活下丘脑-垂体-卵巢轴(HPOA),进而引起初情期的提前启动,但是其具体神经内分泌的机制还有待进一步研究。
综上所述,本试验结果表明Nesfatin-1在雌性大鼠HPOA上广泛表达,且从幼年期到成年期呈先上升后下降的变化规律;侧脑室注射 Nesfatin-1可以引起雌性大鼠HPOA轴中Gnrh、GnrhR、FSHβ、LHβ、LHR、ERαmRNA表达水平的改变,导致雌性大鼠初情期提前。这些结果为探讨性早熟的发生机制以及动物生产实践中提早启动初情期提供理论依据。

