毛喉素诱导猪卵泡颗粒细胞体外分化机制的研究
于昊,李曼曼,薛洋,姜志洋,茆达干
(南京农业大学动物科技学院家畜繁殖研究室/动物科学类国家级实验教学示范中心,江苏 南京 210095)
卵巢黄体是成熟卵泡排卵后形成的一个暂时性内分泌腺体,对卵巢周期性调节和妊娠维持具有重要作用。卵泡排卵后,颗粒细胞逐渐分化成大黄体细胞,与卵泡内膜细胞分化成的小黄体细胞一起构成黄体的重要组成部分[1]。分化的颗粒细胞主要分泌孕酮(progesterone,P4)以维持黄体的功能,然而由于某些原因未排卵的颗粒细胞亦会黄素化引起黄体囊肿从而引起繁殖障碍。因此研究颗粒细胞的正常分化对揭示黄体形成的分子机制具有重要意义。
毛喉素(forskolin,FSK)作为腺苷酸环化酶(cyclic adenosine monophosphate,cAMP)的激动剂可增加胞内cAMP浓度[2],激活蛋白激酶A(protein kinase A,PKA)参与细胞代谢的多种过程[3]。研究表明,FSK可通过PKA下游的cAMP效应元件结合蛋白(cAMP-response element-binding protein,CREB)和Epac1-Rap1信号诱导小鼠巨噬细胞增殖[4];FSK还可以上调未成年大鼠卵泡颗粒细胞雌激素β亚型受体[5],提示FSK有利于颗粒细胞的增殖代谢。Shrestha等[6]发现,FSK诱导的cAMP升高激活了纤维生长因子2并维持牛颗粒细胞的增殖和存活。Bahmanpour等[7]发现,在与颗粒细胞共培养的小鼠胚胎干细胞中加入FSK可以促进胚胎干细胞向生殖样细胞分化;FSK还可以通过减少抗凋亡蛋白加速乳腺癌细胞的凋亡[8]。
鉴于复杂的生物学功能,FSK在细胞培养中广泛应用于促进细胞的增殖、分化或凋亡,而FSK对猪卵泡颗粒细胞分化的分子机制未见详细报道。本试验通过FSK处理体外培养的猪卵泡颗粒细胞,研究其对细胞分化及细胞周期等的影响,为颗粒细胞体外分化模型的建立提供新方法,为研究卵巢卵泡-黄体转化的分子机制提供理论依据。
1 材料与方法
1.1 试验材料
试验所用卵巢从当地屠宰场采集。FSK(F6886)购自Sigma公司;M199培养基、磷酸盐缓冲液(PBS)、胰蛋白酶和青(链)霉素购自Wisent公司;胎牛血清(FBS)购自Gibco公司;油红O试剂盒、CCK-8试剂盒购于Solarbio公司;放射免疫试剂盒购于北方生物技术研究所;RNA提取试剂盒购于TaKaRa公司;RT-qPCR试剂盒购于Vazyme公司。鉴定所用的颗粒细胞标记物促卵泡素受体(follicle-stimulating hormone receptor,FSHR)(A3172)抗体购于AB clonal公司。Western blot试验所用StAR(A1035)和 3β-HSD(A1823)抗体购于AB clonal公司,P450scc(DF6569)抗体购于Affinity公司,ATF3(SC-81189)抗体购于Santa Cruz公司,α-Tubulin(ABM-0010)抗体购于南京钟鼎生物技术有限公司。
1.2 方法
1.2.1 颗粒细胞的分离、培养与鉴定从南京某屠宰场采集母猪卵泡期卵巢,保温并2 h内带回实验室。选取中等大小(直径5~8 mm)的卵泡抽取卵泡液。1 000 r·min-1离心5 min后用M199基础培养基洗涤细胞沉淀3次,完全培养基(含M199基础培养基、5%FBS、100 μg·mL-1双抗)调整细胞含量为1×106mL-1,接种于T75培养瓶,置于37 ℃、5%CO2培养箱中培养过夜。第2天更换新鲜培养基,除去红细胞、卵母细胞及死细胞等不贴壁细胞。每隔1 d更换培养基,待细胞汇合度达70%时传代培养。参照Yousefi等[9]方法进行免疫荧光染色鉴定。封片后于荧光倒置显微镜(Axiovert 40C/CFL,Zeiss)下观察染色情况。
1.2.2 FSK作用浓度的筛选FSK用1 mL二甲基亚砜(DMSO)配成储存浓度,试验前用完全培养基稀释成工作浓度。将处于对数生长期的细胞传代,重新接种于96孔细胞培养板中,待细胞汇合度达到90%时,用不同浓度(0、0.1、1、10、100 μmol·L-1)FSK处理24 h。CCK-8法检测各组细胞的存活率。
1.2.3 试验分组与处理将细胞分为2组,每组至少3个重复。空白对照(CON)组:M199完全培养基培养细胞;FSK处理(FSK)组:先用M199完全培养基培养细胞24 h,再用10 μmol·L-1FSK处理细胞。
1.2.4 油红O染色具体步骤按照油红O染色试剂盒(G1262)说明书。染色完成后用纯异丙醇萃取油红O染液,酶标仪(Multiskan Fc,Thermo Fisher公司)测定510 nm处的吸光值(A510)。
1.2.5 CCK-8法测定细胞活力将细胞重悬后铺至96孔板中,待4 h细胞贴壁后,加入FSK分别处理0、24、48、72、96、120 h后,每孔加入10 μL CCK-8溶液,置于培养箱中孵育4 h,酶标仪测定450 nm处的吸光值(A450)。
1.2.6 放射免疫法(radioimmunoassay,RIA)测定P4含量分别收集FSK处理不同时间(0、24、48、72、96 h)的细胞培养上清液,应用RIA-P4试剂盒(S10940094)检测P4含量。
1.2.7 Western blot检测蛋白的表达具体步骤参照Bond等[10]的方法。检测类固醇合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)、胆固醇侧链断裂酶(cytochrome P450 side-chain cleavage enzyme,P450scc)、3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)和转录激活因子3(activating transcription factor 3,ATF3)蛋白的表达水平,以α-Tubulin为内参蛋白。Image J软件分析条带的灰度值。
1.2.8 RT-qPCR检测基因的表达在NCBI网站查找相关基因序列,利用Primer Premier 6.0软件设计基因引物(表1)。参照RNA提取试剂盒(9108)说明书提纯RNA,用反转录(RT)试剂盒(R212-01)反转录成cDNA。用qPCR试剂盒(R222-01)检测相关基因表达水平。以GAPDH为内参基因,反应产物经熔解曲线检测特异性。用2-ΔΔCT法计算目的基因的相对表达量。
1.2.9 细胞发育周期的流式细胞术测定收集1×106mL-1单细胞悬液1 mL,参照细胞周期检测试剂盒(KGA511)说明书处理细胞,设定流式仪(FACSCalibur,B&D公司)参数并检测细胞的周期。
1.3 数据的统计分析
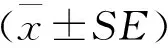
2 结果与分析
2.1 猪卵泡颗粒细胞培养与鉴定
FSHR是猪卵泡颗粒细胞特异性表达的蛋白,采用免疫荧光染色法对所培养的细胞进行鉴定。如图1所示:绿色荧光为FSHR的特异性表达(图1-a);蓝色荧光为细胞核(图1-b)。视野中超过90%细胞的FSHR表达为阳性,说明分离培养的细胞为颗粒细胞。

图1 猪卵泡颗粒细胞促卵泡素受体(FSHR)的免疫荧光鉴定Fig.1 Identification of porcine follicular granulosa cells follicle-stimulating hormone receptor(FSHR)by immunofluorescencea. 促卵泡素受体荧光染色 Fluorescence staining of FSHR;b. 细胞核DAPI染色 DAPI staining of nucleus;c. 合成图 Merged graph.
2.2 不同浓度FSK对颗粒细胞活力的影响
如图2所示:用不同浓度FSK处理颗粒细胞24 h,当FSK浓度为0.1~10 μmol·L-1时,细胞存活率与对照组无显著差异(P>0.05);当FSK浓度为100 μmol·L-1时,细胞存活率显著低于对照组(P<0.05),故选择10 μmol·L-1为本试验的FSK作用浓度。
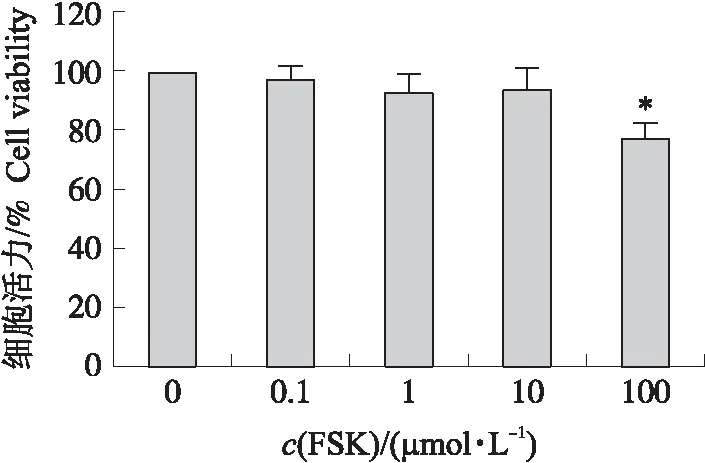
图2 FSK浓度对猪卵泡颗粒细胞活力的影响Fig.2 Effects of FSK concentration on the viability of porcine follicular granulosa cells*P<0.05.
2.3 FSK对颗粒细胞形态的影响
如图3所示:对照组细胞(正常颗粒细胞)与成纤维样细胞形态相似,细胞狭长,排列紧密,呈流线或放射状(图3-a);10 μmol·L-1FSK处理组细胞与上皮样细胞形态类似,细胞呈扁平不规则的多角形或星形(图3-b)。对照组直径13~20 μm的细胞较多,约占58%;FSK组直径21~28 μm和29~40 μm的细胞较多,共约占细胞总数52%(图3-c)。说明FSK改变颗粒细胞形态及大小。
本题源于教材,考查抛物线定义.学生若应用抛物线的定义,则可避免繁琐计算,简洁明快地解决问题.定义体现了数学的本质,本题通过对抛物线定义的考查,让学生体会数学本质的简单美.如果考生能够运用定义及参数的几何意义,结合图形,则可通过心算得到答案.这样的设计体现了“多想少算”的命题理念.

图3 10 μmol·L-1 FSK对猪卵泡颗粒细胞形态的影响Fig.3 Effects of 10 μmol·L-1 FSK on the morphology of porcine follicular granulosa cellsa. 对照组细胞形态 Cell morphology in control group;b. FSK处理组细胞形态Cell morphology in FSK group;c. 细胞大小统计 Cell size statistics。CON:对照组 Control group;FSK:10 μmol·L-1 FSK处理组10 μmol·L-1 FSK-treated group。下同The same below.
2.4 FSK对颗粒细胞脂滴含量的影响
用油红O鉴定细胞中脂滴含量的结果显示:对照组颗粒细胞内脂滴含量较少(图4-a),而FSK处理颗粒细胞48 h后,可观测到细胞内脂滴数量较对照组明显增多(图4-b)。脂滴定量结果(图4-c)显示:与对照组相比,FSK处理组细胞内脂滴含量极显著增加(P<0.01)。
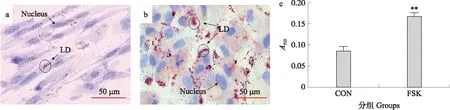
图4 FSK对猪卵泡颗粒细胞脂滴积聚影响的油红O染色鉴定Fig.4 The oil red O staining for identification of the effects of FSK on the lipid drops aggregation of porcine follicular granulosa cellsa. 对照组 Control group;b. FSK处理组 FSK group;c. 脂滴含量比较 Lipid drop content comparation.Nucleus:细胞核;LD:脂滴 Lipid drops. ** P<0.01. 下同The same as follows.
2.5 FSK对颗粒细胞增殖活性的影响
与对照组(0 h)相比,FSK处理24 h后,细胞的增殖活性无显著变化(P>0.05);而FSK处理48 h以后,细胞增殖活性与对照组相比均极显著降低(P<0.01,图5-a)。RT-qPCR结果(图5-b)显示:FSK处理细胞48 h后,FSK组增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)基因表达量极显著低于对照组(P<0.01)。
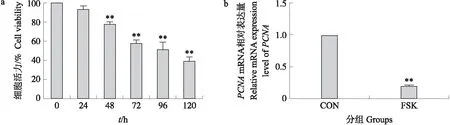
图5 FSK对猪卵泡颗粒细胞增殖活力的影响Fig.5 Effects of FSK on the cell viability of proliferation of porcine follicular granulosa cellsa. CCK-8试剂盒检测细胞增殖活力Cell viability detected by CCK-8 kit;b. RT-qPCR检测PCNA基因相对表达量 Relative gene expression level of PCNA detected by RT-qPCR.
2.6 FSK对颗粒细胞孕酮分泌及类固醇合成相关蛋白表达的影响
用RIA检测细胞培养上清液中P4含量,结果(图6-a)显示:与对照组(0 h)相比,FSK处理颗粒细胞48 h后,培养上清液中P4含量均极显著增加(P<0.01)。应用Western blot检测细胞中类固醇合成相关蛋白表达水平,结果(图6-b)显示:FSK处理颗粒细胞24 h起,StAR、3β-HSD蛋白水平相较于对照组均极显著增加;FSK处理颗粒细胞48 h起,P450scc蛋白水平相较于对照组均极显著增加(P<0.01)。
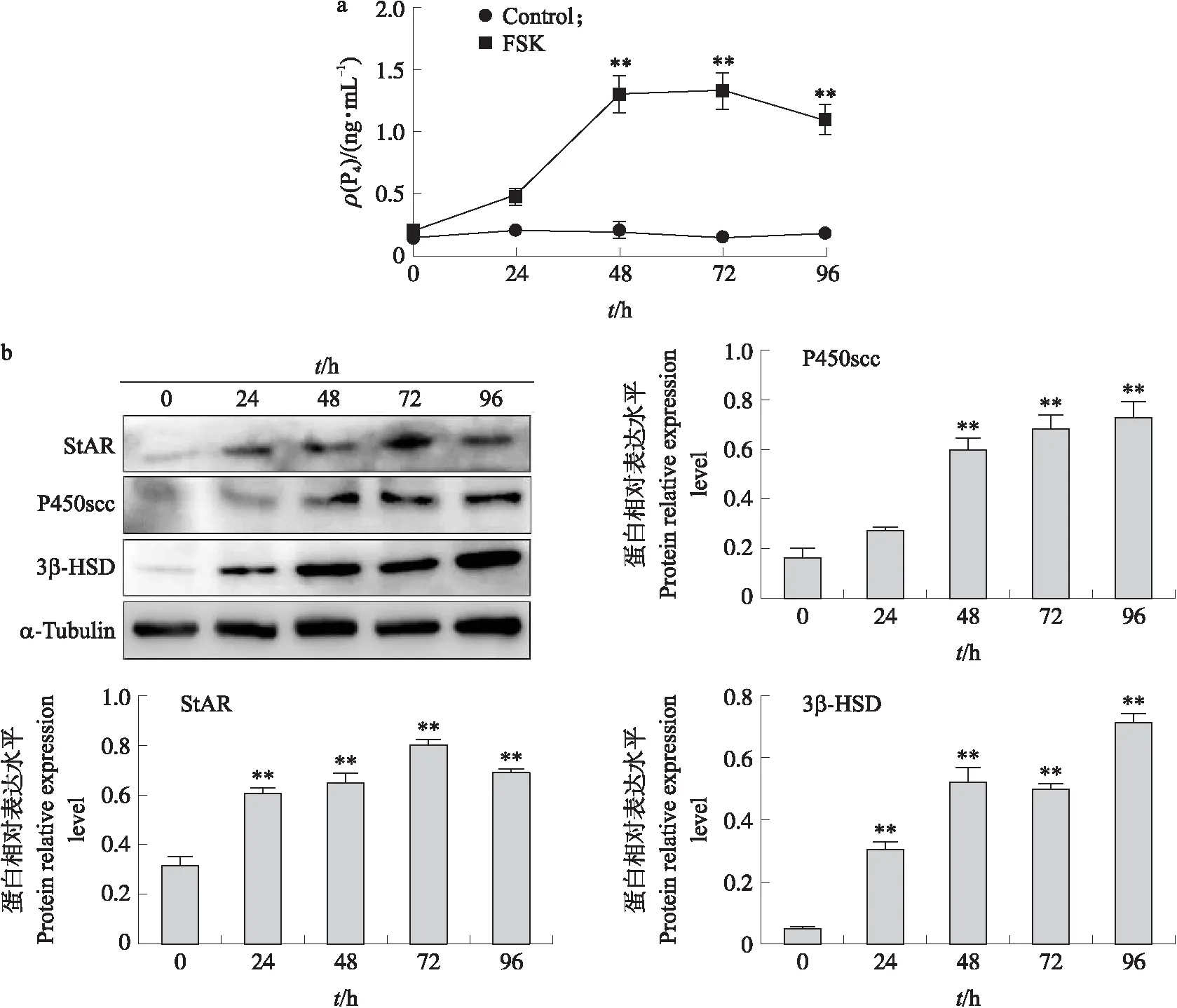
图6 FSK对猪卵泡颗粒细胞孕酮(P4)分泌(a)及类固醇合成相关蛋白表达(b)的影响Fig.6 Effects of FSK on progesterone(P4)level(a)and steroidogenic proteins expression level(b)of porcine follicular granulosa cellsStAR:类固醇合成急性调节蛋白 Steroidogenic acute regulatory protein;P450scc:胆固醇侧链断裂酶 Cytochrome P450 side-chain cleavage enzyme;3β-HSD:3β-羟基类固醇脱氢酶 3β-hydroxysteroid dehydrogenase.
2.7 FSK对标记基因表达的影响
应用RT-qPCR检测颗粒细胞标记基因FSHR和黄体细胞标记基因PTGFR、LHCGR的表达水平。结果(图7-a)显示:与对照组相比,FSK处理48 h后,FSHR基因表达水平极显著降低,PTGFR和LHCGR基因表达水平极显著升高(P<0.01),说明FSK处理降低了颗粒细胞标记基因的表达水平,提高了黄体细胞相关标记基因的表达水平。
此外,应用前列腺素F2α(prostaglandin F2α,PGF2α)处理颗粒细胞0~8 h,检测到FSK组的ATF3蛋白在1~2 h时表达上调(P<0.01,图7-c),而对照组ATF3蛋白无显著变化(P>0.05,图7-b),说明FSK组细胞已具备PGF2α敏感性,可以作为黄体类固醇生成细胞的模型。
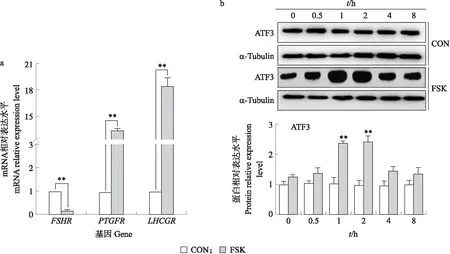
图7 FSK对猪卵泡颗粒细胞标记基因(a)及转录激活因子3(ATF3)蛋白(b)表达的影响Fig.7 Effects of FSK on marker genes(a)and activating transcription factor 3(ATF3)proteins(b)expression of porcine follicular granulosa cells
2.8 FSK对细胞周期相关基因表达的影响
应用RT-qPCR检测细胞周期相关基因表达水平。如图8-a所示:与对照组相比,FSK处理48 h后细胞周期素E1(cyclin E1,CCNE1)基因表达水平无显著变化(P>0.05),细胞周期素B1(cyclin B1,CCNB1)、细胞周期素D1(cyclin D1,CCND1)基因表达水平极显著降低(P<0.01)。如图8-b所示,与对照组相比,细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)和细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)基因表达水平均极显著降低(P<0.01),细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)基因表达水平无显著变化(P>0.05),细胞周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,P21cip1)和细胞周期蛋白依赖性激酶抑制剂1B(cyclin-dependent kinase inhibitor 1B,P27kip1)基因表达水平均极显著升高(P<0.01)。说明FSK处理后,对细胞周期起正向调控的基因表达下调,同时对细胞周期负向调控的基因表达上调。
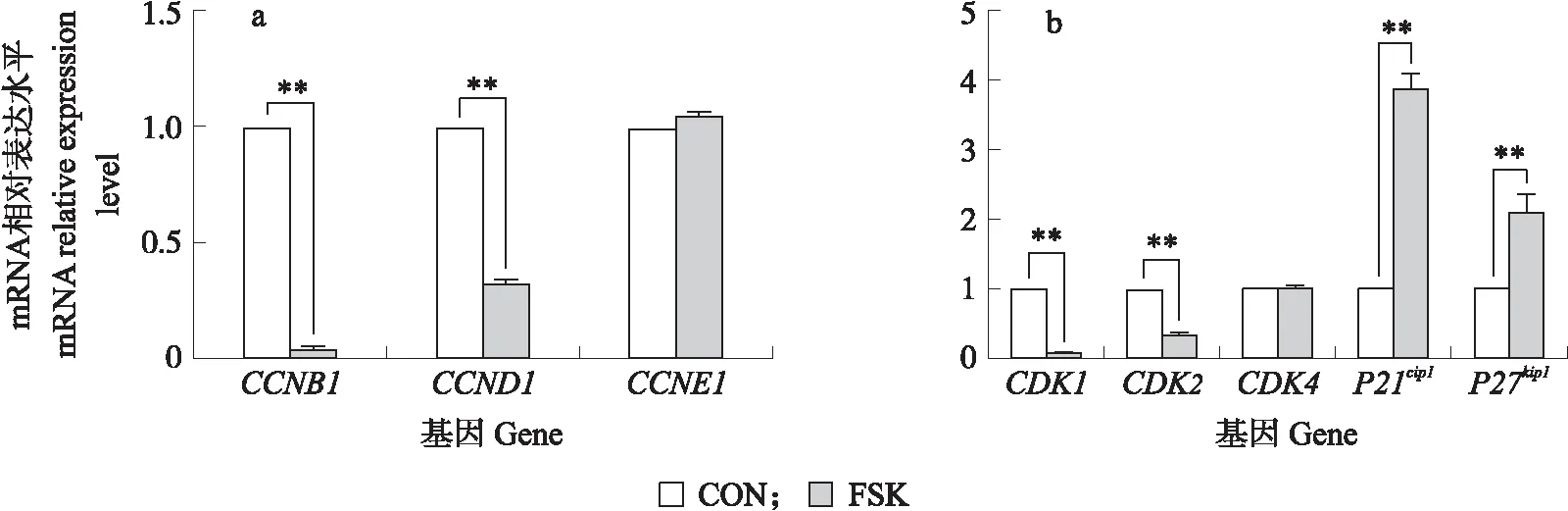
图8 FSK对猪卵泡颗粒细胞周期素基因(a)及其相关酶基因(b)表达的影响Fig.8 Effects of FSK on cyclin(a)and relative enzyme(b)genes expression of porcine follicular granulosa cells
2.9 FSK对细胞周期的影响
3 讨论
3.1 FSK处理对颗粒细胞形态的影响
颗粒细胞的分化过程伴随着细胞形态的改变。Ohleth等[11]用LH处理猪颗粒细胞4 d后观察到细胞形态由纤维样变为上皮样,本研究FSK处理的结果与之相似。Tosca等[12]研究表明,培养液中添加血清可以促进牛卵泡颗粒细胞黄体化;而本试验中血清并未使猪颗粒细胞形态发生显著变化。FSK可以引起多种细胞如心肌纤维、血管内皮细胞的形态变化[10,13],这可能与高浓度的cAMP使肌动蛋白骨架发生重构有关[14]。黄体发育不仅体现在血管和细胞数量增多,还体现在细胞体积的增大,尤其是发育后期的大黄体细胞体积可增大37%[15]。本试验中FSK处理颗粒细胞48 h后细胞形状和大小发生的变化与体内黄体发育过程相一致,说明FSK诱导颗粒细胞向正常黄体细胞发生了形态学分化。
3.2 FSK处理对颗粒细胞脂滴含量的影响
脂滴积聚是黄体细胞形成的重要标志。脂滴作为重要的细胞器参与脂类代谢、跨膜运输、细胞信号传导等过程。类固醇激素以胆固醇为原料,而脂滴是类固醇生成细胞中胆固醇储存的主要形式。Liu等[16]发现FSK处理大鼠脂肪细胞可以诱发细胞内脂滴的重塑。Prates等[17]也发现FSK处理可以提高猪卵母细胞中部分脂肪酸的含量。此外,Gout等[18]研究表明FSK可以提高细胞内C/EBP家族水平,后者被证明是脂质生成的主要调节因子[19]。本试验中FSK处理引起的小脂滴含量的增多与体内LH诱导的正常颗粒细胞黄体化过程类似,都增强了细胞对胆固醇的摄取,加速脂滴积聚,为细胞大量合成类固醇激素提供了必要条件。
3.3 FSK处理对颗粒细胞孕酮分泌及类固醇合成相关蛋白表达的影响
黄体细胞合成P4需要大量的胆固醇作为来源,其合成过程中需要StAR、P450scc和 3β-HSD这3种关键蛋白,这3种蛋白也被认为是颗粒细胞分化的标志[20]。位于线粒体外膜的StAR可以将胆固醇从细胞质转移到线粒体内膜,这一过程是类固醇激素合成的限速步骤[21]。Gyles等[22]在小鼠肾上腺皮质Y1细胞中证实,FSK通过ERK通路磷酸化SF-1以促进cAMP依赖的StAR的基因和蛋白上调,本试验的结果与之相似,说明FSK诱导了颗粒细胞中StAR蛋白的上调,进而有利于脂滴中的胆固醇向线粒体内膜的运输。胆固醇进入线粒体后,相继被P450scc、3β-HSD催化形成P4[23-24]。Akgul等[25]发现杀虫剂的代谢物2,2-双(4-羟基苯基)-1,1,1-三氯乙烷(HPTE)可以通过降低P450scc蛋白的表达进而使小鼠卵巢颗粒细胞和膜间质细胞P4合成水平下降。Begeot等[26]发现FSK通过Spl或类Spl蛋白结合GA盒序列调控牛黄体P450scc的转录水平。Swart等[27]发现在H295细胞系中抑制3β-HSD可以降低FSK诱导的睾酮的分泌。本试验中FSK处理后细胞内P450scc和3β-HSD蛋白水平升高,提示P4的合成代谢正处于有利阶段,而P4的检测结果也证实FSK增强了P4的分泌,且与上述3种蛋白的升高趋势基本一致,说明FSK促进颗粒细胞向黄体细胞的分化。
3.4 FSK处理对颗粒细胞标记基因表达的影响
FSHR是颗粒细胞特异性表达基因,LHCGR和PTGFR是黄体细胞特异性表达基因[28]。本试验中FSK处理后FSHRmRNA表达下调,LHCGR及PTGFRmRNA表达上调,说明颗粒细胞正向黄体细胞转化。据报道,在牛和大鼠的卵巢中,PGF2α处理诱导黄体细胞ATF3的表达,而卵泡和血管中基本不表达ATF3;PGF2α处理体外培养的牛大黄体细胞亦激活ATF3的表达,而处理小黄体细胞则无明显效果[29-30]。本试验中FSK组细胞中ATF3蛋白表达上调,与大黄体细胞ATF3表达趋势类似,提示此时细胞已具备体内形成的正常黄体细胞对PGF2α的敏感性,进一步验证了颗粒细胞向黄体细胞的分化。
3.5 FSK处理对颗粒细胞增殖及细胞周期的影响
PCNA作为直接参与细胞核中DNA复制的辅酶,可以与多种细胞周期相关蛋白相互作用,是增殖活跃细胞的标记之一[31]。细胞周期素调节细胞周期中的关键节点。研究表明,CCND与CCNE促进细胞由G1期过渡到S期,而CCNB促进细胞由G2期向M期转变,是细胞进入有丝分裂期的关键蛋白[32]。Musa等[33]研究显示,FSK处理可以抑制平滑肌细胞CCND1的启动转录活性和蛋白丰度。Tremblay等[34]通过转录组学分析发现,FSK在人颗粒样肿瘤细胞系中通过PKC途径抑制了肝细胞生长因子活性,并下调CCNB1的表达。本试验中FSK处理48 h后颗粒细胞的增殖活性和PCNA、CCNB1、CCND1mRNA表达水平均下降,说明FSK抑制了颗粒细胞周期的正常进行。CDK与其相应的细胞周期素结合形成复合物,促进细胞的增殖,而CDKI与Cyclin-CDK复合物竞争性结合从而抑制细胞周期的进行[35]。本试验中FSK处理后,CDK1、CDK2mRNA水平的下降和CDKImRNA水平的升高,以及G0/G1期细胞数量的增多和S期细胞数量的减少,都进一步说明FSK对颗粒细胞周期的抑制作用。在母猪卵巢中,黄体类固醇生成细胞为终端分化细胞,正常情况下黄体类固醇生成细胞形成后将不再进行增殖,细胞周期处于停滞状态,本试验中FSK降低了CDK基因表达水平,增强了CDKI基因的抑制作用,从而抑制细胞进入细胞周期,进而将细胞周期阻滞在G0/G1期,结果与颗粒细胞体内分化的情况相符,即颗粒细胞发生了分化。
综上所述,在体外培养的猪卵泡颗粒细胞中加入FSK可以改变细胞形态,增强孕酮的合成代谢,抑制细胞增殖,使其退出细胞周期,促进颗粒细胞向黄体化细胞转换,这为颗粒细胞体外分化机制和黄体功能的研究奠定了基础。

