妇科住院患者尿路感染病原菌耐药性分析及产ESBLs大肠埃希菌基因分型研究
彭怡倩 高晶 陈艺升 陆子贇 应春妹
微生物(大多为细菌,极少数为真菌、原虫、病毒)在泌尿系统中繁殖而引起的泌尿系统炎症称泌尿系统感染,其发病率位居临床感染性疾病的第二位。尿路感染主要引起患者排尿困难和腰腿酸痛,如不能及时进行治疗将加重病情,甚至可以引起急、慢性肾功能不全和败血症等[1]。妇科患者受特殊解剖结构、手术部位、治疗后创伤、留置导管等一系列因素影响,更容易引起医院感染,尤其容易发生尿路感染[2]。产超广谱β-内酰胺酶(ESBLs)大肠埃希菌耐药性高于非产ESBLs大肠埃希菌,不同类型的耐药基因型菌株耐药性也有所不同,本研究标本皆来自妇科疾病尿路感染患者清洁中段尿,对培养分离的病原菌流行病学特征和耐药基因分型进行分析,为妇科疾病尿路感染患者临床合理使用抗菌药物预防和治疗以及院内感染的管理控制提供参考。
1 资料与方法
1.1 一般资料 收集2018年1月至12月本院妇科住院临床诊断为尿路感染患者(即有尿频、尿急、尿痛等症状,尿离心沉渣镜检白细胞计数大于10/HP)清洁中段尿883份,定量接种后培养检出病原菌且计数结果>105CFU/ml 321株。质控菌株为金黄色葡萄球菌ATCC29213、粪肠球菌ATCC29212、大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853,来源于上海市临检中心。
1.2 试剂与仪器 (1)试剂:哥伦比亚血琼脂培养基、麦康凯培养基和念珠菌显色培养基均是法国生物梅里埃公司生产;使用法国生物梅里埃VITEK-2 Compact全自动微生物鉴定药敏分析仪对菌株进行鉴定及药敏试验;真菌药敏试验使用法国生物梅里埃ATB-Fungus3手工药敏板条;药敏结果折点判定参考美国临床和实验室标准化协会(CLSI)M100-S27;PCR试剂GoTaq®DNA聚合酶和配套缓冲液5×GoTaq®Reaction Buffer购自Promega公司;细菌基因组提取试剂盒购自上海天根生化科技有限公司;DL2000 DNA marker、dNTP购自大连TaKaRa公司;50×TAE电泳缓冲液购自上海生工生物有限公司;10mg/ml溴化乙锭(EB)溶液购自Sigma公司。(2)仪器:PCR扩增仪cobasZ480(Roche公司);琼脂糖凝胶电泳仪3500(上海天能科技有限公司);紫外线投射凝胶成像系统GelDoc2000(美国Bio-rad公司);微型加热器(美国BD公司);台式超速离心机5804R(德国eppendorf公司);电热恒温水浴锅DK-S22型(上海精宏实验设备有限公司)。
1.3 培养方法 培养按照《全国临床检验操作规程(第4版)》[3]进行标本的留取和接种培养,采用10μl定量接种环取尿液标本,接种于哥伦比亚血琼脂平板及麦康凯琼脂平板,置于35℃,5%CO2培养18~24h,菌落计数≥105CFU/ml所分离得到的菌落进行鉴定、药敏试验表型分析及ESBLs基因型分析。
1.4 表型分析 根据CLSI M100-S29将产ESBLs的可疑菌株使用K-B法对头孢他啶/棒酸、头孢噻肟和头孢噻肟/棒酸进行扩散试验后,分别测量其抑菌圈直径,若该种药物的合剂抑菌圈的直径减去单剂抑菌圈的直径之差≥5mm即可判定为ESBLs阳性[4]。
1.5 ESBLs基因型分析 PCR扩增引物首先提取待检样本,采用25μl PCR反应体系,对产ESBLs的菌株耐药基因进行扩增分析。反应条件为:94℃5min预变性;94℃ 30s变性和55℃分别为45s退火,72℃ 1min延伸,30个循环后,再进行72℃ 5min最后延伸。用1%琼脂糖凝胶电泳分离PCR产物,凝胶成像系统观察结果,扩增产物由华大测序,测序结果进行在线比对(http://pubmlst.org/adatbases/)后,确定菌株基因型别,引物信息见表1。

表1 基因引物相关信息
1.6 统计学方法 应用WHONET5.6软件对细菌分布及耐药性情况进行分析,组间资料比较采用SPSS 18.0统计软件进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 妇科疾病尿路感染患者流行病学特征分析 883份清洁中段尿液标本检出病原菌321株,已剔除同一患者的相同菌株,阳性检出率36.4%。其中革兰阴性杆菌265株,占82.6%,以大肠埃希菌为主68.2%(219/321),其次为肺炎克雷伯菌4.7%(15/321);阳性球菌50株,占15.6%,以粪肠球菌为主12.2%(39/321);真菌6株,占1.8%,以白念珠菌为主。
2.2 细菌药敏试验结果分析 (1)革兰阴性杆菌:本院尿路感染患者中段尿培养检出数量最多的大肠埃希菌,对氨苄西林的耐药率为93.2%,对头孢菌素类抗菌药物耐药率为0.9%,喹诺酮类抗菌药物耐药率为49.8%~53.0%,未检出碳青霉烯类抗菌药物耐药菌株,对阿米卡星耐药率为4.1%,对β-内酰胺酶抑制剂的复合制剂如哌拉西林/他唑巴坦耐药率为1.4%,对氨苄西林/舒巴坦耐药率为50.7%。(2)革兰阳性球菌:本院尿路感染患者中段尿培养检出的革兰阳性球菌,未检出对万古霉素、利奈唑胺耐药的菌株,对青霉素、氨苄西林及喹诺酮类抗菌药物耐药率高于90%,对喹诺酮类抗菌药物耐药率为5%。(3)真菌:检出的真菌主要以白念珠菌和光滑念珠菌为临床常见真菌,对5-氟胞嘧啶和两性霉素耐药率为0%。白念珠菌对伊曲康唑、伏立康唑、氟康唑耐药率分别为50.0%、33.3%、33.3%。(4)产ESBLs和非产ESBLs大肠埃希菌耐药率:在219株大肠埃希菌临床标本中产ESBLs的大肠埃希菌检出率为70.3%(154/219),对氨苄西林的耐药率为100%,喹诺酮类抗菌药物耐药率为54.5%~57.8%,未检出碳青霉烯类抗菌药物耐药菌株,对阿米卡星耐药率为3.9%,对β-ESBLs抑制剂的复合制剂如哌拉西林/他唑巴坦耐药率为0%,对氨苄西林/舒巴坦耐药率为50.7%。产ESBLs和非产ESBLs大肠埃希菌耐药性的比较结果显示,对常见抗生素耐药率有显著差异。见表2。(5)产ESBLs大肠埃希菌耐药基因型分析:本研究对154株产ESBLs大肠埃希菌耐药基因型进行研究,对主要的三种基因型CTX、TEM和OXA进行检出,基因凝胶电泳部分检测结果见图1~3,检出率分别是66.7%、55.0%和13.3%,同时分别对携带三种不同耐药基因的产ESBLs大肠埃希菌进行耐药性分析。携带三种不同耐药基因的大肠埃希菌对哌拉西林/他唑巴坦、碳青霉烯类药物(亚胺培南和美罗培南)、4代头孢菌素(头孢吡肟)和头孢他啶均敏感,对氨苄西林、头孢唑啉和头孢曲松全耐药。氨基糖苷类中庆大霉素和磺胺类的复方新诺明的耐药率较高,呋喃妥因耐药率较低,见表3。(6)携带不同耐药基因的产ESBLs大肠埃希菌在不同病房分布的流行病学分析:按楼层将妇科病房进行分组,对产ESBLs大肠埃希菌携带的三种不同耐药基因检出率进行χ2检验,携带CTX基因和OXA基因的菌株在不同病房的分布有显著差异(P<0.05),在不同楼层的病房有水平传播并爆发流行的风险;携带TEM基因的菌株在各病房的分布结果无显著差异(P>0.05),未显示有水平传播并爆发流行的风险。
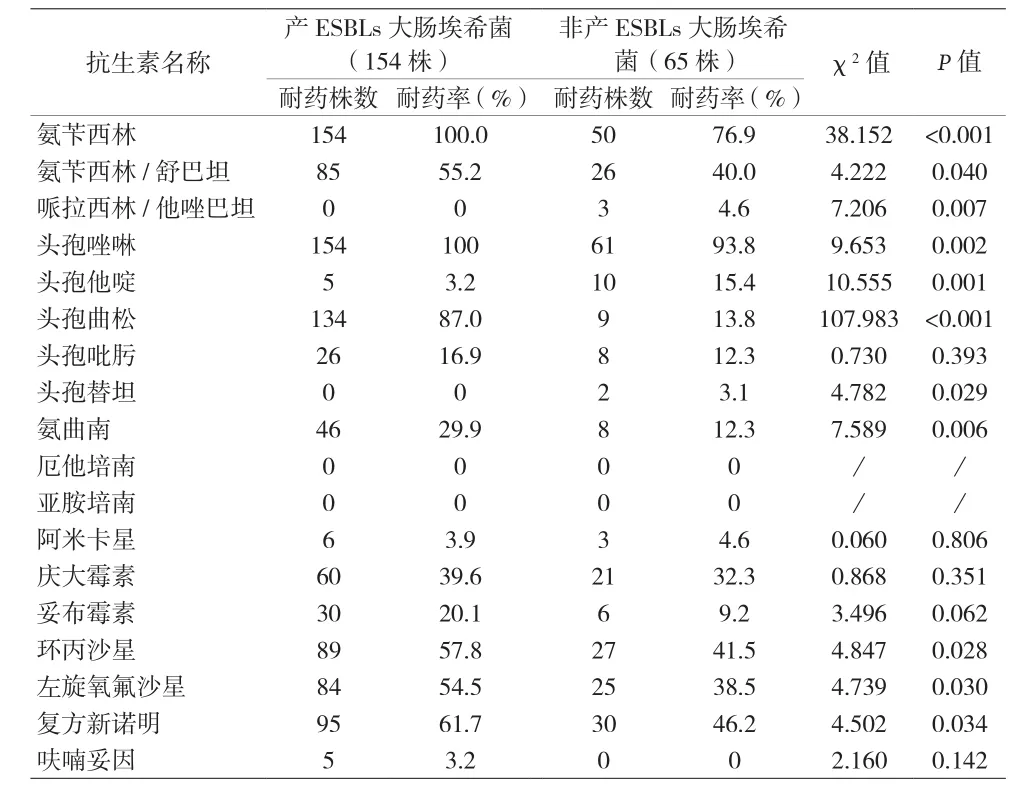
表2 产ESBLs与非产ESBLs大肠埃希菌耐药情况比较
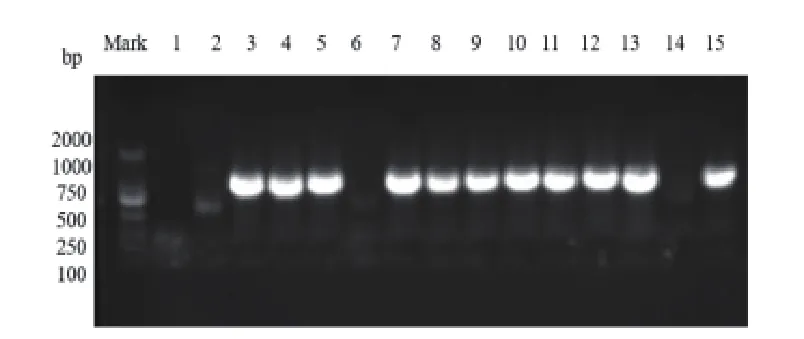
图1 CTX型基因凝胶电泳部分检测结果
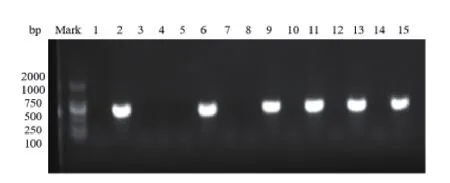
图2 TEM型基因凝胶电泳部分检测结果
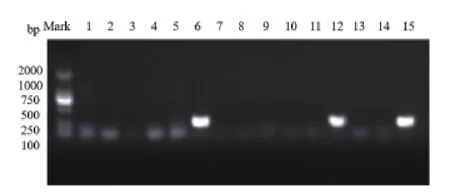
图3 OXA型基因凝胶电泳部分检测结果
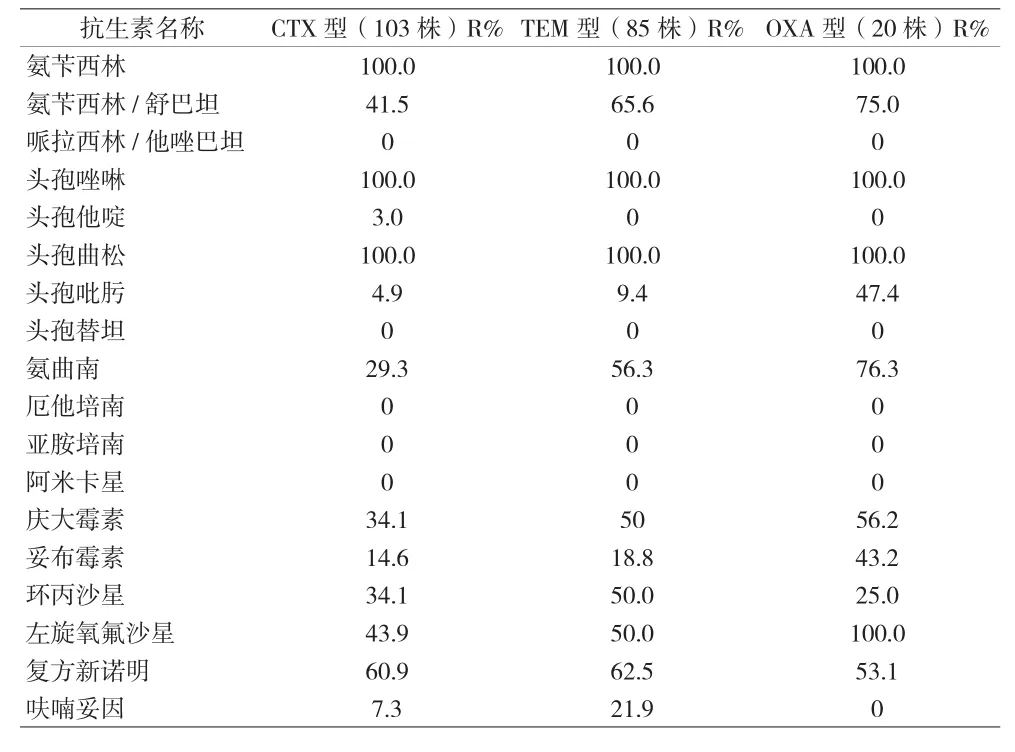
表3 产ESBLs大肠埃希菌各基因型耐药率
3 讨论
本药敏试验结果显示,321株菌株中未检出耐万古霉素肠球菌,与我国的耐药监测流行病学数据一致;检出的真菌主要以白念珠菌和光滑念珠菌为临床常见真菌,未检出对5-氟胞嘧啶和两性霉素耐药的菌株。阴性杆菌以大肠埃希菌为主要致病菌,219株大肠埃希菌对碳青霉烯类亚胺培南、厄他培南均敏感。亚胺培南具有广泛的活性和稳定的β-内酰胺酶,这些特性使亚胺培南成为治疗肠杆菌科、厌氧菌、铜绿假单胞菌和不动杆菌严重感染的重要治疗手段。但碳青霉烯类抗菌药物抗菌谱较广,容易导致二重感染,临床一般选择此类药物时会比较谨慎。碳青霉烯类药物耐药性的产生机制非常复杂,主要是通过产生碳青霉烯酶,但也可能是由于外膜孔蛋白功能障碍,再加上Ampc头孢菌素酶或ESBLs的过度产生所致。本研究检出的菌株对头霉素类头孢替坦、β-内酰胺/β-内酰胺酶哌拉西林/他唑巴坦、氨基糖苷类阿米卡星和呋喃妥因的耐药率也较低。哌拉西林/他唑巴坦耐药率低可能与其使用需要皮试以及有肾毒性相关,临床较少用于尿路感染。产ESBLs大肠埃希菌样本与非产ESBLs大肠埃希菌的样本比较,对抗菌药物的耐药性普遍更高,尿液是产ESBLs大肠埃希菌的主要标本来源。ESBLs能够对头孢菌素类药物、青霉素类药物及单环类药物进行水解,对哌拉西林、头孢噻肟和氨苄西林3种药物几乎无效,耐药率高达100%,是目前临床上革兰阴性菌中的主要耐药菌。除了头霉素类头孢替坦、β-内酰胺/β-内酰胺酶哌拉西林/他唑巴坦、氨基糖苷类阿米卡星和头孢三代霉素头孢他啶对产ESBLs大肠埃希菌更敏感。根据美国CLSI 规定,一旦患者被检出感染产EBSLs大肠埃希菌,则应立即停止使用青霉素类、头孢类、单环类抗菌药物,另选其他治疗方案[4]。既往研究认为,前期碳青霉烯类、含酶抑制剂的复合制剂类或氟喹诺酮类等抗菌药物使用是引起碳青霉烯类耐药肠杆菌或非发酵菌定植或感染的主要危险因素[5]。将产ESBLs大肠埃希菌和非产ESBLs大肠埃希菌对16种抗菌药物进行χ2检验,四代头孢、呋喃妥因和氨基糖苷类药物耐药率无显著差异(P>0.05)外,其他抗菌药物耐药率均有显著差异(P<0.05),因此根据细菌种类不同合理选用抗菌药物十分有必要。
ESBLs由于基因同源性差异分为5类:CTX型、TEM型、SHV型、OXA型和其它型(如土耳其的PER型、越南和泰国VEB型、巴西的BES型等)。国内外研究显示,不同类型的ESBLs分布具有明显的地域差异。由于不同国家和地区使用抗菌药物的种类和数量不同,ESBLs 流行的类型也不同,如意大利以SHV型、CTX-M型为主,加拿大以SHV型多见,亚洲其他国家也多以CTX型和TEM型为主[6-7],而国内主要以CTX和TEM型为主,部分地区也有OXA型,不过数量较少[8-9],故本文主要检测了CTX型、TEM型和OXA型三种耐药型基因。本研究结果以CTX型为主,TEM型次之。本文将妇科病房按不同楼层分成7组对三种基因型进行χ2检验比对,其中携带CTX基因和OXA基因的菌株在不同楼层病房分布有显著差异,有水平传播和暴发流行的趋势。携带三种耐药基因的不同菌株的耐药性也有差异,其中CTX型对青霉素类、头孢菌素类、β内酰胺酶抑制剂、氨基糖苷类和氟喹诺酮类耐药;TEM型能水解青霉素类、头孢菌素类、头霉素类、β内酰胺酶类/酶抑制剂复方剂,主要引起对β内酰胺酶类抗生素耐药;OXA型对青霉素类、四环素类、喹诺酮类抗菌药物有较高的耐药性。本文所检出的三种基因型对哌拉西林/他唑巴坦、碳青霉烯类药物、三代和四代头孢菌素均敏感。应根据菌株不同的类型和药敏结果提示临床合理使用抗菌药物,同时严格管控防止院内感染的发生。
随着抗菌药物在妇科感染领域的广泛使用,多重耐药菌检出率的提高引起广大临床医务工作者的高度重视。对于妇科尿路感染患者的病原菌耐药性研究和相关菌株耐药基因分型的研究,可以更有针对性为临床合理使用抗菌药物及院内感染的管理控制提供参考依据。

